人脐带间充质干细胞对猕猴糖尿病治疗效果的研究
阮光萍 刘菊芬 李自安 王金祥 庞荣清 潘兴华
人脐带间充质干细胞对猕猴糖尿病治疗效果的研究
阮光萍 刘菊芬 李自安 王金祥 庞荣清 潘兴华
目的通过用人脐带间充质干细胞(huMSCs)治疗猕猴糖尿病模型观察其血糖的变化。方法猕猴9只,分为对照组3只和模型组6只,模型组通过高糖高脂饮食及静脉注射链尿佐菌素(STZ)诱导成糖尿病模型,两组间比较用t检验。12周时再分为模型对照组3只和治疗组3只,治疗组每只每周静脉回输huMSCs 1×106个/kg,连续3周,每周检测各组血糖变化,三组间比较用方差分析。结果两组猕猴高糖高脂饮食喂养第8周时模型组空腹血糖值 [(22.00±3.00)mmol/L] 与对照组 [(4.75±0.20)mmol/L] 相比差异有统计学意义(t = 9.94,P < 0.01)。40周时1只猕猴因糖尿病死亡,病理切片证实心、肝、脾、肺、肾和胰腺均有病变,符合糖尿病特征。huMSCs治疗后,3周血糖连续下降,到第4周对照组、模型组、治疗组空腹血糖分别为(4.85±0.35)mmol/L、(18.20±1.00)mmol/L、(4.09±0.50)mmol/L,3 组差异有统计学意义(F = 388.10,P < 0.01)。两两比较结果表明对照组和模型组比较差异有统计学意义(t = 24.173,P < 0.01),模型组与治疗组比较差异有统计学意义(t = 25.549,P = 0.014)。结论STZ联合高糖高脂饲料能成功诱导出猕猴糖尿病模型,用huMSCs能有效降低血糖,使糖尿病猕猴恢复正常血糖,方法简便。
猕猴属; 糖尿病; 病理切片; 血糖; 脐带; 间质干细胞移植
糖尿病是一种严重危害人类生命健康的代谢性疾病,其发病率在世界范围内逐年上升,已成为继心脑血管疾病、肿瘤之后第3位严重的慢性非传染性疾病[1]。糖尿病将成为我国经济和社会发展的障碍。
糖尿病是一种代谢紊乱疾病,其发病率呈逐年上升趋势,与发达国家相比,我国糖尿病患者的绝对数已居世界首位[2-3]。寻找、开发高效的治疗糖尿病药物和全新的干细胞治疗方案,有极其深远的意义[4-5]。但在进行药效学研究时,如何建立理想、稳定的糖尿病动物模型,是许多研究者必须进行的前期工作。
复制与人体接近的糖尿病实验动物模型是进行糖尿病研究的关键环节之一,本实验用与人类最为接近的灵长类动物猕猴做为实验动物,将研究在高糖高脂饲料喂养条件下联合链脲佐菌素(streptozotocin,STZ)诱导猕猴糖尿病模型的建立。
人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,huMSCs)具有分泌造血生长因子、重建造血微环境、低免疫原性、易于外源基因转染和表达等优点,将其应用于猕猴糖尿病模型的临床治疗具有十分广阔的前景。而通过移植huMSCs治疗糖尿病猕猴,并观察疗效和安全性,如果huMSCs用于糖尿病猕猴是安全有效的,那么用于人类的糖尿病将更加安全和有效。
材料与方法
一、猕猴糖尿病模型的建立及评价
猕猴9只,购自中国医学科学院生物医学研究所,分为对照组3只和模型组6只,模型组给予高糖高脂饮食4周,然后静脉注射STZ,STZ先用0.1 mmol/L,pH值为4.3的柠檬酸盐缓冲液配成100 mg/ml浓度,猕猴称重后按30 mg/kg的剂量静脉注射STZ。注射后猕猴血糖升高,成模标准为:空腹血糖≥11.1 mmol/L连续4周。实验步骤通过昆明总医院实验动物伦理委员会批准。
成模后猕猴表现为多饮多食多尿体重减轻等典型糖尿病症状。1只猕猴因糖尿病症状明显,多饮多食多尿体重减轻,在40周时死亡,取心、肝、脾、肺、肾、胰腺做病理切片HE染色,观察糖尿病的内脏病变。另外,在对照组随机挑选1只猕猴,麻醉后,进行活检,取心、肝、脾、肺、肾、胰腺少许做病理切片HE染色,做为正常对照的结果。
病理切片HE染色按照常规方法进行,HE切片观察由专业人士进行。
二、huMSCs的分离培养
无菌留取huMSCs,用组织剪把脐带剪成长约2 ~ 3 cm的小段,剔除脐静动脉,冲去残余血迹,将脐带剪碎至1 ~ 2 mm3大小的组织块,接种于含DMEM/F-12完全培养基的T-75培养瓶中,置于37 ℃、5% CO2饱和湿度培养箱内培养。每隔2 ~4 d换液1次,待有成纤维样细胞爬出后1 ~ 2周去掉组织块。显微镜下观察细胞长至80%~ 90%融合时,用PBS缓冲液冲洗,含0.25%胰蛋白酶的消化液消化细胞,收集所得细胞即为原代细胞。将收集的原代细胞转移至离心管中,离心后弃上清液,加入适量DMEM/F-12完全培养基,以1:1的比例传代培养,计为第1代(Passage1,P1)脐带间充质干细胞。用第4代细胞进行移植治疗。
三、huMSCs移植治疗猕猴糖尿病模型
将第4代细胞消化下来,计数,给3只糖尿病模型猕猴静脉回输,按每公斤体重每只回输1×106个huMSCs,连续回输3周,每周检测3组猕猴的血糖变化,观察huMSCs治疗猕猴糖尿病的疗效及安全性。模型对照组输注生理盐水。
四、统计学分析方法
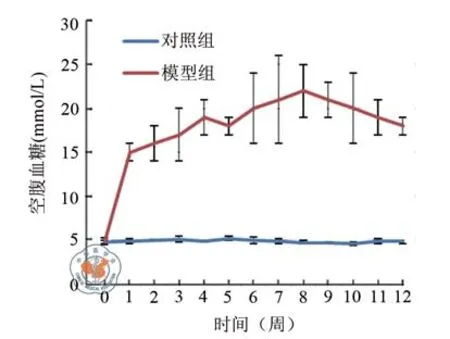
图1 经高糖高脂喂养后两组猕猴空腹血糖结果
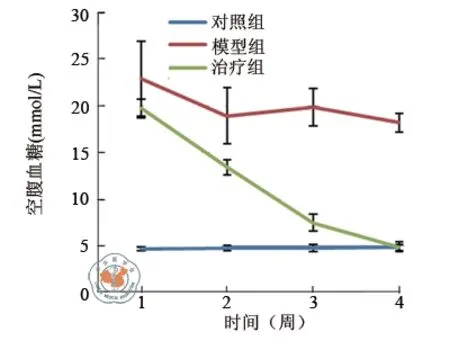
图2 经huMSCs治疗后3组猕猴空腹血糖结果比较
表1 经高糖高脂喂养后2组猕猴0 ~ 6周空腹血糖的结果(mmol/L,±s)
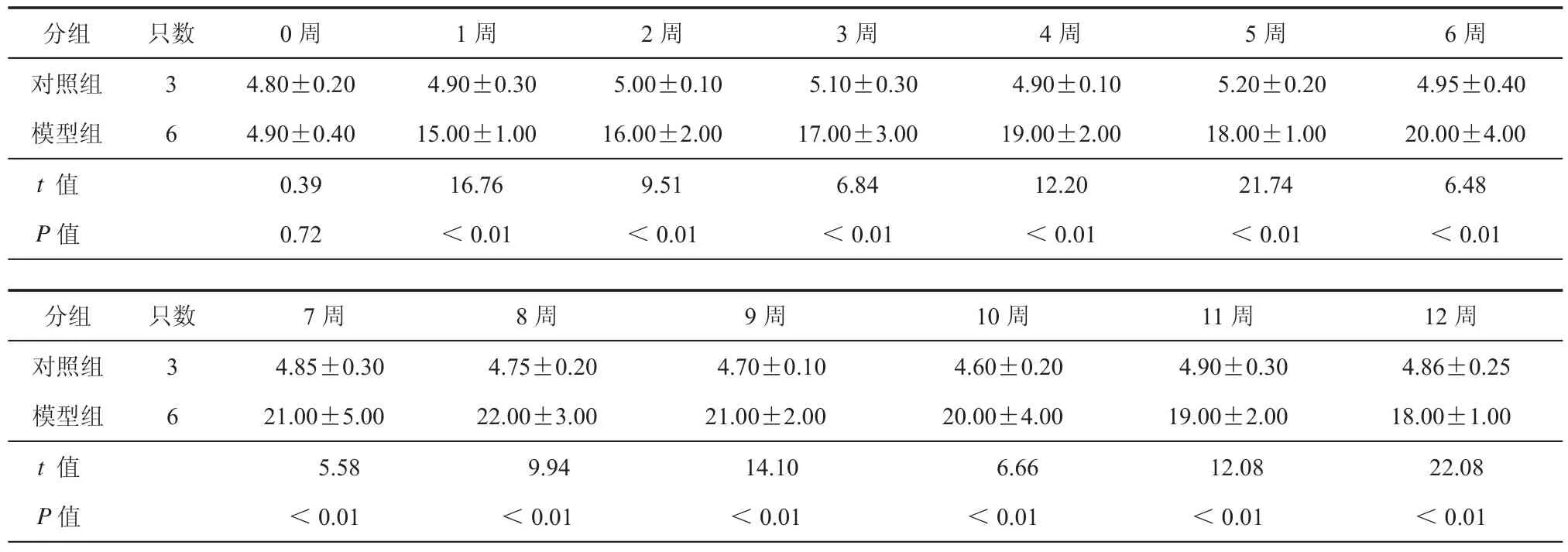
表1 经高糖高脂喂养后2组猕猴0 ~ 6周空腹血糖的结果(mmol/L,±s)
分组 只数 0周 1周 2周 3周 4周 5周 6周对照组 3 4.80±0.20 4.90±0.30 5.00±0.10 5.10±0.30 4.90±0.10 5.20±0.20 4.95±0.40模型组 6 4.90±0.40 15.00±1.00 16.00±2.00 17.00±3.00 19.00±2.00 18.00±1.00 20.00±4.00 t 值 0.39 16.76 9.51 6.84 12.20 21.74 6.48 P值 0.72 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01分组 只数 7周 8周 9周 10周 11周 12周对照组 3 4.85±0.30 4.75±0.20 4.70±0.10 4.60±0.20 4.90±0.30 4.86±0.25模型组 6 21.00±5.00 22.00±3.00 21.00±2.00 20.00±4.00 19.00±2.00 18.00±1.00 t 值 5.58 9.94 14.10 6.66 12.08 22.08 P值 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01
表2 经huMSCs治疗后3组猕猴空腹血糖的结果(mmol/L,±s)

表2 经huMSCs治疗后3组猕猴空腹血糖的结果(mmol/L,±s)
注 :与对照组比较,aP < 0.01,与模型组比较bP < 0.01
分组 只数 1周 2周 3周 4周对照组 3 4.65±0.20 4.75±0.30 4.80±0.40 4.85±0.35模型组 3 22.90±4.00a18.90±3.00a 19.80±2.00a 18.20±1.00a治疗组 3 19.70±1.00a 13.40±0.8ab7.50±0.90ab4.09±0.50bF值 50.16 47.07 115.77 388.10 P值 <0.01 <0.01 <0.01 <0.01
结 果
一、两组猕猴空腹血糖的检测结果
两组猕猴从高糖高脂饮食喂养开始,观察0 ~ 12 周的空腹血糖变化(图 1,表 1),空腹血糖≥11.1 mmol/L连续4周即诊断为猕猴糖尿病。
二、huMSCs治疗后每周3组猕猴血糖检测结果
huMSCs连续治疗3周,从第1周开始每周检测空腹血糖,连续检测4周,到最后一次治疗后1周,治疗组空腹血糖降至正常(图2,表2)。
三、病理组织结构变化
模型组肺组织实质化,肺组织结构消失(图3a),正常对照组肺脏结构正常(图3b);模型组肝组织可见多处局灶性肝细胞坏死(图3c),正常对照组肝脏结构正常(图3d);模型组脾小结区组织坏死,结构紊乱(图3e),正常对照组脾脏结构正常(图3f);模型组部分肾小管水肿,近曲小管刷状缘脱落(图3g),正常对照组肾脏结构正常(图3h);模型组局部心肌细胞核固缩,胞浆淡染,细胞坏死(图3i),正常对照组心脏结构正常(图3g);模型组胰岛结构纤维化改变(图3k),正常对照组胰腺结构正常(图 3l)。

图3 光学显微镜下观察两组猕猴肺、肝脏、脾脏、肾脏、心脏、胰腺病理切片(HE染色,×100)
讨 论
目前,在糖尿病的研究中,国内外学者的实验已证实高热量饮食+STZ注射是复制糖尿病动物模型的重要条件[6]。
STZ引起糖尿病的机理至今仍未完全了解清楚,可能有以下机制参与糖尿病的形成:(1)STZ直接破坏胰岛β细胞;(2)STZ激活自身免疫过程,进一步导致β细胞的损害;(3)通过一氧化氮(NO)和自由基两种途径损伤胰岛β细胞[7]。
STZ大剂量注射时,由于直接引起胰岛β细胞的广泛破坏,可造成1型糖尿病模型;而注射较少量STZ时,由于只是破坏一部分胰岛β细胞的功能,造成外周组织对胰岛素不敏感,同时给予高热量饲料喂养,两者结合便诱导出病理、生理改变都接近于人类2型糖尿病的动物模型[8-9]。
在糖尿病治疗的研究中,糖尿病动物模型的建立是关键的一步,动物模型建立的成功与否直接关系到后续的研究[10]。本实验所建立的猕猴糖尿病模型方法简单易行且稳定性好,适用于糖尿病及其慢性并发症的长期发病机制研究。
目前,复制实验性糖尿病模型的方法很多[11-12],有胰腺切除法,化学诱导法,病毒诱导法等,国内最常用的是化学诱导法,常用药物有四氧嘧啶和STZ。STZ是一种广谱抗菌素,具有抗菌、抗肿瘤的性能和致糖尿病的副作用。引起糖尿病的主要机制是STZ对胰岛β细胞的毒性作用,首先是将DNA碱基上的特殊位点烷基化再作用于ADP核糖体合成酶,导致多聚ADP2核糖体激活,胞内NAD+和ATP耗竭,最终导致大量反应性氧簇产生,引起胰岛β细胞特异性损伤。
huMSCs已经在一些动物糖尿病治疗研究中证实具有类似作用,关于huMSCs修复猕猴糖尿病损伤的研究未见报道。本项目组前期研究发现,huMSCs有治疗猕猴糖尿病的作用,参与损伤组织的修复。关于huMSCs治疗猕猴糖尿病的研究结果提示,干细胞再生修复可能成为猕猴糖尿病治疗的有效手段。本研究表明异种间移植脐带间充质干细胞没有免疫排斥,安全性好,疗效明显。
本研究利用与人类最为接近的灵长类动物,猕猴模型的成功建立为阐明人类糖尿病的发病机制与病理变化有较为重要的意义,猕猴糖尿病模型的建立为人类评价全新的糖尿病治疗方案打下了较好的基础,今后糖尿病的治疗不仅局限于药物疗效的筛选,还为干细胞治疗糖尿病的疗效及机制提供了较好的动物模型。
1 Benitez SU, Carneiro EM, de Oliveira AL. Synaptic input changes to spinal cord motoneurons correlate with motor control impairments in a type 1 diabetes mellitus model[J]. Brain Behav, 2015, 5(10): e00372.
2 高小民, 吴琦, 张岩, 等. 浙江南部地区汉族人群肾移植术后糖尿病患者KIR基因多态性分析[J]. 中华移植杂志(电子版), 2015, 9(2):18-22.
3 蔡适, 刘新峰. 糖尿病与高血压交互作用对缺血性卒中严重程度的影响[J]. 医学研究生学报, 2016, 29(11): 1131-1135.
4 Chadha GS, Morris ME. An extended minimal physiologically based pharmacokinetic model: evaluation of type II diabetes mellitus and diabetic nephropathy on human IgG pharmacokinetics in rats[J]. AAPS J, 2015, 17(6): 1464-1474.
5 Hu H1, Xu M1, Qi R1, et al. Sitagliptin downregulates retinol-binding protein 4 and upregulates glucose transporter type 4 expression in a type 2 diabetes mellitus rat model[J]. Int J Clin Exp Med, 201, 8(10):17902-17911.
6 Luo Q, Liu W, Chen J, et al. Nerve growth factor and inducible nitric oxide synthase expression in the mesencephalon and diencephalon,as well as visual- and auditory-related nervous tissues, in a macaque model of type 2 diabetes[J]. Neural Regen Res, 2012, 7(4): 302-307.
7 Matthews KA, Tonsho M, Madsen JC. New-onset diabetes mellitus after transplantation in a cynomolgus macaque (macaca fasicularis)[J].Comp Med, 2015, 65(4): 352-356.
8 Mátyás C, Németh BT, Oláh A, et al. The soluble guanylate cyclase activator cinaciguat prevents cardiac dysfunction in a rat model of type-1 diabetes mellitus[J]. Cardiovasc Diabetol, 2015, 14:145.
9 Pan XH, Song QQ, Dai JJ, et al. Transplantation of bone marrow mesenchymal stem cells for the treatment of type 2 diabetes in a macaque model[J]. Cells Tissues Organs, 2013, 198(6):414-427.
10 Park MH, Han JS. Padina arborescens ameliorates hyperglycemia and dyslipidemia in C57BL/KsJ-db/db mice, a model of Type 2 diabetes mellitus[J]. J Med Food, 2015, 18(10):1088-1094.
11 Qiang S, Nakatsu Y, Seno Y, et al. Treatment with the SGLT2 inhibitor luseogli fl ozin improves nonalcoholic steatohepatitis in a rodent model with diabetes mellitus[J]. Diabetol Metab Syndr, 2015, 7:104.
12 Røge RM, Klim S, Ingwersen SH, et al. The effects of a GLP-1 analog on glucose homeostasis in type 2 diabetes mellitus quantified by an integrated glucose insulin model[J]. CPT Pharmacometrics Syst Pharmacol, 2015, 4(1):e00011.
Safety and efficacy of human umbilical cord mesenchymal stem cells for diabetes in macaques
Ruan Guangping, Liu Jufen, Li Zi’an, Wang Jinxiang, Pang Rongqing, Pan Xinghua.
the Cell Biological Therapy Center of Kunming General Hospital of Chendu Military Commend, the Integrated Engineering laboratory of Cell Biological Medicine of State and Regions, the Transfer Medicine Key Laboratory of Cell Therapy Technology of Yunan Province, the Stem Cell Engineering laboratory of Yunan Province, Kunming 650032, China
Pan Xinghua, Email:xinghuapan@aliyun.com
ObjectiveTo evaluate the safety and efficacy of human umbilical cord mesenchymal stem cells(huMSCs)in the macaque model of diabetes.MethodsNine macaques were divided into either control group(n = 3)or model group(n = 6). Diabetes was induced by high-sugar, high-fat diet and intravenous injection of streptozotocin(STZ). Comparison between the two groups was performed using t test. At 12 weeks diabetic macaques were subdivided into the model control group(n = 3)and the treatment group(n = 3), and the treatment group was given weekly intravenous transfusion of 1×106huMSCs per kilogram of body weight for 3 weeks.Blood sugar levels were measured weekly. Comparison among the three groups was performed using variance analysis.ResultsAt the 8th week, the fasting blood glucose level increased significantly in the model group(22.00±3.00)mmol/L. Compared with the control group(4.89±0.16)mmol/L,the difference was statistically significant(t = 9.94, P < 0.01). A monkey died due to diabetes at 40 weeks. Pathological examination showed heart, liver, spleen, lungs, kidneys and pancreas had thecharacteristics of diabetes. After huMSCs therapy, blood sugar continuously declined for 3 weeks. At the fourth week, the fasting blood glucose of the control group, the model group and the treatment group were 4.85±0.35 mmol/L, 18.20±1.00 mmol/L, and 4.09±0.50 mmol/L respectively. There was significant difference between the control group and the model group(t = 24.173, P < 0.01),and between the model group and the treatment group(t = 25.549, P = 0.014).ConclusionSTZ and high-sugar, high-fat diet can induce diabetes in macaques. HuMSCs is simple and effective in treating diabetes.
Macaca; Diabetes mellitus; Pathological section; Blood glucose;Umbilical cord; Mesenchymal stem cell transplantation
2016-08-02)
(本文编辑:陈媛媛)
10.3877/cma.j.issn.2095-1221.2017.03.002
国家科技支撑计划(2014BI01B01);云南省科技计划重点项目(2013CA005);云南省应用基础研究计划重点项目(2015FA039)
650032 昆明,成都军区昆明总医院细胞生物治疗中心 干细胞与免疫细胞生物医药技术国家地方联合工程实验室 云南省细胞治疗技术转化医学重点实验室
潘兴华,Email:xinghuapan@aliyun.com
阮光萍,刘菊芬,李自安,等.人脐带间充质干细胞对猕猴糖尿病治疗效果的研究[J/CD].中华细胞与干细胞杂志(电子版),2017,7(3):131-135.

