Indoxyl Sulfate诱导腹膜间皮细胞转分化的实验研究
王强 俞国庆 黄雅清 傅云泉 陈鑫 庄永泽
Indoxyl Sulfate诱导腹膜间皮细胞转分化的实验研究
王强 俞国庆 黄雅清 傅云泉 陈鑫 庄永泽
目的硫酸吲哚酚(IS)刺激永生化人腹膜间皮细胞株(HMrSV5)后,研究细胞是否发生上皮细胞-间充质转分化(EMT),同时探索转化生长因子β1(TGF-β1)可能在其中的作用。方法体外培养HMrSV5,传代后,随机将人腹膜间皮细胞株分成以3组:对照组:加入4.25%腹膜透析液与培养液共培养;IS处理组:分别用含250 μmol/LIS、500 μmol/LIS、1 000 μmol/LIS浓度的培养液与4.25%腹膜透析液共培养;TGF-β1受体抑制剂组:用含2 μmol/L LY364947+IS的培养液与4.25%腹膜透析液共培养。分别在培养0、4、12、24、48和72 h时间下,采用细胞免疫荧光法观察细胞形态变化,Western Blot法研究细胞α平滑肌肌动蛋白(α-SMA)的表达规律,48 h时用ELISA法测定纤维连接蛋白(FN),层粘连蛋白(LN5)两种基质蛋白的分泌情况。结果(1)免疫荧光法显示:与正常细胞比较,IS处理组细胞由典型的铺路样鹅卵石状,逐渐变细变长,呈梭形改变;而TGF-β1受体抑制剂组细胞形态变化不明显,不如IS处理组;(2)Western Blot法检测结果显示:与对照组比较,IS处理组α-SMA的表达水平明显增加,48 h 时 1 000 μmol/LIS 表达最明显(39.929±2.610 vs 0.996±0.001 ;P < 0.01),差异有统计学意义;与IS处理组比较,TGF-β1受体抑制剂组的表达则明显减少,其中48 h时抑制明显(7.418±3.075 vs 39.929±2.610,P < 0.01),差异有统计学意义 ;(3)ELISA 法结果显示 :与对照组比较,IS 处理组基质蛋白 FN(1.368±0.040 vs 1.094±0.036,P < 0.01)、LN5(1.031±0.085 vs 0.860±0.063,P < 0.01)的表达均上调,差异有统计学意义;与IS处理组比较,TGF-β1受体抑制剂组 FN(0.925 ±0.15 vs 1.368 ±0.040,P < 0.01)、LN5(0.795±0.426 vs 1.031±0.085,P < 0.01)分泌均减少,差异有统计学意义。结论IS可诱导腹膜间皮细胞发生EMT,TGF-β1的参与可能起重要作用,这为治疗腹膜纤维化可能提供新的靶点。
腹膜间皮细胞; 硫酸吲哚酚; 细胞上皮-间充皮转分化; 转化生长因子β
腹膜透析(peritoneal dialysis,PD)是终末期肾脏病患者的一种替代治疗。腹膜纤维化是导致腹透治疗失败的主要原因,而腹膜间皮细胞的转分化(epithelial-mesenchymal-transition,EMT)就是其中主要的一种机制[1-3]。
近年来内源性尿毒症毒素的毒性作用日益得到重视,其中,第三类毒素硫酸吲哚酚(indoxyl sulfate,IS)的研究最为广泛,在慢性肾脏病(chronic kidney disease,CKD)患者中IS的血清浓度比正常人显著升高,它是一种蛋白结合毒素,由食物中的色氨酸代谢而来[4],不容易被透析方式排出,对患者的肾脏及心血管系统均造成严重的影响[5]。文献报道IS可以诱导近曲小管上皮细胞、系膜细胞、内皮细胞、血管平滑肌细胞以及成骨细胞发生氧化应激[6-8],促进血管平滑肌细胞增殖以及成骨细胞转分化、血管钙化[7,9]以及血管老化[10],可加快CKD的进展[11]。有研究发现,IS诱发小管上皮细胞EMT[12]。但IS能否诱导腹膜间皮细胞转分化,目前没有见到相关研究。
转化生长因子β(transforming growth factor beta,TGF-β)是EMT过程中的一个关键因子,研究显示腹膜间皮细胞在TGF-β1刺激下,α-SMA蛋白的表达和羟基脯氨酸的分泌增加,E-cadherin的表达下降,并且导致细胞失去了规则的立方形结构,提示TGF-β1可以促进α-SMA的表达[13]。
基于上述依据,本研究拟通过体外实验研究IS对腹膜间皮细胞的EMT作用以及TGF-β1可能在其中的作用,旨在通过明确IS对腹膜间皮细胞EMT的影响机制,进而对腹膜纤维化做出具有临床意义的预防或治疗措施。
材料与方法
一、材料
人腹膜间皮细胞株HMrSV5购自上海冠导生物工程有限公司,RPMI1640细胞培养基,PBS液购自美国Hyclone公司,澳洲胎牛血清购自Gibco公司,4.5%腹透液购自广东百特公司,TGF-β1受体抑制剂(LY364947)、硫酸吲哚酚(IS)购自美国 sigma公司,鼠抗人α平滑肌肌动蛋白(α-SMA)购自英国Abcam公司,纤维连接蛋白(Fibronectin,FN)及层粘连蛋白(laminin5,LN5)酶联免疫吸附法(ELISA)试剂盒购自美国RB公司。
二、方法
1.细胞培养:将复苏的HMrSV5细胞接种于25 cm2培养瓶,用含10%胎牛血清的RPMI1640培养液放在37 ℃、5% CO2培养箱中培养,24 h后首次换液,以后48 h换液1次;待细胞生长达到80%~ 90%汇合时,进行传代。细胞经倒置相差显微镜、投射电镜、扫描电镜鉴定,细胞活力检测:细胞悬液与0.4%台盼蓝溶液以9 : 1混合混匀。用细胞计数板在3 min内,分别计数活细胞和死细胞。镜下观察,死细胞被染成明显的蓝色,而活细胞拒染呈无色透明状。统计细胞活力:活细胞率(%)=活细胞总数/(活细胞总数+死细胞总数)×100%。
2.实验分组:当细胞生长达到80%~ 90%时,用0.25%胰酶消化,传代后随机分为3组:(1)对照组:加入4.25%腹透液与培养液共培养,培养中不予干预;(2)IS处理组:分别用含250 μmol/LIS、500 μmol/LIS、1 000 μmol/LIS 浓度的培养液与4.25%腹透液共培养;(3)TGF-β1受体抑制剂组:用含2 μmol/L LY364947+IS的培养液与4.25%腹透液共培养。分别孵育一定时间(0,4,12,24,48,72 h)后提取细胞总蛋白,其中ELISA在48 h提取上清液后进行实验。
3.免疫荧光化学检测法观察细胞形态变化:将培养的细胞传至共聚焦皿中,加药一定时间后,PBS漂洗充分,用4%多聚甲醛固定15 min,PBS漂洗3次,每次3 min,山羊血清封闭30 min,加入适当稀释的鼠抗人 α-SMA 抗体(1:100),4 ℃过夜 ;PBS洗涤5次,每次3 min,加入非免疫山羊抗鼠IgG(1:200),37 ℃温箱中孵育 1 h ;PBS 洗涤 5 次,每次3 min,DAPI染色5 min;洗涤后在荧光显微镜下观察,若有红色荧光,可在共聚焦显微镜下观察并拍照。
4. Western Blot法研究细胞α-SMA的表达规律:收集细胞,4 ℃预冷,PBS洗3遍,加入适量含蛋白酶抑制剂(PMSF)的 RIPA 裂解液(按 1:100)冰上充分裂解细胞,4 ℃,13 000×g离心15 min,收集上清液,BCA法测定蛋白浓度;按照1:4比例将5×SDS-PAGE与样本混合,100 ℃变性10 min后,迅速置于冰上冷却,13 000×g 离心 5 min,20 μl蛋白样品行100 g/L聚丙烯酰胺凝胶电泳(上层胶80 V,下层胶120 V),待电泳结束后,将切取下来的凝胶转至PVDF膜上,并用5%脱脂奶粉封闭2 h。将膜放入稀释的一抗溶液(鼠抗人α-SMA抗体)中,4 ℃孵育过夜。次日,用TBST洗涤3次,每次5 min,然后放入稀释的二抗中,室温孵育1 h,TBST洗涤3次,每次5 min,ECL试剂检测蛋白表达。利用Western-blotting的照相软件按照灰度值的高低来定量分析样品中的蛋白表达,与内参a-tublin的比值代表定量值。
5. ELISA法检测FN及LN5的表达情况:将细胞种植于24孔板内,提取上清液后并做好标记后放置于-80 ℃内冻存。用碳酸盐包被缓冲液将抗体稀释至蛋白质含量为1 ~ 10 μg/ml。在每个聚苯乙稀板的反应孔中加0.1 ml,37 ℃4 h。弃去孔内溶液,用PBS洗3次,每次3 min。加一定稀释的待检样品0.1 ml于已包被之反应孔中,置37 ℃孵育1 h,然后充分洗涤。于各反应孔中,加入新鲜稀释的酶标抗体(经滴定后的稀释度)0.1 ml,37 ℃孵育30 min,洗涤。于各反应孔中加入临时配制的TMB底物溶液0.1 ml显色,37 ℃10 min。于各反应孔中加入终止液50 μl终止反应。检测吸光度(A)值,在检测检测仪上,于450 nm处以空白对照孔调零后测各孔A值,若大于规定的阴性对照值的2.1倍,即为阳性。并将结果输入电脑软件进行计算,建立标准曲线,根据标准曲线计算待测样品中FN及LN5的浓度。
三、统计学分析方法
使用SPSS 20.0统计软件进行统计学分析,图片处理使用Photoshop。Western Blot及ELISA计量资料均采用±s表示,组间差异的比较运用单因素方差分析,不符合正态分布时用Mann-Whitney U秩和检验,以P < 0.05为差异有统计学意义。
结 果
1. IS可诱导腹膜间皮细胞发生形态变化:正常的HMrSV5细胞贴壁生长,排列紧密,呈典型的铺路样鹅卵石状(图 1),1 000 μmol/L IS 刺激细胞后,从12 h开始,共聚焦显微镜下可观察细胞表达红色荧光(图2),荧光区域内可见细胞变细变长,呈长梭形改变,以48 h变化最明显,向典型的纤维细胞转变。而1 000 μmol/LIS + LY364947刺激细胞后,细胞形态变化不明显,从24 h开始出现红色荧光(图3),48 h可见部分细胞呈长梭形改变,但总体变化不如单纯的 1 000 μumol/LIS 刺激,表示 TGF-β1受体抑制剂对细胞转分化的抑制作用明显。
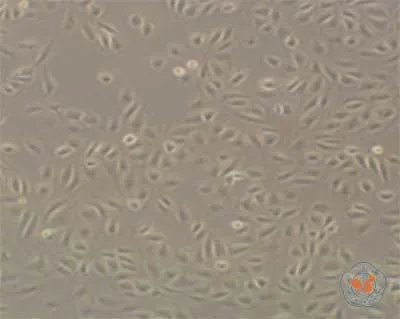
图1 倒置显微镜下观察正常腹膜间皮细胞株形态(×100)
2. IS刺激HMrSV5后,α-SMA表达量增加,而TGF-β1受体抑制剂可抑制其表达:Westernblotting法结果显示:IS刺激细胞后,0 h、4 h条带不明显(图4),从12 h开始,条带逐渐变深,最大浓度1 000 μmol/LIS刺激细胞48 h后,间质细胞标志物α-SMA表达量明显增加,并达到最大值(P <0.05),提示细胞发生了EMT。同时用LY364947与1 000 μmol/LIS同时刺激细胞后,α-SMA表达量较 1 000 μmol/LIS 组明显下降(P < 0.05),差异有统计学意义(表1),说明TGF-β1受体抑制剂对IS促进HMrSV5转分化具有抑制作用,提示TGF-β1在HMrSV5细胞转分化中可能发挥着重要的作用。
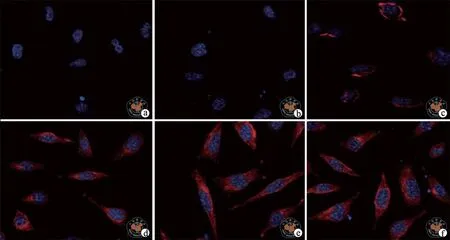
图2 共聚焦显微镜下观察IS处理组HMrSV5细胞发形态(IF染色,×400)
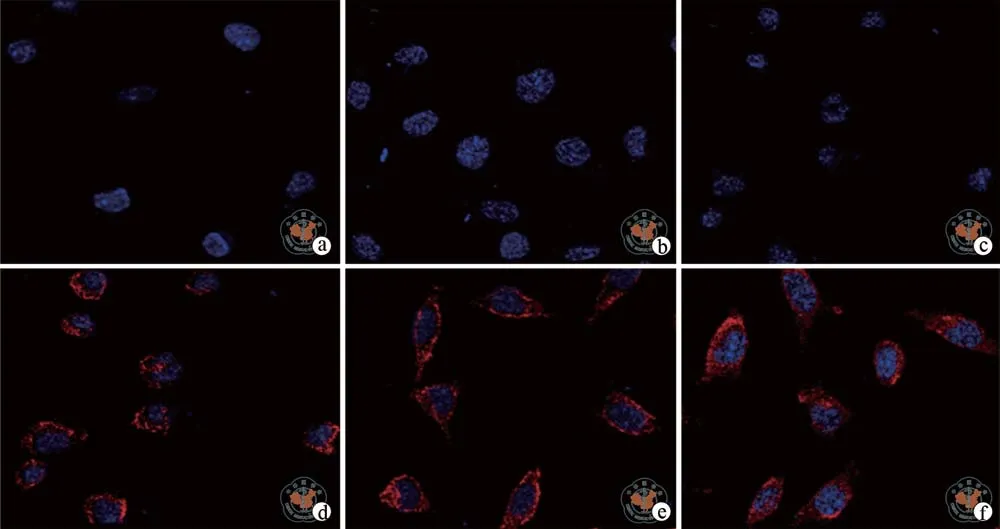
图3 共聚焦显微镜下观察TGF-β1受体抑制剂组HMrSV5细胞形态(IF染色,×400)
3. IS刺激腹膜间皮细胞 48 h后FN、laminin 5的分泌均上调:IS刺激腹膜间皮细胞 48 h后,ELISA结果显示:IS能促进基质蛋白FN、LN5的分泌,不同的是,当IS浓度达1 000 μmol/L是,FN分泌最大(P < 0.05),而 LN5 则是 500 μmol/L 达最大值(P < 0.05,表 2),运用 LY364947 作为通路抑制剂后,两者的分泌均显著降低(P < 0.05),差异有统计学意义。
表1 对照组、IS处理组及TGF-β1受体抑制剂组培养不同时间后灰度值比较(±s)

表1 对照组、IS处理组及TGF-β1受体抑制剂组培养不同时间后灰度值比较(±s)
注 :与对照组比较,aP < 0.05 ;与 1 000 μmol/LIS 浓度组比,bP < 0.05
分组 0 h 4 h 12 h 24 h 48 h 72 h对照组 1.012±0.001 1.115±0.116 1.066±0.114 1.034±0.066 0.996±0.001 1.115±0.116 250 μmol/LIS 1.035±0.305 2.358±0.310a2.725±0.310a2.151±0.355 0.873±0.419 25.025±2.332a500 μmol/LIS 1.245±0.202 3.491±0.328a4.079±0.189a4.744±0.199a1.831±0.505 36.491±2.227a1 000 μmol/LIS 1.176±0.316 2.518±0.180a5.317±0.275a 35.707±2.008a 39.929±2.610a 25.518±1.173aTGF-β1 受体抑制剂组 0.821±0.265 1.871±0.535b4.305±0.240b 14.738±2.364b7.418±3.075b1.871±0.535bF值 1.331 21.377 145.845 321.323 254.515 308.506 P 值 0.324 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01

图4 不同时间各组刺激细胞表达α-SMA蛋白的条带变化
表2 对照组、IS处理组及TGF-β1受体抑制剂组培养48 h后 LN5、FN 浓度(μg /L)比较(±s)
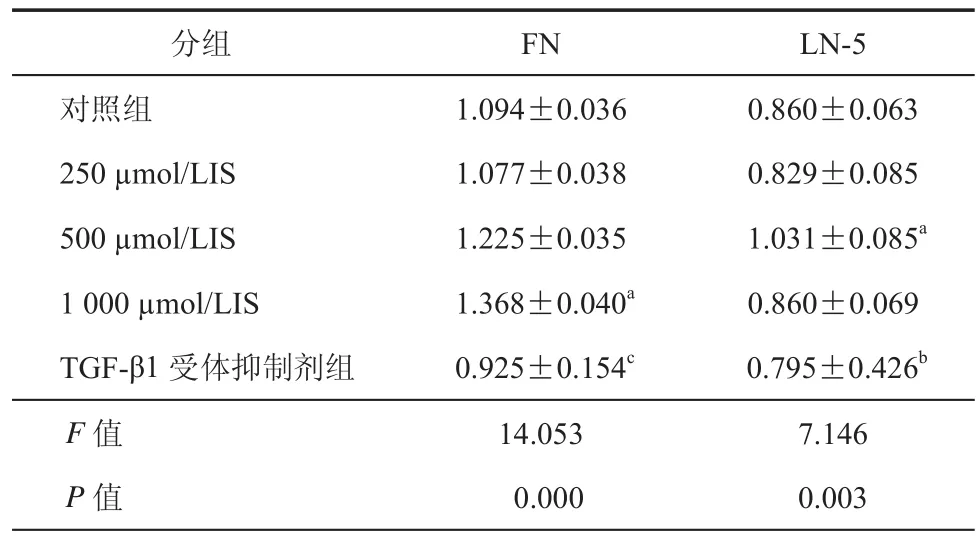
表2 对照组、IS处理组及TGF-β1受体抑制剂组培养48 h后 LN5、FN 浓度(μg /L)比较(±s)
注 :与对照组比较,aP < 0.05 ;与 500 μmol/LIS 浓度组比,bP < 0.05 ;与 1 000 μmol/LIS 浓度组比,cP < 0.05
分组 FN LN-5对照组 1.094±0.036 0.860±0.063 250 μmol/LIS 1.077±0.038 0.829±0.085 500 μmol/LIS 1.225±0.035 1.031±0.085a1 000 μmol/LIS 1.368±0.040a 0.860±0.069 TGF-β1 受体抑制剂组 0.925±0.154c0.795±0.426bF值 14.053 7.146 P值 0.000 0.003
讨 论
腹膜纤维化是导致腹透治疗失败的主要原因,研究腹膜纤维化的机制进而寻找预防其发生的干预措施一直是近年来透析学界研究的重点和热点,腹膜间皮细胞的EMT就是其中主要的一种[1-2]。腹膜间皮细胞层在调节腹膜功能,抑制炎症和纤维化中起着关键作用。研究显示EMT过程中的间皮细胞表达某些促血管新生因子,比如VEGF等的表达增加,因而推测EMT、血管新生和腹膜纤维化相互作用,共同损伤腹膜[3]。因此,学者认为腹膜间皮细胞发生EMT是腹膜纤维化的起始和可逆环节[14],是主要机制之一。
多种原因可导致腹膜间皮细胞发生EMT,例如腹透液的葡萄糖、氧化应激产物等[15]。近年来内源性尿毒症毒素的毒性作用日益得到重视,此类毒素包含三类毒素:第一类是以尿素为代表的小分子毒素;第二类是以β2微球蛋白为代表的中大分子毒素,第三类就是蛋白结合毒素,以IS和phenolic compounds为代表。研究发现,腹膜透析患者血清IS水平显著升高,而腹膜透析对其清除也显著增加,但仍不足以代偿肾功能下降[16]。目前研究发现IS可显著增加CKD患者死亡率[17],但此类毒素与腹膜透析相关的研究则较少[18]。文献报道IS可以诱导近曲小管上皮细胞、系膜细胞、内皮细胞、血管平滑肌细胞以及成骨细胞发生氧化应激[6-8],促进血管平滑肌细胞增殖以及成骨细胞转分化、血管钙化[7,9]以及血管老化[10],可加快CKD的进展[11]。促进单核细胞向前纤维化巨噬细胞转化[19]。它还可以增加TGF-β1的表达,促进间质纤维化,加速5/6肾切除大鼠的肾功能恶化,提示IS对TGF-β1的作用[20],而缓解IS过负荷则可以减少氧化应激,改善5/6肾切除大鼠肾小管-间质纤维化[21]。最近文献报道,IS可以促进近端小管上皮细胞α-SMA的表达,降低E-cadherin和zonula occludens-1表达,诱发小管上皮细胞EMT[12]。但IS能否诱导腹膜间皮细胞的转分化,目前没有见到相关研究。为此,本研究首先通过采用细胞免疫荧光法检测IS作用下细胞的形态变化,并通过激光共聚焦,对样本进行逐点扫描,获得比荧光显微镜更清晰的图片,通过任意角度旋转,观察细胞形态。发现IS刺激后,0 h、4 h细胞形态未见明显改变,从12 h开始,显微镜下可见腹膜间皮细胞逐渐变细变长,呈长梭形改变,以48 h变化最明显,呈典型的纤维细胞样改变,同时,免疫荧光显示α-SMA的表达增加,说明腹膜间皮细胞发生了转分化。
此外,本研究还采用Western-blot方法证明IS促进HMrSV5表达α-SMA的作用。结果显示不同浓度IS刺激HMrSV5后,α-SMA的表达较对照组显著增加,但并非呈浓度依赖关系,分别在500 μmol/L和1 000 μmol/L表达最强。从时间上看,随着刺激时间的延长,α-SMA的表达总体有增加,但并非呈时间依赖关系,在浓度为1 000 μmol/L刺激时间48 h达最高峰。出现非时间依赖性的因素考虑可能有(1)随着时间的延长,IS不断的消耗,浓度的下降对细胞的影响变弱;(2)IS对细胞不断的刺激之后,使细胞对IS毒素产生了一定的抵抗,可能引起细胞对毒素的耐受,毒性作用下降;(3)细胞培养时间的延长,会使细胞变得密集,导致细胞与IS的有效接触面积变小。总之,IS刺激HMrSV5可使α-SMA蛋白表达增加。
TGF-β1是致腹膜纤维化的重要因素。Margetts等[22]通过基因工程发现转入TGF-β1的小鼠体内与EMT及纤维化相关的基因表达明显增多,如胶原I、α-SMA,并在间皮细胞下组织发现了细胞角蛋白和α-SMA阳性的成纤维细胞。为了明确TGF-β1在腹膜间皮细胞转分化中的作用。结果也显示,IS刺激HMrSV5后,间质细胞标记物α-SMA与基质蛋白FN、LN5分泌显著增加,提示IS促进腹膜转分化,而加入TGF-β1受体抑制剂后,α-SMA表达、FN及LN5分泌显著减少,提示TGF-β1可能参与IS诱导间皮细胞转分化的过程。
基于上述结果,本研究表明IS可诱导腹膜间皮细胞EMT,而TGF-β1可能在其中起重要作用。而IS如何造成腹膜间皮细胞发生EMT的细胞内信号转导,将是下一步研究内容。
1 Del Peso G, Jiménez-Heffernan JA, Bajo MA, et al. Epithelial-tomesenchymal transition of mesothelial cells is an early event during peritoneal dialysis and is associated with high peritoneal transport[J].Kidney Int Suppl, 2008(108):S26-S33.
2 Zhang J, Oh KH, Xu H, et al. Vascular endothelial growth factor expression in peritoneal mesothelial cells undergoing transdifferentiation[J]. Perit Dial Int, 2008, 28(5):497-504.
3 Ha HR, Yu MR, Lee HB. High glucose-induced PKC activation mediates TGF-beta 1 and fibronectin synthesis by peritoneal mesothelial cells[J]. Kidney Int, 2001, 59(2):463-470.
4 Leong SC, Sirich TL. Indoxyl Sulfate-Review of toxicity and therapeutic strategies[J]. Toxins (Basel), 2016, 8(12):358.
5 Lekawanvijit S, Adrahtas A, Kelly DJ, et al. Does indoxyl sulfate,a uraemic toxin, have direct effects on cardiac fibroblasts and myocytes?[J]. Eur Heart J, 2010, 31(14):1771-1779.
6 Dou L, Jourde-Chiche N, Faure V, et al. The uremic solute indoxyl sulfate induces oxidative stress in endothelial cells[J]. J Thromb Haemost, 2007, 5(6):1302-1308.
7 Muteliefu G, Enomoto A, Jiang P, et al. Indoxyl sulphate induces oxidative stress and the expression of osteoblast-specific proteins in vascular smooth muscle cells[J]. Nephrol Dial Transplant, 2009,24(7):2051-2058.
8 Tumur Z, Niwa T. Indoxyl sulfate inhibits nitric oxide production and cell viability by inducing oxidative stress in vascular endothelial cells[J]. Am J Nephrol, 2009, 29(6):551-557.
9 Shimizu H, Hirose Y, Nishijima F, et al. ROS and PDGF-beta[corrected] receptors are critically involved in indoxyl sulfate actions that promote vascular smooth muscle cell proliferation and migration[J]. Am J Physiol Cell Physiol, 2009, 297(2):C389-C396.
10 Adijiang A, Higuchi Y, Nishijima F, et al. Indoxyl sulfate, a uremic toxin, promotes cell senescence in aorta of hypertensive rats[J].Biochem Biophys Res Commun, 2010, 399(4):637-641.
11 Niwa T, Ise M. Indoxyl sulfate, a circulating uremic toxin, stimulates the progression of glomerular sclerosis[J]. J Lab Clin Med, 1994,124(1):96-104.
12 Bolati D, Shimizu H, Higashiyama Y, et al. Indoxyl sulfate induces epithelial-to-mesenchymal transition in rat kidneys and human proximal tubular cells[J]. Am J Nephrol, 2011, 34(4):318-323.
13 Liu Q, Mao H, Nie J, et al. Transforming growth factor{beta}1 induces epithelial-mesenchymal transition by activating the JNK-Smad3 pathway in rat peritoneal mesothelial cells[J]. Perit Dial Int, 2008,28(S3):S88-S95.
14 Nagy JA. Peritoneal membrane morphology and function[J]. Kidney Int Suppl, 1996(56): S2-S11.
15 Lee HB, Ha H. Mechanisms of epithelial-mesenchymal transition of peritoneal mesothelial cells during peritoneal dialysis[J]. J Korean Med Sci, 2007, 22(6):943-945.
16 Viaene L, Meijers BK, Vanrenterghem Y, et al. Serum concentrations of p-Cresyl sulfate and indoxyl sulfate, but not in fl ammatory markers,increase in incident peritoneal dialysis patients in parallel with loss of residual renal function[J]. Perit Dial Int, 2015, 35(4):492.
17 Lin CJ, Wu V, Wu PC, et al. Meta-Analysis of the associations of p-Cresyl sulfate (PCS) and indoxyl sulfate (IS) with cardiovascular events and All-Cause Mortality in Patients with Chronic Renal Failure[J]. PLoS One, 2015, 10(7):e0132589.
18 Vanholder R, De Smet R, Glorieux G, et al. Review on uremic toxins:classi fi cation, concentration, and interindividual variability[J]. Kidney Int, 2003, 63(5):1934-1943.
19 Barisione C, Garibaldi S, Furfaro AL, et al. Moderate increase of indoxyl sulfate promotes monocyte transition into profibrotic macrophages[J]. PLoS One, 2016, 11(2):e0149276.
20 Miyazaki T, Ise M, Seo H, et al. Indoxyl sulfate increases the gene expressions of TGF-beta 1, TIMP-1 and pro-alpha 1(I)collagen in uremic rat kidneys[J]. 1997(62): S15-S22.
21 Lu Z, Zeng Y, Lu F, et al. Rhubarb enema attenuates renal tubulointerstitial fibrosis in 5/6 nephrectomized rats by alleviating indoxyl sulfate overload[J]. PLoS One, 2015, 10(12):e0144726.
22 Margetts PJ, Bonniaud P, Liu L, et al. Transient overexpression of TGF-{beta} 1 induces epithelial mesenchymal transition in the rodent peritoneum[J]. J Am Soc Nephrol, 2005, 16(2):425-436.
Experimental study on epithelial-mesenchymal-transition of peritoneal mesothelial cells induced by indoxyl sulfate
Wang Qiang, Yu Guoqing, Huang Yaqing, Fu Yunquan, Chen Xin, Zhuang Yongze.
Department of nephrology, Fuzhou General Hospital, People's Liberation Army of China,Fuzhou 350025,China
Yu Guoqing, Email:yuguoqing@medmail.com.cn
ObjectiveTo induce epithelial mesenchymal transition(EMT)of immortalized human peritoneal mesothelial cell line(HMrSV5)with indoxyl sulfate (IS) and investigate the role of transforming growth factor(TGF-β1).MethodsHMrSV5 cells were randomly divided into 3 groups: the control group: with 4.25%peritoneal dialysate fluid in culture medium; IS groups: with IS at final concentrations oft 250 μmol/L, 500 μmol/L, and 1 000 μmol/L and 4.25%peritoneal dialysate fluid; TGF-β1 inhibitor group: with 2 μmol/L LY364947, IS and 4.25%peritoneal dialysate fluid. At 0 h, 4 h, 12 h, 24 h, 48 h, and 72 h, the morphological changeswere observed by immunofluorescence method, and alpha smooth muscle actin(α-SMA)expression was evaluated with Western Blot. At 48 h,supernatant was collected to determinate fibronectin and laminin5 by ELISA.ResultsAfter IS induction, cells change from typical cobblestone-like shape to long fusiform shape, which was prevented but TGF-β1 inhibitor. Western Blot showed that: compared with control group the expression level of α-SMA increased significantly in the IS treatment group.The level of α-SMA was highest at 48 h with 1 000 μmol/L IS(39.929±2.610 vs 0.996±0.001;P < 0.05), which was decrease to 7.418±3.075 in the presence of TGF-β1 inhibitor(P < 0.05).Compared with control group, IS increased the secretion of FN(1.368±0.040 vs 1.094±0.036, P < 0.05)and laminin 5(1.031±0.085 vs 0.860±0.063, P < 0.05), which were decreased by TGF-β inhibitor(0.925±0.15 and 0.795±0.426 respectively, P < 0.05).ConclusionEMT of PMC could be induced by IS via TGF-β1 signaling pathway and is potential target for the treatment of peritoneal fibrosis.
Peritoneum; Stromal cells; Sulfuric acids; Indophenol; Epithelialmesenchymal-transition; Transforming growth factor beta
2017-03-07)
(本文编辑:李少婷)
10.3877/cma.j.issn.2095-1221.2017.03.006
福建省自然科学基金面上项目(2014J01426)
350025 福州,中国人民解放军福州总医院肾内科
俞国庆,Email:yuguoqing@medmail.com.cn
王强,俞国庆,黄雅清,等. Indoxyl Sulfate诱导腹膜间皮细胞转分化的实验研究[J/CD].中华细胞与干细胞杂志(电子版),2017,7(3):152-158.

