高剂量pSin慢病毒载体介导的转染对诱导性多能干细胞影响的研究
黄乙涓黄强吕欧
高剂量pSin慢病毒载体介导的转染对诱导性多能干细胞影响的研究
黄乙涓1黄强2吕欧3
目的研究慢病毒载体pSin介导的基因修饰后的诱导性多能干细胞(iPS),细胞形态和传代的影响。方法通过包装慢病毒pSin-GFP感染iPS,分为实验组(细胞与病毒滴度比例1 : 200)和对照组(细胞与病毒滴度比例1 : 1)感染人iPS,经过嘌呤霉素药物筛选获得单克隆,重复3次实验观察细胞形态学变化记录细胞每代克隆数,采用方差分析及t检验进行统计学分析数据结果,用免疫荧光和werstern检测iPS标志蛋白表达。结果pSin-GFP病毒感染iPS后挑取24个单克隆细胞株,传十代后实验组(4.67±0.33)明显少于对照组(16.00±0.58)的细胞克隆数(t =17.00,P < 0.01),实验组细胞状态稳定并正常表达 Oct-4、Sox2、SSEA-1、Nanog和Tra-1-60。结论使用1 : 200的高比例慢病毒载体pSin介导的基因修饰后的iPS可传代次数减少,形态学并未发生变化,其正常表达的干细胞标志性蛋白。
多能干细胞; 慢病毒属; 基因修饰
日本学者2006年发现可以通过导入外源性的几个因子将已分化的体细胞重编程使其回到原始状态表现出胚胎干细胞的特性[1],而这几个因子分别是Oct4、Sox2、c-Myc和Klf4这种通过使用慢病毒介导的重编程作用使得体细胞表现出胚胎细胞特性,并被赋予一个新的名字—诱导性多能干细胞(induced pluripotent stem cells,iPS)。至从该研究发表在《细胞》杂志上后,许多科学家投入研究该细胞。
在后面的研究中,我国科学家成功将来源人体细胞的iPS细胞分化成为胰岛细胞[2-3],并且该细胞经过验证可以成功分泌胰岛素[4],在接下来的研究中该小组又将人iPS细胞成功分化为肝细胞[5]为了今后干细胞用于治疗提供了实践依据。Wernig等[6]利用帕金森病的动物疾病模型表明,从小鼠的诱导多能性细胞分化成的多巴胺能神经元可以整合到宿主大脑并改善与帕金森病的症状相似的小鼠。同时,通过基因修饰后的iPS细胞也同样用于后续的研究和治疗中。
常用的基因修饰方法是病毒转染,许多病毒可以高效的将自身基因整合到宿主基因中,并且有效的将宿主细胞变成复制病毒的工厂。慢病毒可以感染分裂期的细胞或者静止期的细胞,并且其感染干细胞的效率也高于常用的逆转录病毒,其成为构建稳转细胞株的主要转染工具,其已经安全的使用于哺乳动物的基因调控研究,目前常用构建稳转细胞株的病毒为慢病毒。因此有许多实验中使用慢病毒与iPS细胞结合,使其过表达某一特定基因,用于治疗神经系统或者消化系统疾病等,常用的慢病毒载体携带自身结构基因,但慢病毒自身结构基因插入iPS细胞后对该细胞的生长影响却鲜有报道,并且使用过量的慢病毒感染干细胞是否对细胞的生长状态或者代数有影响也未见报道。本文就此问题进行了实验研究。
材料与方法
一、材料
1.主要设备:超速离心机(美国Beckman公司),化学发光成像仪(美国Beckman公司),荧光倒置显微镜(美国蔡式公司),离心机(美国Eppendorf公司),流式细胞仪C6(美国BD公司)。
2.主要的试剂和材料:iPS(赛业公司),293T细胞(美国 ATCC 公司),Jurkat细胞(美国 ATCC公 司),lipofectamine 3000(美 国 Invitrogen 公司),DMEM Basic培养基(美国 Invitrogen公司),mTeSR1干细胞培养基(加拿大干细胞公司),胎牛血清(FBS)(美国Invitrogen公司),胰蛋白酶(美国Invitrogen公司),二甲基亚砜(美国Invitrogen公司),Matrigel(美国 BD 公司),Oct-4A(C30A3)Rabbit mAb(美 国 CST 公 司)、Sox2(D6D9)XP Rabbit mAb(美国 CST公司)、anti-GAPDH(美国 CST公司)。本实验所用一抗均购于美国CST公司,荧光标记二抗购于美国Invitrogen公司。
二、方法
1. iPS的培养:本实验使用的iPS来源于人皮肤的成纤维上皮细胞,已传14代。使用mTeSR1人胚胎干细胞完全培养基培养,复苏后隔天换液培养3 ~ 4 d,待细胞克隆后成为肉眼可见的克隆后,使用1 ml枪头轻轻划田字把较大的细胞克隆分散成小克隆后吸取到铺有30%的Matrigel的细胞皿中,加入新鲜培养基继续培养,每天换液。
2.慢病毒包装:复苏293T细胞,并传代培养2 ~ 4代后用于病毒包装。293T细胞传代之前,先明胶包被数个10 cm的大培养皿。包装病毒的前1天,传代293T细胞。5×106个细胞接种到10 cm的大培养皿中。按照这样的起始接种密度,在包装病毒当天,细胞可以达到90%~ 95%融合。每个皿使用 10 μg 的 pSin-EF2-GFP-puro 质粒 15 μg psPAX2质粒、10 μg pMD2.G 质粒,与 P3000,颠倒混匀,RT温浴5min将温浴好的lipofectamine 3 000、DNA的混合液体,逐滴加入10 cm的培养皿。12 ~ 20 h后换液,从换液后开始计时,在36 h和48 h两个时间点,收集病毒上清液高速离心后用100 μl PBS重悬病毒颗粒,存于-80℃。
3.慢病毒滴度计算:将生长状态良好的Jurkat细胞接种于6孔板,每孔细胞为5×104个。将浓缩病毒液稀释200倍,在3个培养孔中分别加入0.5,5,50 μl的稀释病毒,感染48 h后用流式计数每孔细胞荧光数计算病毒滴度。滴度(integration units per ml,IU ml-1)的计算公式如下 :IU ml-1=(C × D×1 000)/V;其中:C=平均每孔荧光细胞占总细胞数比例;N=感染时细胞的数目(为1×105)D =病毒载体的稀释倍数;V =加入的稀释病毒的体积数。
4.慢病毒感染和单克隆细胞株培养:六孔培养板,每孔1×104个iPSCs接种过夜,分为3个组。实验组以细胞与病毒滴度比例1 : 200的高剂量加入1×106病毒液,对照组按照1 : 1的比例将正常量的细胞与病毒滴度加入1×104病毒液感染iPSCs,同时设置阴性对照组在细胞中加入等量PBS。感染细胞24 h后换液,48 h后加入puromysin筛选,48 h后停止药筛。传一代后精确计算细胞数量,用培养基稀释配制成0.005 ~ 0.02个/μl的细胞悬液,每孔取100 μl均匀分配至96孔板中,待细胞生长为单克隆后继续传代。重复3次实验,记录每代细胞的克隆数量。
5.流式细胞仪检测iPS细胞荧光表达情况:用胶原酶Ⅳ消化细胞,离心后用PBS润洗2次,最后重悬于PBS中。取空白组作为对照,实验组上机检测GFP表达量。
6. werstern检测蛋白表达情况:收集对数期的细胞,将细胞浓度调节至200 000个/ml,将细胞稀释液接种到 12孔板中,每孔 1 ml,37 ℃、5%CO2条件下培养过夜;用PBS润洗2次后每孔加入 200 μl预先配制好的含SDS上样缓冲液和含苯甲基磺酰氟(Phenylmethanesulfonyl fl uoride,PMSF)的 RIPA 裂解液(RIPA lysis buffer);在细胞充分裂解后,98 ℃水浴10 min;用煮过的蛋白样品跑蛋白电泳(8%蛋白胶浓度);电泳后将含目标蛋白的胶切下,进行转膜(90 V,90 min);转完膜后,将膜用5%脱脂牛奶(溶于TBST)于室温下封闭1 h;将封闭完的膜用一抗于室温孵育1 h[Oct-4A(C30A3)Rabbit mAb、Sox2(D6D9)XP Rabbit mAb、anti-β-Tubulin];用 TBST 将膜在室温下润洗3次,每次5 min;将膜用二抗于室温下孵育1 h(anti-rabbit IgG,HRP-linked antibody),用 TBST 将膜在室温下润洗3次,每次5 min,然后在化学发光液的作用下用化学发光成像仪进行显色。
7.免疫荧光染色鉴定iPS细胞系的多能性:将iPSCs正常传代后,用4%甲醛固定30 min,PBS清洗3次后,用0.2% Triton X-100透化5 min。使用一抗(用1%BSA稀释)封闭,于4 ℃过夜;PBS洗3 遍后,用荧光二抗(1:500 稀释)37 ℃避光放置 1 h,再PBS洗3遍,每遍5 min。最后用荧光倒置显微镜进行荧光照相。
三、统计学分析方法
采用SPSS 13.0统计软件,SUVmax数据以±s表示。细胞每代克隆数实验组、对照组与空白组间用ANOVA检验,细胞每代克隆数SUVmax实验组与对照组之间比较采用两样本t检验,以P < 0.05为差异有统计学意义。
表1 慢病毒pSin-GFP转染对细胞代数的影响(个,±s)
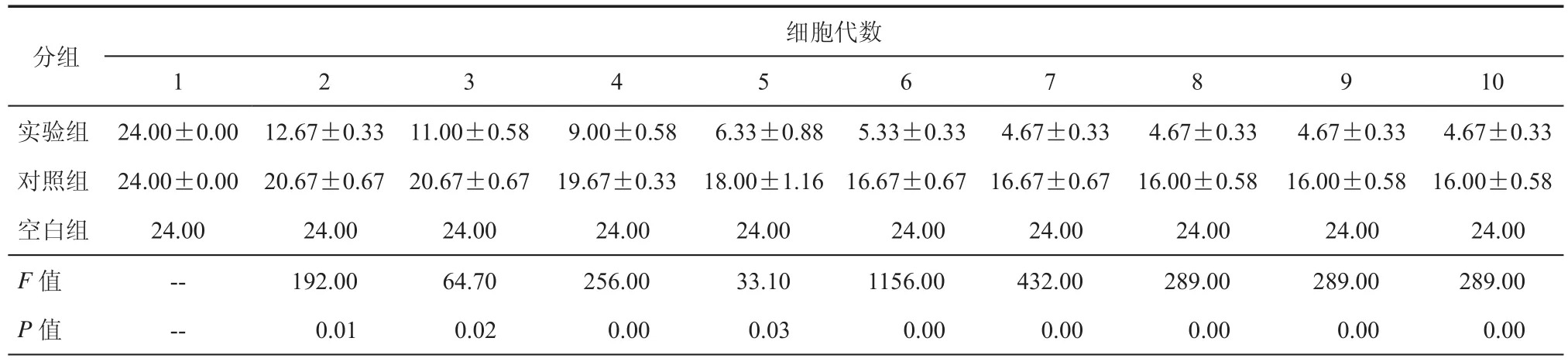
表1 慢病毒pSin-GFP转染对细胞代数的影响(个,±s)
注:F细胞代数=1496.0,F = 121.1,F组间交互= 20.65;P均< 0.05
细胞代数分组10实验组 24.00±0.00 12.67±0.33 11.00±0.58 9.00±0.58 6.33±0.88 5.33±0.33 4.67±0.33 4.67±0.33 4.67±0.33 4.67±0.33对照组 24.00±0.00 20.67±0.67 20.67±0.67 19.67±0.33 18.00±1.16 16.67±0.67 16.67±0.67 16.00±0.58 16.00±0.58 16.00±0.58空白组 24.00 24.00 24.00 24.00 24.00 24.00 24.00 24.00 24.00 24.00 F值 -- 192.00 64.70 256.00 33.10 1156.00 432.00 289.00 289.00 289.00 P值 -- 0.01 0.02 0.00 0.03 0.00 0.00 0.00 0.00 0.00 1 2 3 4 5 6 7 8 9
结 果
一、pSin-GFP病毒感染iPS细胞
用包装衣壳蛋白的质粒pMD2.G和psPAX2连同pSin-GFP都用于病毒包装,Lipofectamine 3 000、DNA的混合液体加入293T中,实验组和对照组病毒感染细胞后24 h观察绿色荧光(图1)。
二、高剂量慢病毒pSin-GFP转染对细胞影响
在病毒感染细胞后挑选得到的单克隆细胞继续传代,从图2a可以看到细胞克隆中高亮的细胞为凋亡的细胞,部分克隆凋亡细胞增多,传至6 ~ 8代时多数克隆全部凋亡,少部分克隆未有完全凋亡可稳定传代,图2b可见细胞克隆中高亮细胞明显减少,凋亡较少。
三、高剂量慢病毒pSin-GFP转染对细胞代数的影响
高剂量慢病毒的表达引起单克隆细胞株在传代后凋亡,使用高剂量的慢病毒感染干细胞的实验组与对照组比较高剂量慢病毒对干细胞生长状态和传代次数差异有统计学意义(P < 0.01)。如表1,从单克隆细胞株可传代代数中发现细胞在感染病毒的前几代中细胞状态较好,但是在第3代后慢病毒对细胞的影响渐渐表现出来,引起大部分克隆的凋亡。
四、药筛过后iPS细胞表达绿色荧光鉴定
药筛后未感染病毒的iPS细胞凋亡,为了验证传代后细胞仍旧稳定表达绿色荧光,通过流式检测出药筛后实验组中有94%的iPS细胞稳定高表达绿色荧光,空白组iPS细胞几乎没有绿色荧光的表达如图3。

图1 荧光显微镜下观察两组pSin-GFP病毒感染24h后iPS细胞形态(×100)
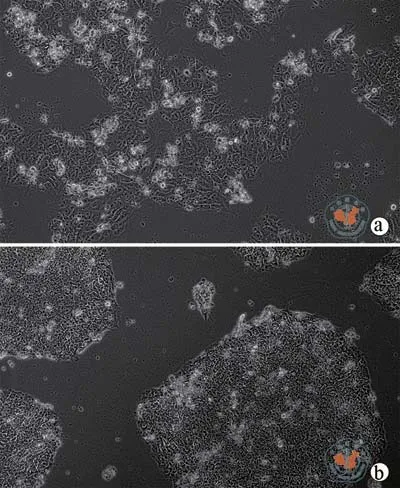
图2倒置显微镜下观察两组病毒感染24 h后iPS细胞形态(×100)
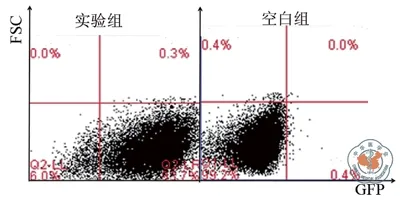
图3 流式检测药筛后实验组iPS细胞绿色荧光表达量
五、高剂量慢病毒pSin-GFP转染对iPS细胞影响werstern和免疫荧光检测蛋白表达情况
为了鉴定高剂量pSin病毒对细胞多能性的影响,将使用高剂量病毒转染iPS细胞组与未使用高剂量病毒转染iPS细胞组中通过werstern检测Oct-4蛋白和Sox2蛋白表达情况如图4所示。通过免疫荧光检测多能性基因SSEA-1和Nanog和Tra-1-60细胞的表达情况结果如图5所示;实验组中Oct-4蛋白与空白组中基本一致,Sox2蛋白表达情况也基本一致,说明在传代稳定后细胞的多能性并未受到影响,并且细胞形态与消化传代时间也基本一致。
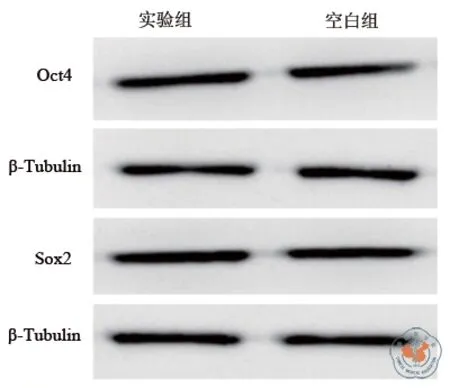
图4 werstern检测Oct-4蛋白和Sox2蛋白表达情况

图5 免疫荧光检测多能性基因SSEA-1和Nanog和Tra-1-60细胞的表达情况
讨 论
iPS是通过体细胞重编程、去分化在体外诱导得到的,尽管该细胞目前尚存许多机制未明,但其优势和潜能在临床应用前景广泛。因此许多研究者在将该细胞的研究关注其的临床应用。近年来研究者发现可用于诱导分化成为iPS细胞的体细胞并不局限于某几种细胞类或者不同阶段,例如:肝细胞[7-8]、胃(肠)上皮细胞[7-8]、成熟B淋巴细胞[9]等。三个胚层来源的细胞或者处于不同阶段的细胞都可以通过添加特定的因子重编程为iPS细胞[10]。目前研究者用血细胞(T细胞和B细胞等)、脂肪细胞和皮肤成纤维细胞重编程为iPS细胞[10]。
与胚胎干细胞(embryonic stem cells,ES)相似的iPS细胞可参与形成机体所有组织和器官。在过去几年的研究中iPS细胞研究取得了巨大进步,同时iPS细胞的重编程方法也在不断改进中[11],其使用于临床的安全性也在不断加强[12];从小分子化合物、miRNA、缺氧条件等的应用。iPS细胞研究不仅具有重要理论意义,而且在对于基因修饰后的iPS细胞可以直接应用在再生医学、组织工程和药物发现与评价等方面,但是就目前研究的关于慢病毒对于iPS细胞影响的文献较少。
首次成功的临床应用是用病毒治疗儿童的严重联合免疫缺陷疾病-X1[13]。在后来几例治疗中都因为病毒的毒性作用而使患者患上白血病。对于逆转录病毒上调的诱变引起的恶性肿瘤已经被证实并且成为了使用病毒的重要关注点[14-17]。在2007年有科学家证实慢病毒在介导基因插入靶细胞是引发大约病毒的插入诱变的主要原因,并且这些诱变的位点都集中在原癌基因和生长控制的基因上[18]。该团队证实慢病毒的介导基因插入靶细胞的插入诱变为8%,而且插入位点的热点并不全都是集中在影响原癌基因和生长控制的基因位点上的。在动物骨髓细胞[19]和肝细胞[20]的研究中,慢病毒介导的基因转导位点也并非都集中在与生长相关的基因座中。并且在慢病毒的感染过程中并没有看到细胞有呈单克隆的扩增状态[19-20]。因此慢病毒成为基因修饰常用的工具和手段,但是其安全性少有研究。
本文针对这个问题利用高剂量慢病毒感染iPS细胞,并且发现慢病毒载体对细胞有一定的毒性。以1:1的正常剂量感染iPS细胞未引起细胞大量凋亡,如果以高剂量1:200的量感染细胞慢病毒对iPS细胞的影响十分明显,因此考虑到Psin载体在介导目的基因整合到iPS细胞中同时病毒自身的片段也会整合到细胞当中,而这部分基因对iPS细胞生长的影响和传代稳定性一直未有报道。本文就此进行了初步的研究,在传代十代时细胞性质趋于稳定,并且通过werstern和免疫荧光的检测,稳定传代后的细胞特性未有变化并且其携带的目的基因也可以正常稳定的表达。因此对于基因修饰后的iPS细胞生物学性质的研究应该在十代之后,待细胞稳定传代后进行。iPS细胞成为现在的研究热点,虽然目前仍有许多问题需要去解决,但是在未来其必可为人类疾病治疗翻开新的篇章。
1 Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J]. Cell, 2007,131(5):861-872.
2 Lerou PH, Daley GQ. Therapeutic potential of embryonic stem cells[J].Blood Rev, 2005, 19(6):321-331.
3 Murry CE, Keller G. Differentiation of embryonic stem cells to clinically relevant populations: lessons from embryonic development[J]. Cell, 2008, 132(4):661-680.
4 Zhang D, Jiang W, Liu M, et al. Highly efficient differentiation of human ES cells and iPS cells into mature pancreatic insulin-producing cells[J]. Cell Res, 2009, 19(4):429-438.
5 Song ZH, Cai J, Liu YX, et al. Ef fi cient Generation of hepatocyte-like cells from human induced pluripotent stem cells[J]. Cell Res, 2009,19(11):1233-1242.
6 Wernig M, Zhao JP, Pruszak J, et al. Neurons derived from reprogrammed fi broblasts functionally integrate into the fetal brain and improve symptoms of rats with Parkinson's disease[J]. Proc Natl Acad Sci U S A, 2008, 105(15):5856-5861.
7 Aoi T, Yae K, Nakagawa M, et al. Generation of pluripotent stem cells from adult mouse liver and stomach cells[J]. Science, 2008,321(5889):699-702.
8 Stadtfeld M, Nagaya M, Utikal J, et al. Induced pluripotent stem cells generated without viral integration[J]. Science, 2008,322(593):945-949.
9 Hanna J, Markoulaki S, Schorderet P, et al. Direct reprogramming of terminally differentiated mature B lymphocytes to pluripotency[J].Cell, 2008, 133(2):250-264.
10 申红芬, 姚志芳, 肖高芳, 等. 诱导性多潜能干细胞(iPS cells)——现状及前景展望[J]. 生物化学与生物物理进展, 2009, 36(8):950-960.
11 Bhutani N, Brady JJ, Damian M, et al. Reprogramming towards pluripotency requires AID-dependent DNA demethylation[J]. Nature,2010, 463(7284):1042-1047.
12 Nakagawa M, Takizawa N, Narita M, et al. Promotion of direct reprogramming by transformation-de fi cient Myc[J]. Proc Natl Acad Sci U S A, 2010, 107(32):14152-14157.
13 Cavazzana-Calvo M, Hacein-Bey S, De Saint Basile G, et al. Gene therapy of human severe combined immunodeficiency (SCID)-X1 disease[J]. Science, 2000, 288(5466):669-672.
14 Hacein-Bey-Abina S, Von Kalle C, Schmidt M, et al. LMO2-associated clonal T cell proliferation in two patients after gene therapy for SCIDX1[J]. Science, 2003, 302(5644):415-419.
15 Hacein-Bey-Abina S, Garrigue A, Wang GP,et al. Insertional oncogenesis in 4 patients after retrovirus-mediated gene therapy of SCID-X1[J]. J Clin Invest, 2008, 118(9):3132-3142.
16 Howe SJ, Mansour MR, Schwarzwaelder K, et al. Insertional mutagenesis combined with acquired somatic mutations causes leukemogenesis following gene therapy of SCID-X1 patients[J]. J Clin Invest, 2008, 118(9):3143-3150.
17 Stein S, Ott MG, Schultze-Strasser S, et al. Genomic instability and myelodysplasia with monosomy 7 consequent to EVI1 activation after gene therapy for chronic granulomatous disease[J]. Nat Med, 2010,16(2):198-204.
18 Cattoglio C, Facchini G, Sartori D, et al. Hot spots of retroviral integration in human CD34+hematopoietic cells[J]. Blood, 2007,110(6):1770-1778.
19 Ronen K, Negre O, Roth S, et al. Distribution of lentiviral vector integration sites in mice following therapeutic gene transfer to treat β-thalassemia[J]. Mol Ther, 2011, 19(7):1273-1286.
20 Rittelmeyer I, Rothe M, Brugman MH, et al. Hepatic lentiviral gene transfer is associated with clonal selection, but not with tumor formation in serially transplanted rodents[J]. Hepatology, 2013,58(1):397-408.
Effect of high dose pSin lentiviral vector-mediated transfection on pluripotent stem cells
Huang Yijuan1, Huang Qiang2, Lyu Qu3.
1Department of immunology,Sun Yat-sen University Zhongshan School of Medicine, Guangzhou 51000 China;2State Intellectual Property Office Patent Office Patent Examination Cooperation Guangdong Center, Guangzhou 51000, China;3Guangzhou Runcheng Chemical Materials Limited Company,Guangzhou 51000,China
Lyu Ou, Email: 441823577@qq.com
ObjectiveTo study the effect of lentiviral vector pSin-mediated gene modification on pluripotent stem cell lines.MethodsThe lentivirus pSin-GFP was packaged, iPS cells were divided into experimental group(cell and virus titer ratio 1 : 200)and control group(cell and virus titer ratio 1 : 1)and infected with virus. Stem cells were harvested and the single cell clones were obtained by limit dilution method. The cell clones after infection was calculated by subculture and pluripotent stem cell markers were detected by Western blot and immunofluorescence staining.The results were analyzed by variance analysis and t test.ResultsTwenty-four monoclonal cell lines were selected after 10 generations. Cell cloning number of the experimental group(4.67±0.33)was significantly fewer than that of the control group(16.00±0.58)(t =17.00,P < 0.01). Stable passaged cells expressed Oct-4, Sox2, Nanog, SSEA-1 and Tra-1-60.ConclusionAfter genetic modification, the proliferation potential of iPS decreases, but their morphology is not changed and they express common stem cell markers.
Pluripotent stem cells; Lentivirus; Genetically modified
2016-12-30)
(本文编辑:李少婷)
10.3877/cma.j.issn.2095-1221.2017.03.001
510080 广州,中山大学中山医学院基础医学系1;510630 广州,中山大学附属第三医院肝脏外科暨肝移植中心 中山大学器官移植研究所 广东省器官移植研究中心2;510535 广州,国家知识产权局专利局专利审查协作广东中心3
张英才,Email:76207884@qq.com
黄乙涓,叶林森,唐晖,等.高剂量pSin慢病毒载体介导的转染对诱导性多能干细胞影响的研究[J/CD].中华细胞与干细胞杂志(电子版),2017,7(3):125-130.

