草果油抗MRSA体外活性研究*
徐 航,龙娜娜,林 琳,李建龙,代 敏,2△,孙丰慧,2△,唐婉林,陈玉平,张 芬
1.成都医学院 检验医学院(成都 610500);2.成都医学院四川省动物源性食品兽药残留防控技术工程实验室(成都 610500);3.成都医学院 人文信息管理学院(成都 610500)
·论著·
草果油抗MRSA体外活性研究*
徐 航1,龙娜娜1,林 琳1,李建龙1,代 敏1,2△,孙丰慧1,2△,唐婉林1,陈玉平1,张 芬3
1.成都医学院 检验医学院(成都 610500);2.成都医学院四川省动物源性食品兽药残留防控技术工程实验室(成都 610500);3.成都医学院 人文信息管理学院(成都 610500)
目的 探讨草果油抗耐甲氧西林金黄色葡萄球菌 (methicillin-resistantstaphylococcusaureus, MRSA)体外活性和逆转MRSA对β-内酰胺类抗生素的多重耐药活性,为后续综合开发抗MRSA感染中药新药提供科学依据。方法 采用96-孔板微量稀释法分别测定草果油的最低抑菌浓度(MIC)和最低杀菌浓度(MBC),微量棋盘稀释法测定草果油与3种β-内酰胺类抗生素(阿莫西林、头孢氨苄和头孢吡肟)的联合抑菌指数(FIC)。结果 草果油具有明显体外抗MRSA活性,MIC和MBC分别为0.36 ~2.90 mg/mL、1.45 ~11.61 mg/mL;且草果油能明显增强3种β-内酰胺类抗生素(阿莫西林、头孢氨苄和头孢吡肟)抗MRSA的体外活性,除1株(3.70%)在与头孢吡肟联合使用时表现为无关作用外,其余均表现为协同和相加作用,协同率分别为81.48%、81.48%和77.78%,5株(18.52%)表现为相加作用。结论 草果油具有较强的抗MRSA活性及逆转MRSA对β-内酰胺类抗生素的多重耐药活性能力,具有开发与运用防治MRSA感染中药新药的前景。
草果油;耐甲氧西林金黄色葡萄球菌;体外抗菌活性;逆转多重耐药活性; β-内酰胺类抗生素
自1961年Jevons在英国首次发现耐甲氧西林金黄色葡萄球菌 (methicillin-resistantstaphylococcusaureus, MRSA)以来,MRSA在上世纪70年代遍布全球,是目前院内感染和社区获得性感染最常见、最重要的多重耐药致病菌,可引起肺炎、心内膜炎和败血症等严重感染[1-4]。MRSA感染与乙型肝炎、艾滋病被列为世界三大最难解决的感染性疾病[5]。中药作为我国的传统药物,具有非特异性抗菌作用,并能调节和提高机体免疫力,且毒副作用小、不易产生耐药性[6]。草果(Amomumtsao-koCrevost et Lemaire) 是我国重要的药食两用植物,为姜科豆蔻属植物草果的干燥成熟果实,主产于广西、云南、贵州等地,具有燥湿温中、截疟除痰的功效,用于寒湿内阻,痞满呕吐,疟疾寒热,瘟疫发热等证,广泛用于治疗痔疮、咽喉感染、消化系统疾病、恶心和腹痛等病症[7-8];作为东南亚地区重要的食用香料,多用于糕点、食物、火锅等食品的调味品[9]。现代研究[10]表明,草果及其提取物具有调节胃肠功能、减肥降脂、降血糖、抗氧化、抗肿瘤、防霉和抗炎镇痛等药理活性。草果挥发油是草果的主要活性部位,含有1,8-桉叶素、香叶醇和柠檬醛等多种化学成分[11-12],具有抗氧化、调节胃肠功能、抗菌、抗肿瘤及改变药物通透性等药理作用[13]。本研究旨在研究草果挥发油自身抗MRSA活性及与β-内酰胺类抗生素联合使用的协同增效作用,为后续抗MRSA感染中药新药的综合开发与应用奠定基础。
1 材料与方法
1.1 实验菌株
MRSA标准株ATCC43300和ATCC33591均购自美国典型菌种保藏中心;MRSA临床分离株25株来源于四川省妇幼保健院;所有菌株均保存于成都医学院医学检验实验教学示范中心(表1)。
1.2 实验药物
草果,产于云南,购自北京同仁堂;抗生素:阿莫西林,批号:B326BA3634,购自生工生物工程(上海)股份有限公司;头孢氨苄,批号:BA14BA0016,购自生工生物工程(上海)股份有限公司;头孢吡肟,批号:RK9Y-DN25,购自中国食品药品检定研究院。
1.3 培养基和试剂
MUELLER-HINTON BROTH(MHB),批号:583507,购自英国OXOID公司;MUELLER-HINTON AGAR(MHA),批号:1376993,购自英国OXOID公司;营养琼脂,批号:20150810,购自北京奥博星生物技术有限责任公司;0.5麦氏比浊管,购自bioMerieux SA公司;Tween-80,批号:20150429,购自国药集团化学试剂有限公司;0.9%氯化钠注射液,批号:B16051903,购自四川科伦药业股份有限公司;96-孔板,批号:160805-078,购自加拿大JET BIOFIL公司。

表1 受试菌株的编号和来源
1.4 实验方法
1.4.1 草果油提取 按照中华人民共和国药典标准,采用水蒸气蒸馏法提取草果挥发油,并用无水十二烷基磺酸钠进行去水处理,测其密度(ρ=929 mg/mL),存放于棕色瓶中,4 ℃冰箱保存备用。
1.4.2 最低抑菌浓度(MIC)测定 1)药液稀释:以Tween-80为乳化剂,对草果油进行乳化,制备成185.80 mg/mL草果乳化液母液,4 ℃冰箱保存备用。以无菌水为溶剂,将抗生素溶解和稀释,配制成浓度为4 096 μg/mL的母液,4 ℃冰箱保存备用。采用二倍稀释法分别对草果油乳化液和抗生素母液进行系列稀释,共稀释成12个不同浓度梯度的稀释液,用于测定MIC、MBC和FIC。2)菌液制备:取各受试菌进行活化,挑取单克隆菌落于0.9%生理盐水中,将菌液配置成0.5麦氏浓度(1.5×108CFU/mL),后用Mueller-Hinton无菌肉汤培养基稀释50倍备用。3)MIC测定:96-孔板微量棋盘稀释法分别测定草果油和阿莫西林、头孢氨苄、头孢吡肟的MIC值[14-15]。具体方法如下:在96-孔板中每孔分别加入100 μL MHB,50 μL稀释后的不同浓度药液,50 μL制备的受试菌液,使草果油在每孔中的终浓度为0.02~ 46.45 mg/mL,抗生素的终浓度为1~2 048 μg/mL,37 ℃恒温培养18~24 h,观察受试菌的生长情况,以无生长的药物最低浓度为该药对该受试菌的MIC值;以不加药物为受试菌的阳性对照,以不加菌液为药物阴性对照,以仅含培养液的为空白对照,每株受试菌进行3个平行实验,实验重复3次。
1.4.3 最低杀菌浓度(MBC)测定 药液稀释和菌液配制同MIC测定。MBC测定:首先用96-孔板微量棋盘稀释法测定草果油对不同受试菌的MIC值(方法同上),37 ℃恒温培养箱培养18~24 h后,将培养板中未见细菌生长的肉汤接种于MHA琼脂平板上,37 ℃恒温培养18~24 h,观察受试菌生长情况,以未见菌落生长的最小药物浓度,即引起大多数细菌裂解的最低浓度为该药物MBC值[16]。以不加药物为受试菌的阳性对照,以不加菌液为药物阴性对照,以仅含培养液的为空白对照,每株受试菌进行3个平行实验,实验重复3次。
1.4.4 联合抑菌指数(FIC)测定 药液稀释和菌液制备同MIC测定。FIC测定:根据草果油和β-内酰胺类抗生素(阿莫西林、头孢氨苄和头孢吡肟)的MIC结果,用微量棋盘稀释法测量草果油与β-内酰胺类抗生素联合使用的FIC值[29-31]。具体方法如下:将96孔板横排(1-12),竖列(A-E)分别加上不同浓度梯度(0.06~2.00 MIC)的草果油(甲药)和受试抗生素(乙药)各50 μL,再加上100 μL受试菌液,使其终浓度为5×105CFU/mL,37 ℃恒温培养18~24 h,观察细菌生长情况。以不加药物为受试菌的阳性对照,以不加菌液为药物阴性对照,以仅含培养液的为空白对照,每株受试菌进行3个平行实验,实验重复3次。FIC计算:FIC=甲药联用的MIC/甲药单用的MIC + 乙药联用的MIC/乙药单用的MIC)[17]。结果判断:FIC≤0.5为协同作用,0.5
2 结果
2.1 草果油抗MRSA体外活性
用96-孔板微量棋盘稀释法分别测定了草果油和3种β-内酰胺类抗生素(阿莫西林、头孢氨苄和头孢吡肟)的MIC(表2)。结果表明,草果油对MRSA的MIC为0.36 ~2.90 mg/mL,均值为(1.05 ± 0.37 )mg/mL;MBC为1.45~11.61 mg/mL,说明草果油具有明显抗MRSA体外活性。临床常用3种β-内酰胺类抗生素(阿莫西林、头孢氨苄、头孢吡肟)对MRSA的MIC分别为4~128 μg/mL、4 ~512 μg/mL、4~512 μg/mL;MBC分别为32 ~1 024 μg/mL、256 ~1 024 μg/mL、256 ~1 024 μg/mL,3种抗生素多表现为高水平耐药。
2.2 草果油增强β-内酰胺类抗生素抗MRSA体外活性
棋盘法分别测定了草果油和3种β-内酰胺类抗生素(阿莫西林、头孢氨苄、头孢吡肟)联合使用抗MRSA的FIC指数,分析了草果油与β-内酰胺类抗生素联合使用对2株MRSA标准株的活性变化(表3)。结果表明,草果油与3种β-内酰胺类抗生素(阿莫西林、头孢氨苄、头孢吡肟)联合使用时,能明显降低阿莫西林、头孢氨苄和头孢吡肟对MRSA的MIC,说明草果油能有效逆转MRSA标准株ATCC33591和ATCC43300的多重耐药活性。统计分析了草果油和β-内酰胺类抗生素联合使用对27株MRSA受试菌的相互作用(表4)。结果表明,苹果油分别与3种β-内酰胺类抗生素联合使用,主要表现为协同作用,其次为相加作用,仅有1株(3.70%)表现为无关作用。其中与阿莫西林、头孢氨苄和头孢吡肟的协同率分别为81.48%、81.48%和77.78%,说明苹果油与3种β-内酰胺类抗生素(阿莫西林、头孢氨苄、头孢吡肟)对80%左右的MRSA菌株具有协同作用,5株(18.52%)表现为相加作用,说明草果油可有效增强β-内酰胺类抗生素治疗MRSA的作用,具有逆转MRSA对β-内酰胺类抗生素的多重耐药活性。
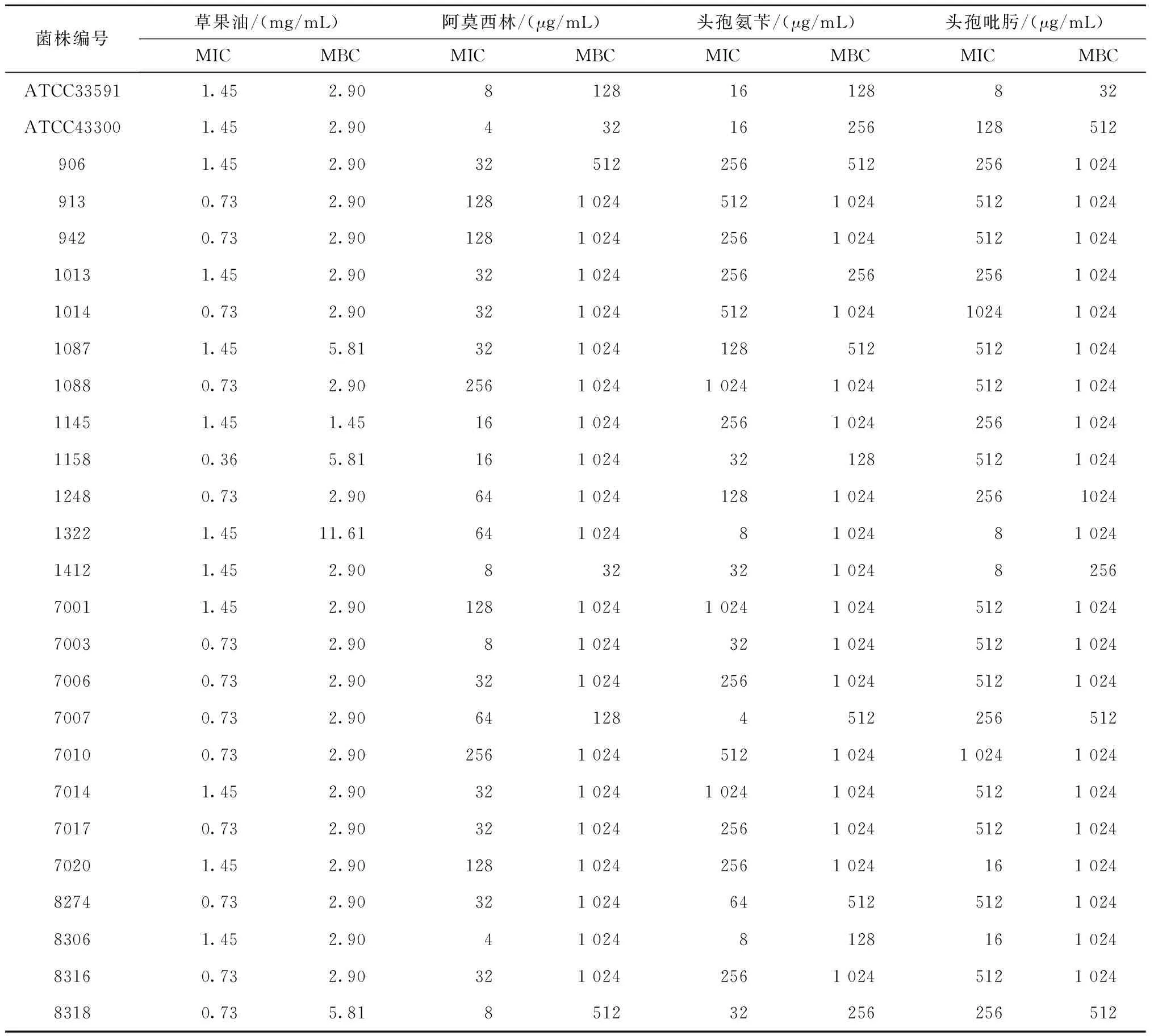
表2 草果油和3种β-内酰胺类抗生素对MRSA的体外活性

表3 β-内酰胺类抗生素与草果油联合使用对MRSA标准株的MIC比较分析

表4 草果油与β-内酰胺类抗生素联合使用抗MRSA活性[n(%),株]
3 讨论
金黄色葡萄球菌是临床上造成感染的常见菌种,常引起皮肤、组织、器官的化脓性炎症[19]。近年来,随着抗生素的广泛应用,MRSA的检出率逐年上升[20],MRSA常对β-内酰胺类、氨基糖苷类、氟喹诺酮类、四环素类和大环内酯类等多种抗生素表现为耐药。由于MRSA的广泛耐药性,目前可供临床治疗MRSA的药物非常有限,除万古霉素、利奈唑胺及达托霉素外,其他药物疗效不佳。随着MRSA感染一线药物万古霉素和利奈唑胺耐药株的不断增多[21-23],抗MRSA感染正面临“临床用药选择难,疗效不佳,发病率和病死率不断增加”的严峻挑战[24-25]。研发新型抗MRSA感染药物,包括能够控制MRSA多重耐药性的药物,成为当前药物研发和临床科技工作者的重要课题[26-28]。
草果是药食两用植物,其主要活性物质为草果仁,其挥发油是药理活性的主要有效部位。项目组前期研究发现,草果油具有明显的体内外广谱抗菌活性[11]。本研究以MRSA和临床常用抗金黄色葡萄球菌感染药物β-内酰胺类抗生素为研究对象,首先采用96-孔板微量稀释法测定了草果挥发油对2株MRSA标准株和25株MRSA临床分离株的MIC、MBC,发现草果油能明显抑制MRSA活性,MIC和MBC分别为0.36~2.90 mg/mL、1.45~11.61 mg/mL,说明草果油具有明显抗MRSA体外活性;耐药性分析表明,3种β-内酰胺类抗生素阿莫西林、头孢氨苄、头孢吡肟对临床分离MRSA菌株的MIC值大于4 μg/mL,均为耐药菌株,且多数MIC大于64 μg/mL,表现为高耐药。其次用棋盘法进一步研究了草果油与阿莫西林、头孢氨苄、头孢吡肟3种抗生素联合使用对27株MRSA的抑菌效果,结果发现草果油在与3种β-内酰胺类抗生素联合使用时,21株(77.78%)等多数菌株表现为协同作用,5株(18.52%)等少数菌株表现为相加作用;与头孢吡肟联合使用时,1株MRSA菌株表现为无关作用。
综上所述,目前国内外尚未见有关草果抗MRSA及逆转MRSA多重耐药活性的研究报道,本研究首次对草果油体外MRSA活性及逆转MRSA对β-内酰胺类抗生素多重耐药活性进行了研究,发现草果油具有明显体外抗MRSA活性和逆转MRSA多重耐药活性,具有开发与运用防治MRSA感染新药的前景,但其具体作用机制和体内疗效有待后续深入研究。
[1]Bosch T, Verkade E, van Luit M,etal. Transmission and persistence of livestock-associated methicillin-resistant Staphylococcus aureus among veterinarians and their household members[J]. Appl Environ Microbiol, 2015, 81(1): 124-129.
[2] Xu-hong Y, Falagas M E, Dong W,etal. In vitro activity of fosfomycin in combination with linezolid against clinical isolates of methicillin-resistant Staphylococcus aureus[J]. J Antibiot, 2014, 67(5): 369-371.
[3] Antignac A, Tomasz A. Reconstruction of the Phenotypes of Methicillin-Resistant Staphylococcus aureus by Replacement of the Staphylococcal Cassette Chromosome mec with a Plasmid-Borne Copy of Staphylococcus sciuri pbpD Gene[J]. Antimicrobial Agents and Chemotherapy, 2008, 53(2): 435-441.
[4] Klein E Y, Sun L, Smith D L,etal. The changing epidemiology of methicillin-resistant Staphylococcus aureus in the United States: a national observational study[J]. Am J Epidemiol, 2013, 177(7): 666-674.
[5] 窦学梅, 宋巍, 高文旃. MRSA医院感染及耐药性研究[J]. 中华医院感染学杂志, 2012, 22(9): 1943-1945.
[6] 郝佳, 刘哲, 张瑜, 等. 苦参、绿茶及紫苏叶提取物联用对金黄色葡萄球菌的体外活性研究[J]. 天津中医药大学学报, 2014, 33(5): 296-298.
[7] 尹安强, 王芳艳, 杨永红, 等. 我国草果研究文献的分析[J]. 中国医药指南, 2014, 12(34): 263-264.
[8] Rahman M R, Lou Z, Yu F,etal. Anti-quorum sensing and anti-biofilm activity of Amomum tsaoko (Amommum tsao-ko Crevost et Lemarie) on foodborne pathogens[J]. Saudi J Biol Sci, 2017, 24(2): 324-330.
[9] 冯雪, 姜子涛, 李荣. 调味香料草果挥发油的抗氧化性能及清除自由基能力[J]. 中国调味品, 2010, 35(3): 48-50,54.
[10] 代敏, 彭成. 草果的化学成分及其药理作用研究进展[J]. 中药与临床, 2011, 2(4): 55-59.
[11] Dai M, Peng C, Sun F H. Anti-infectious efficacy of essential oil from Caoguo (Fructus Tsaoko)[J]. J Tradit Chin Med,2016,36(6):799-804.
[12] 罗士数,刘小玲,仇厚援.草果提取物抑菌活性和稳定性研究[J].中国调味品,2013,38(10):27-31.
[13] 张琪, 黄燕, 杨扬. 草果挥发油的研究进展[J]. 时珍国医国药, 2014, 25(4): 931-933.
[14] Bhattacharyya S, Agrawal A, Knabe C,etal. Sol-gel silica controlled release thin films for the inhibition of methicillin-resistant Staphylococcus aureus[J]. Biomaterials, 2014, 35(1): 509-517.
[15] 肖康康, 覃容欣, 李斌, 等. 儿茶素类化合物增强β-内酰胺类抗生素抗MRSA的作用[J]. 中国抗生素杂志, 2012, 37(5): 397-400.
[16] 吕伟伟, 朱童娜, 邱欢, 等. 疏风解毒胶囊抗病毒及抗菌的体外药效学实验研究[J]. 中药新药与临床药理, 2013, 24(3): 234-238.
[17] Yang Y, Yan R W, Cai X Q,etal. Chemical composition and antimicrobial activity of the essential oil ofAmomum tsao-ko[J]. J J Sci Food Agric, 2008, 88(12): 2111-2116.
[18] 郑宝英, 张杰. 抗生素的联合用药[J]. 中国抗生素杂志, 2007, 32(6): 324-328.
[19] 孟志明, 封会茹, 赵伟, 等. 金黄色葡萄球菌引起的食物中毒[J]. 当代医学, 2008, 14(22): 71-72.
[20] 耿先龙, 马筱玲, 付广林, 等. 某院近3年金黄色葡萄球菌分布特征与耐药性分析[J]. 临床输血与检验, 2008, 10(4): 324-327.
[21] Howden B P, Beaume M, Harrison P F,etal. Analysis of the small RNA transcriptional response in multidrug-resistant Staphylococcus aureus after antimicrobial exposure[J]. Antimicrob Agents Chemother, 2013, 57(8): 3864-3874.
[22] Giltner C L, Kelesidis T, Hindler J A,etal. Frequency of susceptibility testing for patients with persistent methicillin-resistant Staphylococcus aureus bacteremia[J]. J Clin Microbiol, 2014, 52(1): 357-361.
[23] Stryjewski M E, Corey G R. Methicillin-resistant Staphylococcus aureus: an evolving pathogen[J]. Clin Infect Dis, 2014, 58(Suppl 1): S10-S19.
[24] Oliveira D C, de Lencastre H. Methicillin-Resistance in Staphylococcus aureus Is Not Affected by the Overexpression in Trans of the mecA Gene Repressor: A Surprising Observation[J]. PLoS One, 2011, 6(8): e23287.
[25] Bhattacharyya S, Agrawal A, Knabe C,etal. Sol-gel silica controlled release thin films for the inhibition of methicillin-resistant Staphylococcus aureus[J]. Biomaterials, 2014, 35(1): 509-517.
[26] Barnea Y, Navon-Venezia S, Kuzmenko B,etal. Ceftobiprole medocaril is an effective treatment against methicillin-resistant Staphylococcus aureus (MRSA) mediastinitis in a rat model[J]. Eur J Clin Microbiol Infect Dis, 2014, 33(3): 325-329.
[27] Grossman T H, Starosta A L, Fyfe C,etal. Target-and resistance-based mechanistic studies with TP-434, a novel fluorocycline antibiotic[J]. Antimicrob Agents Chemother, 2012,56(5):2559-2564.
[28] Mohtar M, Johari S A, Li A R,etal. Inhibitory and resistance-modifying potential of plant-based alkaloids against methicillin-resistant Staphylococcus aureus (MRSA)[J]. Curr Microbiol, 2009, 59(2): 181-186.
InVitroAntibacterial Activity ofAmomumTsao-koEssential Oil Against Methicillin-resistantStaphylococcusAureus
Xu Hang1, Long Nana1, Lin Lin1, Li Jianlong1, Dai Min1,2△, Sun Fenghui1,2△, Tang Wanlin1, Chen Yuping1, Zhang Fen3.
1. School of Laboratory Medicine, Chengdu Medical College, Chengdu 610500, China; 2. Sichuan Provincial Engineering Laboratory for Prevention and Control Technology of Veterinary Drug Residue in Animal-origin Food, Chengdu 610500, China; 3. School of Humanities and Information Management, Chengdu Medical College, Chengdu 610500, China
Objective To explore the in vitro antibacterial activity ofAmomumtsao-koessential oil against methicillin-resistant Staphylococcus aureus (MRSA) and to reverse the multi-drug resistance of MRSA to β-lactam antibiotics in order to provide scientific evidence for the comprehensive development of new drugs of traditional Chinese medicine against MRSA infection. Methods The 96-well plate dilution method was adopted to determine the MIC an MBC ofAmomumtsao-koessential oil. The microfluidic method was used to determine the FIC indexes of three kinds of β-lactam antibiotics (amoxicillin, cefalexin and cefepime). ResultsAmomumtsao-koessential oil had significant anti-MRSA activity invitro. MIC and MBC were (0.36~2.90)mg/mL and (1.45~11.61)mg/mL respectively. The oil could significantly enhanced anti-MRSA activity invitroof β-lactam antibiotics (amoxicillin, cephalexin and cefepime). When combined with cefepime,Amomumtsao-koessential oil showed the synergistic and additive action with the synergistic rates 81.48%, 81.48% and 77.78% respectively except in 1 strains of MRSA (3.70%) with indifferent reaction, and 5 strains (18.52%) showed the additive action. Conclusion TheAmomumtsao-koessential oil has strong anti-MRSA activity invitroagainst MRSA and the oil could reverses the multi-drug resistance of MRSA to β-lactam antibiotics. Therefore, theAmomumtsao-koessential oil provides a new prospect for developing the new drug of traditional Chinese medicine against MRSA infection.
Amomumtsao-koessential oil; Methicillin-resistantStaphylococcusaureus;Invitroantibacterial activity; Reversing multi-drug resistance; β-lactam antibiotic
http://kns.cnki.net/kcms/detail/51.1705.R.20170523.1115.008.html
10.3969/j.issn.1674-2257.2017.03.002
四川省科技厅应用基础(重点)项目(No:2016JY0014);成都中医药大学中药学国家级重点学科、中药资源系统研究与开发利用省部共建国家重点实验室培育基地开放基金;四川省省属高校科研创新团队建设计划(No:16TD0027);四川省科技厅科技支撑计划项目 (No:2016FZ0068)
TS255.1
A
△通信作者:代 敏,E-mail:daimin1015@163.com;孙丰慧,E-mail:sunfenghui@cmc.edu.cn

