艾灸对CIA模型小鼠关节炎及miRNA-155、miRNA-146a、miRNA-21表达的影响*
赵 创,李晓燕,陈春兰,李 淼,梁 薇,刘志丹△
(1.上海市宝山区中西医结合医院,上海 201999;2.上海中医药大学附属曙光医院宝山分院,上海 201999;3.上海中医药大学附属岳阳中西医结合医院,上海 200437)
艾灸对CIA模型小鼠关节炎及miRNA-155、miRNA-146a、miRNA-21表达的影响*
赵 创1,2,李晓燕1,2,陈春兰1,2,李 淼3,梁 薇1,2,刘志丹1,2△
(1.上海市宝山区中西医结合医院,上海 201999;2.上海中医药大学附属曙光医院宝山分院,上海 201999;3.上海中医药大学附属岳阳中西医结合医院,上海 200437)
目的:探讨艾灸对胶原诱导的关节炎(CIA)模型小鼠关节炎及miRNA-155、miRNA-146a、miRNA-21表达的影响。方法:24只雄性DBA/1J小鼠随机分为正常组、模型组、对照组和艾灸组。正常组之外的小鼠,用Ⅱ型胶原加佐剂尾部皮下注射建立类风湿关节炎模型。艾灸组小鼠在足三里穴、肾俞予以1 mg/壮的艾灸治疗,每只小鼠每穴灸6壮,连续治疗6天为1个疗程,共治疗2个疗程,疗程间休息2天。运用CIA小鼠模型多发性关节炎指数评分标准观察艾灸对关节肿胀的影响,病变关节矢状面切片HE染色观察关节炎症病理表现,Real-time PCR检测miRNA-155、miRNA-146a、miRNA-21的表达。结果:Ⅱ型胶原及佐剂注射后成功复制胶原诱导的关节炎小鼠模型。艾灸组在足三里穴(后三里)、肾俞穴给予12次艾灸治疗。治疗后,艾灸组及对照组小鼠关节肿胀均有所好转,关节评分的重复测量数据方差分析显示:对照组评分明显高于艾灸组。病理形态上,与正常小鼠比较,CIA模型小鼠关节面粗糙、滑膜层变薄,不经治疗的对照组小鼠中上述变化有一定程度的自行恢复,而经艾灸治疗组小鼠关节面恢复平整,滑膜层较治疗前变厚,与正常组表现较为接近。与正常小鼠比较,CIA模型小鼠miRNA-155、miRNA-146a较正常组表达增多(P<0.05);艾灸组miRNA-155、miRNA-146a表达下调,与未经治疗的对照组比较,有显著统计学差异(P<0.05),但仍未达到正常水平(与正常组比较P<0.05)。而miRNA-21表达在各组小鼠中,差异无显著性意义(P>0.05)。结论:艾灸能减轻胶原诱导的关节炎模型小鼠关节肿胀,改善滑膜炎症,其机制可能与下调miRNA-155、miRNA-146a有关。
miRNA;类风湿关节炎;艾灸;痹证
类风湿关节炎(Rheumatoid arthritis,RA)是一种以多关节滑膜慢性炎症为主要表现的全身性炎症性自身免疫性疾病,关节侵犯呈多发性、对称性,主要病理特征为关节滑膜增厚合并大量炎症细胞浸润,血管翳形成及软骨组织的侵蚀与破坏[1],属中医“痹症”范畴,又称“顽痹”“尪痹”和“白虎历节”等。
近年来,大量的临床报道和实验动物研究表明:灸法治疗类风湿关节炎有较好的疗效[2-3],能减轻炎症反应、改善症状。其机制可能是改善关节滑膜细胞细胞器的结构异常[4],减轻关节滑膜的充血水肿、炎细胞浸润、滑膜细胞增生、组织增厚等渗出性变,诱导关节滑膜细胞的凋亡[5-6],下调相关炎症因子的基因和蛋白表达[7-18]。
微小RNA(microRNA,miRNA)是一类新发现的、微小的、非编码的RNA,在转录后水平调节多个靶基因表达。研究表明miRNA在调节免疫功能中具有重要作用。近年来的研究表明,miRNA在RA的发生、发展中起着重要作用,相关研究发现在RA患者外周血及关节滑液中大量miRNA表达异常,如miRNA-155、miRNA-146a、miRNA-21等,并可能影响RA中Th17、Treg细胞的分化及数量[19]。因此,艾灸是否对RA相关miRNA有积极影响,是需要回答的重要问题。本研究围绕艾灸对RA动物模型中miRNAs的影响进行了实验研究,报道如下。
1 材料和方法
1.1 实验动物与饲养场所
雄性DBA/1J小鼠24只,8~10周龄,南京大学-南京生物医药研究院实验动物中心提供,许可证号为SCXK(苏)2015-0001。小鼠适应性饲养1周后,随机分为4组,每组6只。第1组为正常组,后3组混合后进行RA造模,然后再随机分为模型组、对照组和艾灸组。实验中,分笼饲养,每笼3只,投放普通小鼠饲料,自然光照,并定期清洁、消毒。实验过程中对动物的处置符合中华人民共和国科技部2006年颁布的《关于善待实验动物的指导性意见》。
1.2 材料和试剂
牛Ⅱ型胶原: Chondrex公司;福氏完全佐剂(Freunds' Complete adjuvant, FCA)、福氏不完全佐剂(Incomplete Freund's Adjuvant, IFA): Sigma公司;冰乙酸:上海试剂四厂;石蜡:上海国药集团;甲醛:上海国药集团;二甲苯:上海国药集团;无水乙醇:上海国药集团;氨水:上海国药集团;苏木素:BASO公司;伊红:BASO;中性树脂:上海长岛生物技术有限公司;哺乳动物淋巴细胞分离液:CEDARLANE公司;Trizol:invitrogen公司;SYBR Green PCR试剂盒:Thermo公司;逆转录试剂盒:Fermentas公司。所用化学试剂均为分析纯。
1.3 实验仪器
CX41正置显微镜:OLYMPUS公司;石蜡切片机:徕克公司,SQ2125;摊片机:徕克公司,PPTHK-21B;IMS图象分析系统:基尔顿生物科技(上海)有限公司;D5100数码相机:NIKON公司;CO2恒温培养箱:Thermo Forma公司,3111;Real-time检测仪:ABI公司,ABI-7300;低温冷冻离心机:上海卢湘仪离心机仪器有限公司,TG-16M;水浴锅:Leica公司,HI1210;成像系统:Tanon Tanon公司,5200。
1.4 胶原诱导的关节炎模型的建立
18只DBA/1J小鼠建立Ⅱ型胶原诱导的类风湿关节炎(Collagen induced arthritis,CIA)模型。参照文献[20]方法:牛Ⅱ型胶原溶解在0.05 mol/L的醋酸中,配制成2 mg/ml的胶原溶液,4℃过夜。冰浴条件下,用样本均质仪低速混合时滴加等体积的完全弗氏佐剂,配制Ⅱ型胶原乳剂(终浓度为1 mg/ml)。每只200 μl于鼠尾根部皮下注射免疫,21天后按照上述方法100 μl鼠尾基部皮内注射二次免疫。
1.5 艾灸治疗
会议邀请了美国Emory大学教授、国家千人计划特聘教授李晓江博士,以及华中科技大学同济医学院彭挺博士分别作了“转基因动物在人类疾病中的应用”和“荧光蛋白标记技术在蛋白质定位、相互作用以及动态追踪研究中的发展和应用”大会专题报告。报告精彩纷呈,大家听的意犹未尽。
艾灸组小鼠均参照文献[21-23]中大鼠的定位进行取穴,肾俞:第2腰椎棘突下两旁;足三里穴(后三里)穴:膝关节后外侧,腓骨小头下方,并用记号笔标记位置。自制小鼠艾灸固定装置:50 ml离心管,在尾部挖去2 cm2大小的部分,见封三彩图1;艾灸时将小鼠放入,灸足三里穴时,把后足从挖去的孔中拉出,露出需要艾灸的穴位进行艾灸;灸肾俞穴时,将腰部对准挖去的孔即可。艾灸材料选用南阳艾颜堂艾绒有限责任公司生产的45∶1精制艾绒。将艾绒捏成1 mg/壮的米粒样大小进行直接灸,每只小鼠每个穴位灸6壮。连续治疗6天为1个疗程,共治疗2个疗程,疗程间休息2天。
1.6 关节肿胀度观察
自艾灸治疗第1日开始,每隔1日对发病关节进行关节炎指数评分,评分标准参照文献[24-25]按照CIA小鼠模型多发性关节炎指数评分标准:0分:无红斑和水肿;1分:两只足小趾关节红斑水肿;2分:全部趾关节或前脚掌红斑水肿;3分:踝关节以下延伸到趾红斑水肿;4分:踝关节至全爪红肿或畸形。每只小鼠四肢评分相加总为关节炎指数,最高16分。观察共进行8次,根据每次观察评分结果,绘制曲线图。
1.7 取材及病理观察
CIA模型小鼠随机平均分为模型组、对照组和艾灸组3组,模型组为说明模型小鼠治疗前的情况,成模后即处死、取材;对照组不治疗,仅进行与艾灸组一样的抓取,为说明模型小鼠未经治疗的15天后的情况,与艾灸组进行对比,成模15天后与艾灸组一同处死、取材。
成模后第15天即艾灸组末次治疗后24 h,小鼠颈椎脱臼处死,于75%的酒精中浸泡10~15 min,取新鲜脾脏和踝关节。脾脏经剪碎、研磨,过200细筛,加入淋巴细胞分离液,3000 rpm离心10 min,离心完毕后吸取中间白膜层即为脾单个核细胞;加入RMPI-1640培养基进行洗涤1次。用红细胞裂解液去除红细胞;3000 rpm离心10 min,再次用RMPI-1640培养基进行洗涤1次;洗涤结束后,所得细胞沉淀用RMPI-1640培养基重悬后进行细胞计数,细胞定量后分管冻存进行后续实验。踝关节经10%福尔马林固定,石蜡包埋,矢状面切片,常规HE染色。
严格按照所购总RNA提取试剂盒、Real-Time PCR试剂盒进行操作。总RNA的提取:细胞定量,Trizol匀浆,先后加入氯仿、异丙醇,离心,弃上清,无水乙醇漂洗沉淀,加入DEPC水溶解RNA,置于-80℃冰箱保存备用。miRNA-155引物:Sense:5′ACACTCCAGCTGGGTTAATGCTAATTGTGAT 3′,Antisense:5′CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGA CCCCT 3′,反向TRP序列:5′TGGTGTCGTGGAGTCG-3′;miRNA-146a引物:Sense:5′ACACTCCAGCTGGGTGAGAACTGAATTCCA 3′,Antisense:5′CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAACCCA 3′,反向TRP序列:5′TGGTGTCGTGGAGTCG-3′;miRNA-21引物:Sense:5′ACACTCCAGCTGGGTAGCTTATCAGACTGA 3′,Antisense:5′CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTCAACA 3′,反向TRP序列:5′TGGTGTCGTGGAGTCG-3′;U6引物:F-CTCGCTTCGGCAGCACA, R-AACGCTTCACGAATTTGCGT。反转录体系: RNA-Primer Mix:12 μl,5×RT Reaction Buffer:5 μl,25mM dNTPs:1 μl,25 U/μl RNase Inhibitor:1 μl,200 U/μl M-MLV Rtase:1 μl,Oligo(dt)18:1 μl,ddH2O(DNase-free):4 μl。总体积25 μl。反应程序:37℃,60 min;85℃,5 min;4℃,5 min;置于-20℃保存。Real-time PCR扩增体系:SYBRGreen Mix:12.5 μl,上游引物F:0.5 μl,下游引物R:0.5 μl,ddH2O:9.5 μl,cDNA模板:2 μl。总体积25 μl。反应程序:95℃,10 min(95℃,15Sec;60℃,45Sec)×40;95℃,15 Sec; 60℃,1 min;95℃,15 Sec;60℃, 15 Sec;数据采用仪器自带软件分析:ABI Prism 7300 SDS Software。
1.9 统计学分析
2 结果
2.1 关节形态变化
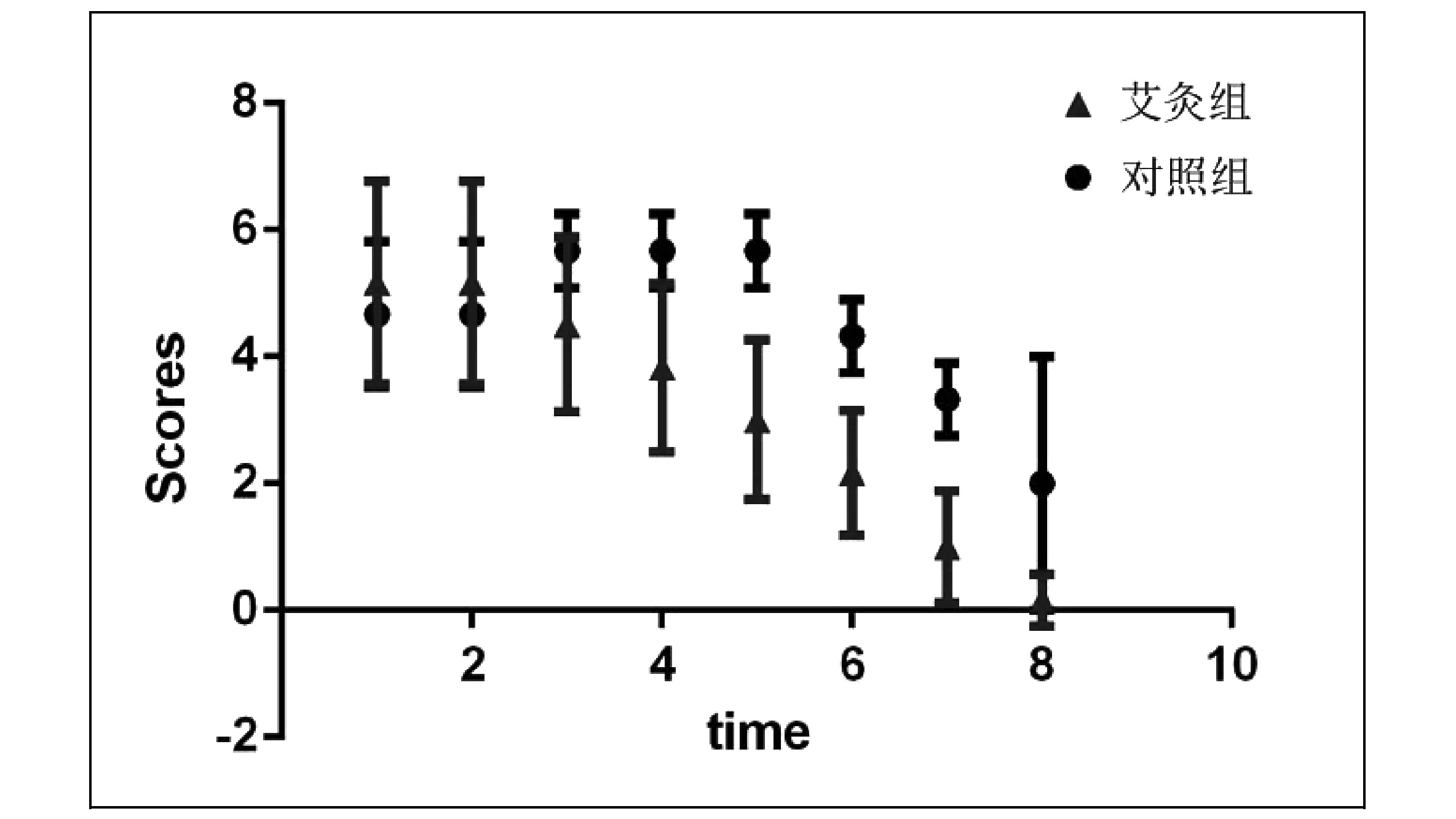
图3 艾灸组与对照组CIA小鼠的关节评分曲线对比
关节形态变化可见封三彩图2。通过观察,对照组第1次关节评分为4.67±1.15(CIA模型的基线),此时的艾灸组关节评分为5.17±1.60,二者无显著性差异;对照组随后关节肿胀经历了加重然后好转的过程,见图3,最终未经治疗15天后关节评分为2.0±2.0;而艾灸治疗组关节评分持续下降,经治疗,15天后关节评分为0.16±0.41。8次关节评分数值的重复测量数据方差分析显示,两组方差不完全相同,由图3可见,从第6天开始,对照组评分明显高于艾灸组,这说明艾灸对小鼠关节肿胀有一定治疗作用。
2.2 关节病理分析
如封三彩图4所示CIA模型建立后(模型组),与正常组关节对比,关节面粗糙、滑膜层变薄,经艾灸治疗的小鼠病变关节面恢复平整,滑膜层较治疗前变厚,与正常组表现较为接近。不经治疗的对照组,上述变化有一定程度的自行恢复,但不如艾灸组恢复的好。
2.3 Real-time PCR 检测miRNA表达
与正常小鼠比较,CIA模型小鼠miRNA-155、miRNA-146a较正常组表达增多(P<0.05),艾灸治疗后,miRNA-155、miRNA-146a表达下调,与未经治疗的对照组比较,有显著统计学差异(P<0.05),但仍未达到正常水平(与正常组比较P<0.05)。而miRNA-21表达在4组小鼠中,差异无显著性意义(P>0.05)。见图5。

图5 各组小鼠不同时间点血清miRNA表达相对定量 注:与正常组比较,*P<0.05;与艾灸组比较,△P<0.05
3 讨论
尽管既往研究报道艾灸治疗RA作用显著,但文献中少见有艾灸治疗后病理改变的图片,这可能与滑膜及滑膜细胞的改变较难观察、评估有关,而本研究提供了较为直观的观察结果。本研究显示,艾灸对CIA模型小鼠的关节肿胀有一定影响,但因为小鼠关节较小,测量其肿胀度的误差可能较大,因此,与诸多已发表的研究一样,笔者没有测量、记录、比较关节周径。关节评分显示:CIA小鼠关节功能可一定程度自我恢复,但艾灸能进一步提高效果;这与笔者在临床上观察到的现象相对一致。
研究显示:miRNA-146a在RA发病过程中起到重要作用。miRNA-146a、miRNA-155在RA患者滑膜组织中的表达水平明显高于健康正常人[26]。与骨性关节炎(OA)患者相比,RA患者滑膜中的miRNA-146a呈现高表达[27]。因此,可以认为RA中miRNA-146a可能参与RA发病。本研究中,CIA模型小鼠中miRNA-146a表达增高,艾灸治疗后下降,说明艾灸治疗的作用机制可能与下调miRNA-146a表达有关。
miRNA-155在RA患者滑膜组织中的表达水平明显高于健康正常人,并且其在RA患者滑膜成纤维细胞中的表达水平高于其在外周血中的表达水平[26]。在RA外周血及外周巨噬细胞中测定TNF-α、IL-1β释放水平和miRNA-155的表达水平发现miRNA-155能够靶向抑制SOCS1(Suppressor of cytokine signaling-1)的表达,且miRNA-155高表达与TNF-α、IL-1β表达增强之间存在相关性[28]。这说明miRNA-146a也在RA发病过程中起到重要作用。本研究中,CIA模型小鼠中miRNA-155表达增高,艾灸治疗后下降,说明艾灸治疗的作用机制可能与下调miRNA-155表达有关。
miRNA-21则可能参与RA中Th17/Treg细胞失衡的调节:Dong等[29]研究发现,与正常对照组相比,miRNA-21在RA外周血中呈现低表达,伴有STAT3(Signal Transducer and Activator of Transcription,信号传导与转录激活因子)的表达、活化增加,并降低STAT5/pSTAT5蛋白和Foxp3 mRNA表达水平,进而促进T细胞向Th17细胞方向分化,破坏体内Th17/Treg细胞的平衡,加快疾病发展进程。本研究中,miRNA-21表达在4组小鼠中无显著性差异,是一个意外的发现,是否与该品系的小鼠自身特性有关,还是人、鼠之间的差异,有待进一步研究。
miRNAs参与的生命活动和机体的调节作用十分复杂,究竟哪些miRNA与艾灸治疗的作用靶点有关,还有待进一步明确,miRNA网络分析方法[30]为未来的研究提供了有力的技术平台,值得深入研究。
[1] Cooles Faye A H,Isaacs Joan D.Pathophysiology of rheumatoid arthritis[J].Curr Opin Rheumatol,2011,23(3):233-240
[2] 胡玲,郝峰,钟峰,等.艾灸治疗类风湿关节炎的多中心随机对照临床研究[J].环球中医药,2011,6(5):401-405
[3] 陈英,曹晶晶,杨卫杰.电针加艾条温和灸治疗类风湿关节炎40例[J].光明中医,2011,26(6):1173-1174
[4] 唐照亮,宋小鸽,王宁新,等.艾灸对佐剂性关节炎大鼠滑膜细胞凋亡及病理组织的观察[J].中医药学刊,2004,22(2): 226-227
[5] 罗磊,胡玲,何璐,等.艾灸对类风湿性关节炎大鼠关节滑膜细胞超微结构的影响[J].针刺研究,2011,36(2):105-109
[6] 彭传玉,胡玲,吴子建,等.艾灸对类风湿关节炎模型大鼠滑膜细胞凋亡的影响[J].云南中医学院学报,2013,36(6):52-55
[7] 刘旭光,杨慎峭,余曙光,等.艾灸对实验性类风湿性关节炎家兔关节滑膜液MMP-3、TIMP-1含量的影响[J].成都中医药大学学报,2005,28(4):1-2
[8] 杨慎峭,刘旭光,余曙光,等.艾灸对类风湿性关节炎家兔关节滑膜液IL-1β、TNF-α含量的影响[J].成都中医药大学学报,2005,28(3):11-12
[9] 刘旭光,房繄恭,余曙光,等.艾灸对实验性RA家兔关节滑膜液FGF、EGF、PDGF含量的影响[J].中医药学刊,2006,24(3):428-429
[10] 罗磊,胡玲,宋小鸽,等.艾灸对类风湿关节炎模型大鼠跖关节中细胞因子的影响[J].环球中医药,2011,4(6):416-419
[11] 魏铮,杨露晨,杨馨,等.艾灸对类风湿性关节炎家兔滑膜细胞CyclinD1及CDK4蛋白表达的影响[J].中华中医药学刊, 2012,30(7):1503-1505
[12] 杨馨,李继书,杨慎峭,等.艾灸对实验性类风湿性关节炎家兔滑膜细胞JAK-STAT信号通路影响的研究[J].针刺研究,2007,32(2):75-82
[13] 杨馨,杨慎峭,周海燕,等.艾灸对实验性RA家兔滑膜细胞MAPK信号通路影响的研究[J].中华中医药学刊,2007,25(3):470-474
[14] 杨馨,刘旭光,王月,等.艾灸对类风湿性关节炎家兔滑膜细胞JAK-STAT通路负反馈调节家族细胞因子信号抑制因子的影响[J].针刺研究,2013,38(2):129-133
[15] 姚剑,胡玲,宋小鸽,等.艾灸“肾俞”“足三里穴”穴对类风湿关节炎大鼠滑膜组织中Ras-MAPK信号通路的影响[J].世界针灸杂志:英文版,2013,23(2):29-33
[16] 刘旭光,黄迪君,郝亮,等.艾灸对类风湿性关节炎大鼠下丘脑-垂体-肾上腺皮质轴的影响[J].中国中医基础医学杂志,2003,9(2):57-59
[17] 高骏,刘旭光,黄迪君,等.HPAA在艾灸调控类风湿性关节炎大鼠滑膜组织NF-kB信号通路中的作用[J].针刺研究,2010,35(3):198-203
[18] 郑保主,胡玲,宋小鸽,等.艾灸对类风湿关节炎大鼠下丘脑POMCmRNA和PDYNmRNA表达的影响[J].中国针灸,2013,33(5):433-437
[19] Mookherjee N, El-Gabalawy HS. High degree of correlation be-tween whole blood and PBMC expression levels of miRNA-155 and miRNA-146a in healthy controls and rheumatoid arthritis patients[J].J Immunol Methods,2013,400(401):106-110
[20] Brand DD,Latham KA,Rosloniec EF.Collagen-induced arthritis[J].Nat Protoc,2007,2(5):1269-1275
[21] 李忠仁.实验针灸学[M] 北京:中国中医药出版社,2003:327
[22] 袁娟,胡玲,宋小鸽,等.艾灸对类风湿性关节炎大鼠关节滑膜组织Toll样受体4骨髓样分化因子88核转录因子κB信号通路的影响[J].针刺研究,2015,40(3):199-204
[23] XIAO Xu,Miao-Miao Wang,Zhi ling Sun,et al.Discovery of serum proteomic biomarkers for prediction of response to moxibustion treatment rats with collagen inducedarthritis: an exploratory analysis[J].Acupunct Med,2016,34(3):184-193
[24] Brahn E,Banquerigo ML,Firestein GS,et al.Collagen induced arthritis: reversal by mercaptoethylguanidine, a novel antiinflammatory agent with a combined mechanism of action[J].J Rheumatol,1998,25(9):1785-1793
[25] Chen HH,Chen DY,Chao YH,et al.Acarbose decreases the rheumatoid arthritis Risk of diabetic patients and attenuates the incidence and severity of collagen-induced arthritis in mice[J].Sci Rep,2015,18(5):18288
[26] Stanczyk J,Pedrioli DM,Brentano F,et al.Altered expression of MicroRNA in synovial fibroblasts and synovial tissue in rheumatoid arthritis[J].Arthritis Rheum,2008,58(4):1001-1009
[27] Niimoto T,Nakasa T,Ishikawa M,et al.MicroRNA-146a expresses in interleukin-17 producing T cells in rheumatoid arthritis patients[J].BMC Musculoskelet Disord,2010,11:209
[28] Li X,Tian F,Wang F,et al.Rheumatoid arthritis-associated microRNA-155 targets SOCS1 and upregulates TNF-αand IL-1βin PBMCs[J].Int J Mol Sci, 2013,14(12):23910-23921
[29] Dong L,Wang X,Tan J,et al.Decreased expression of microRNA-21 correlates with the imbalance of Th17 and Treg cells in patients with rheumatoid arthritis[J].J Cell Mol Med,2014,18(11):2213-2224
[30] 朱亚梅,周玲玲,彭孝武,等.清络通痹方调控miRNA网络干预类风湿关节炎的研究[J].中国免疫学杂志,2016,32(4):495-499
收稿日期:2016-12-29
Moxibustion for CIA Mice and the Expressions of miRNA-155, miRNA-146a, and miRNA-21
ZHAO Chuang1,2, LI Xiao-yan1,2, CHEN Chun-lan1,2, LI Miao3,LIANG Wei1,2,LIU Zhi-dan1,2△
(1.ShanghaiBaoshanHospitalofIntegratedTraditionalChineseMedicineandWesternMedicine,Shanghai201999,China; 2.BaoshanBranchofShuguangHospitalAffiliatedtoShanghaiUniversityofTraditionalChineseMedicine,Shanghai201999,China; 3.YueyangHospitalofIntegratedTraditionalChineseandWesternMedicine,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai200437,China)
Objective:To observe the effect of moxibustion on arthritis and the expressions of miRNA-155, miRNA-146a, and miRNA-21 in the model mice with collagen induced arthritis(CIA).Methods:24 male mice of DBA/1J were randomly divided into the normal group, the model group, the control group and the moxibustion group. Mice model of rheumatoid arthritis(RA) was induced by injection of typeⅡ collagen. Moxibustion was applied to point ST36 and BL23 in the RA mice in the moxibustion group for 12 days, the ankle swelling was evaluated by RA scale; the pathological changes of articular cavity and synovial membrane were observed by HE analysis; the expressions of miRNA-155, miRNA-146a, and miRNA-21 were detected by Real-time PCR.Results:CIA model was successfully established by injection of typeⅡ collagen. The swelling joint of CIA mice partly recovered in the moxibustion group and in the control group. Difference was shown between the two groups by variability analysis of repeated eight-time measurement data of joint scale score. The joint synovial layer in the CIA mice were roughen and thinner than the normal mice, certain degree of self-repairing was observed in the control group; however, the synovial layers were much smoother and thicker in the moxibustion group compared to the control group, which were close to those in the normal group. The expressions of miRNA-155 and miRNA-146a increased in the model group compared to the normal group(P<0.05); whereas they decreased in the moxibustion group with a significant difference compared to the control group(P<0.05), but they didn’t reach the level of the normal group(P<0.05). No differences were observed among all groups in terms of miRNA-21 expression(P>0.05). Conclusion:Moxibustion can improve the joint swelling and pathological synovial changes in RA mice, and the mechanism may be related to the down-regulation of miRNA-155 and miRNA-146a expressions.
miRNA; Rheumatoid arthritis; Moxibustion; Bi syndrome
2016-11-14
国家自然科学基金青年科学基金项目,编号:81403465;上海市“杏林新星”计划项目,编号:ZY3-RCPY-2-2041;上海市宝山区卫生青年医学人才培养项目,编号:bswsyq-2014-A05。
赵创(1987-),女,住院医师,主要从事针灸临床工作。
△通讯作者:刘志丹(1981-),男,主治医师,主要从事针灸临床研究工作。
R245.81
A
1005-0779(2017)06-0060-05

