响应面法优化β-伴大豆球蛋白超高静压处理条件的研究
贺梦雪,席 俊,皮江一
(河南工业大学 粮油食品学院,河南 郑州 450001)
响应面法优化β-伴大豆球蛋白超高静压处理条件的研究
贺梦雪,席 俊*,皮江一
(河南工业大学 粮油食品学院,河南 郑州 450001)
β-伴大豆球蛋白是7S球蛋白的主要成分,是重要的大豆抗原蛋白。在单因素试验的基础上对超高静压处理压强、处理时间、β-伴大豆球蛋白质量浓度3个因素进行研究,以β-伴大豆球蛋白抗原抑制率为响应值,采用响应面法优化β-伴大豆球蛋白超高静压处理条件。结果表明:β-伴大豆球蛋白超高静压处理最佳条件为压强455 MPa、时间18 min、蛋白质量浓度15 mg/mL,在此条件下β-伴大豆球蛋白抗原性抑制率为49.59%。验证试验测得此条件下β-伴大豆球蛋白抗原抑制率为51.19%,标准偏差为1.07%,说明利用响应面法分析结果可靠。
β-伴大豆球蛋白;超高静压;β-伴大豆球蛋白抗原性;响应面
网络出版时间:2017-4-20 14:09:34
0 引言
大豆中蛋白质含量约40%[1],还富含不饱和脂肪酸、维生素和矿物质[2],具有极高的营养价值,是食品加工工业中植物蛋白的主要来源之一。但同时,大豆也是八大食物过敏原之一,包含许多抗原蛋白[3-4]。这些抗原蛋白通过干扰营养物质的消化吸收,改变机体的正常新陈代谢,引发不良生理反应,造成大豆过敏。大豆球蛋白和β-伴大豆球蛋白是大豆中的主要抗原蛋白,而且β-伴大豆球蛋白比大豆球蛋白的致敏性更强[5-6],其3个亚基α'、α、β均存在过敏原性,能被超过25%的大豆过敏患者血清所识别,因此成为大豆脱敏的重要靶向蛋白[7]。
作为一种新型的非热物理脱敏技术,超高静压主要通过改变蛋白质的结构来影响其致敏性,对食品中的氨基酸、维生素和风味物质等小分子物质无明显影响,可以最大程度保持食物原有的风味和营养,已被广泛地应用于食品生产中。超高静压能有效地降低食物致敏性,目前研究主要集中在大豆蛋白及其副产品处理中。Wang等[8]研究了高压(HP)处理对大豆蛋白分离物的一些物理化学和功能性质的影响,并指出超高静压能引起大豆蛋白结构伸展和变性,甚至引起蛋白的解聚或聚合。Li等[9-10]研究发现,超高静压处理能有效地改变婴幼儿配方食品专用大豆分离蛋白的致敏性,影响其功能特性,包括持水能力、乳化活性指数、发泡能力和乳化稳定性指数。Penas等[11]发现,大豆经高压(300 MPa,15 min)处理后再发芽,大豆芽的致敏性明显降低,可以用于工业生产低过敏大豆芽。但是,超高静压处理对β-伴大豆球蛋白抗原性的影响鲜有报道,本研究对超高静压处理前后β-伴大豆球蛋白抗原性进行分析,并对超高静压处理条件进行响应面试验优化,确定对β-伴大豆球蛋白抗原性影响最大的超高静压条件,为定位超高静压导致β-伴大豆球蛋白致敏性降低的亚分子结构提供理论依据,对探明超高静压降低β-伴大豆球蛋白致敏性的分子机制,正确指导安全食品的生产,防止食物过敏性疾病的发生有重大意义。
1 材料与方法
1.1 材料、试剂及仪器设备
β-伴大豆球蛋白:实验室保存[12];牛血清白蛋白(BSA):Solarbio公司;兔抗β-伴大豆球蛋白血清:实验室保存;羊抗兔酶标二抗(GaMIgG-HRP):Solarbio公司;TMB单组分显色液:Solarbio公司;其他试剂均为分析纯或生化试剂。
BS-210-S型电子天平:德国Sartorius公司;无菌均质袋:青岛高科技工业园海博生物技术有限公司;PB-10型pH计:德国Sartorius公司;HPP-600 MPa/5L超高静压处理装置:包头科发高压科技有限责任公司;LGJ-18C型冷冻干燥机:北京四环科学仪器厂;96孔聚苯乙烯板:美国Costar公司;Multiskan FC型酶标仪:美国Thermo公司。
1.2 方法
1.2.1 超高静压处理
超高静压处理方法参照Li等[9]的方法。将β-伴大豆球蛋白按照不同的浓度用蒸馏水稀释,置于无菌均质袋中,封口抽真空。参数设置:处理腔温度为23℃,升压速率为250 MPa/min,卸压速率为300 MPa/min。超高静压处理装置预热至所需温度,将封闭好的均质袋置于处理腔内,升压至所需压强,到达保压时间后机器自动卸压。
1.2.2 抗原性检测
采用间接竞争ELISA法检测β-伴大豆球蛋白抗原性[13]。用β-伴大豆球蛋白包被96孔酶标板(0.4 μg/mL,100 μL/孔,4℃过夜)。将超高静压处理样品、未处理样品蛋白及无蛋白竞争样品(1 μg/mL)与兔抗β-伴大豆球蛋白血清(1∶8 000)等体积混合,4℃过夜,进行初级反应。次日甩掉孔内液体,用PBST溶液洗板4~6次。5%BSA封闭1~2 h后,洗板,拍干。加入抗原抗体混合液(100 μL/孔),37℃孵育1 h,洗板,拍干。加入羊抗兔IgGHRP酶标记物,37℃孵育0.5 h,洗板,拍干。加入TMB单组分显色液(100 μL/孔),37℃显色10~15 min后,终止反应。最后测定450 nm下各孔的OD值,抗原性大小按以下公式计算:
β-伴大豆球蛋白抗原抑制率(%)=(1-OD/OD0)×100,式中:OD表示被测样品的吸光度值,OD0为无竞争体系的吸光度值。β-伴大豆球蛋白抗原抑制率越低,则样品中的β-伴大豆球蛋白抗原性越低[14],超高静压处理效果越好。
1.2.3 单因素试验
1.2.3.1 超高静压处理压强对β-伴大豆球蛋白抗原性的影响
将质量浓度为10 mg/mL的β-伴大豆球蛋白,置于无菌均质袋内,分别在200、300、400、500 MPa压力条件下处理15 min,检测β-伴大豆球蛋白抗原抑制率。
1.2.3.2 超高静压处理时间对β-伴大豆球蛋白抗原性的影响
将质量浓度为10 mg/mL的β-伴大豆球蛋白,置于无菌均质袋内,在300 MPa压力条件下分别处理5、10、15、20 min,检测β-伴大豆球蛋白抗原抑制率。
1.2.3.3 β-伴大豆球蛋白质量浓度对其抗原性的影响
将质量浓度为10、20、30、40 mg/mL的β-伴大豆球蛋白,置于无菌均质袋内,在300 MPa压力条件下处理15 min,检测β-伴大豆球蛋白抗原抑制率。
1.2.4 响应面法对β-伴大豆球蛋白超高静压处理条件的优化
根据响应面中心组合设计理论(central composite experimental design principle)[15],在单因素基础上,采用响应面法在三因子三水平上对β-伴大豆球蛋白超高静压处理条件进行优化。试验因子和水平见表1。

表1 试验因子及水平Table 1 Experimental factors and levels
2 结果与分析
2.1 单因素试验
2.1.1 超高静压处理压强对β-伴大豆球蛋白抗原性的影响
由图1可知,β-伴大豆球蛋白经过超高压处理后,相对对照而言抗原性显著下降,这可能是因为超高压引起蛋白质空间构象的改变造成的[9]。在400 MPa之前随着压强的增大,β-伴大豆球蛋白抗原抑制率逐渐降低,即抗原性逐渐减弱,在400 MPa时抗原性下降幅度最大,因此,选择超高静压处理压强为400 MPa。过敏原结构的变化往往导致抗原性的变化,在加工过程中过敏原表位可能受到一定程度的破坏,从而导致抗原性的变化。Messens等[16]认为超高静压的压强高于300 MPa时才能引起大豆蛋白结构伸展和变性。Zhang等[17]在研究超高静压对β-伴大豆球蛋白构象结构影响时发现,经高压(≥300 MPa)处理后巯基及氨基酸残基数量均显著增加。在Molina等[18]的研究中,400 MPa高压处理下,7S球蛋白解聚为部分或全部变性的单体,使表面疏水性增加。在此基础上,后续的试验主要研究超高静压对β-伴大豆球蛋白结构的影响。
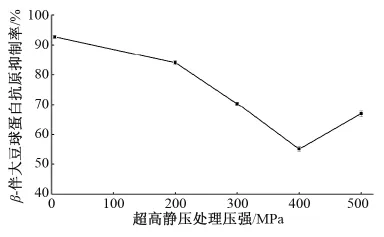
图1 超高静压处理压强对β-伴大豆球蛋白抗原性的影响Fig.1 Effect of HHP treatment pressure on antigenicity of β-conglycinin
2.1.2 超高静压处理时间对抗原性的影响
由图2可知,超高静压处理时间在5~15 min时抗原性显著下降,处理时间为15 min时,抗原性下降最为显著,因此选择超高静压处理时间为15 min。Li等[9]在研究超高静压对大豆分离蛋白致敏性的影响时发现,超高静压处理时间在5~15 min时致敏性显著下降,处理时间为15 min时致敏性下降最为显著,与此研究结果一致。
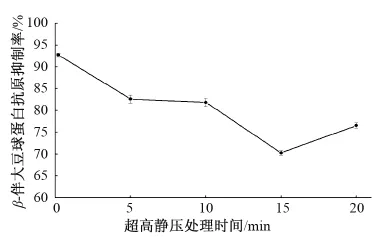
图2 超高静压处理时间对β-伴大豆球蛋白抗原性的影响Fig.2 Effect of HHP treatment time on antigenicity of β-conglycinin
2.1.3 β-伴大豆球蛋白质量浓度对其抗原性的影响
由图3可知,β-伴大豆球蛋白质量浓度从10 mg/mL到20 mg/mL递变时,抗原抑制率有轻微的下降,浓度从20 mg/mL变化到40 mg/mL时抑制率变大,因此选择蛋白质量浓度为20 mg/mL。
2.2 响应面试验结果
2.2.1 响应面试验设计与结果及方差分析
在单因素考察基础上,应用Design-Expert 8.0软件以超高静压处理压强(A)、超高静压处理时间(B)和β-伴大豆球蛋白质量浓度(C)为自变量,以抗原抑制率(R)为响应值,设计三因素三水平响应面分析试验,试验结果见表2。
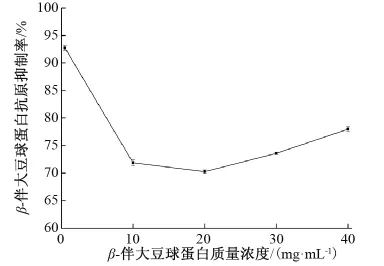
图3 β-伴大豆球蛋白质量浓度对抗原性的影响Fig.3 Effect of β-conglycinin concentration on antigenicity of β-conglycinin
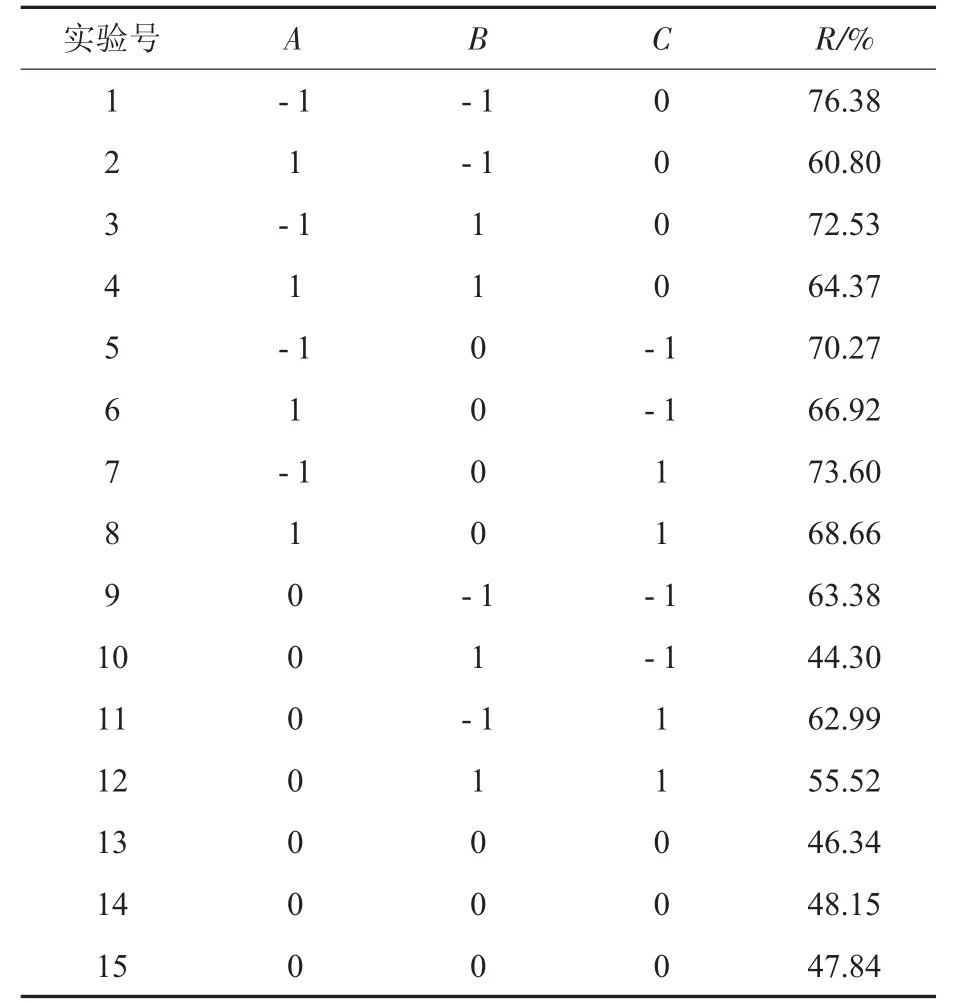
表2 响应面试验设计方案与结果Table 2 Design and results of Box-Behnken experiments
应用Design-Expert 8.0软件对所得数据进行分析,结果见表3。由表3可知,压强和时间对抗原抑制率的影响显著。3个因子经过拟合得到的回归方程为:Y=431.993 75-1.475 90A-7.722 75B-21.023 33C-1.29×10-3AB-3.975×10-3AC+0.580 50BC+1.844 58×10-3A2+0.200 523B2+3.973 33C2。
由表3方差分析结果可以看出,失拟项 P=0.064 9(不显著)说明无其他因素能显著影响本试验;模型的P值小于0.01(极显著),方程的相关系数R2=0.974 3,说明该方程拟合程度较好,可以模拟97.43%的超高静压β-伴大豆球蛋白抗原性的变化,各因素对抗原性的影响顺序为:B>A>C,即超高静压处理时间>超高静压处理压强>β-伴大豆球蛋白质量浓度。
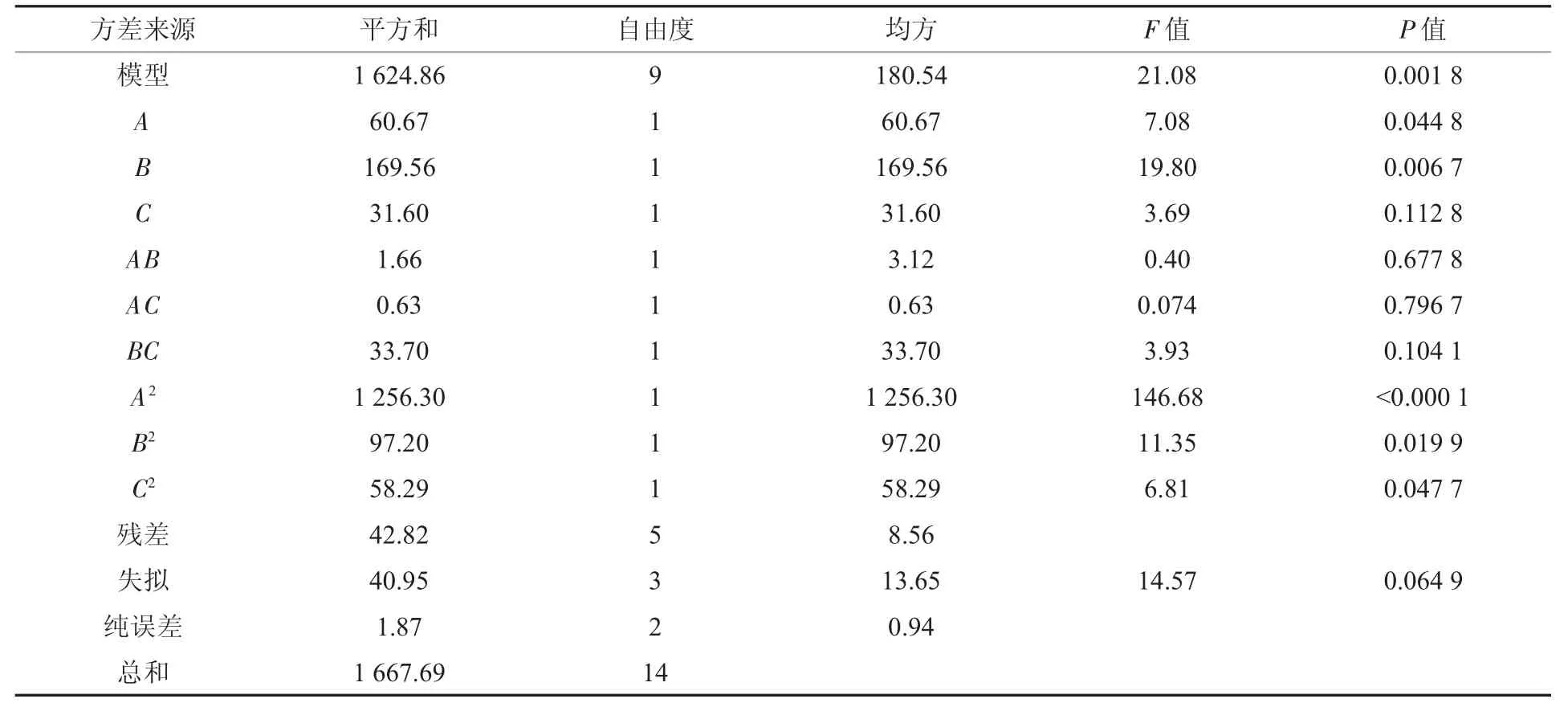
表3 方差分析Table 3 Variance analysis of RSM
2.2.2 各因素交互作用的响应面分析
根据回归方程得出不同因素交互作用的响应面3D图见图4。由图4可以直观地看出影响因素与响应值之间的关系,若曲线越陡峭,则该因素对抗原抑制率的影响越大。
图4反映了各因素交互作用对β-伴大豆球蛋白的抗原抑制率的影响,可以看出:因素B(时间)对响应值的影响最大,表现为曲线较陡;因素A(压强)与因素C(蛋白质量浓度)次之,表现为曲线较为平滑,且随其数值的增大或减小,响应值变化较小,这与方差分析中的结果一致。
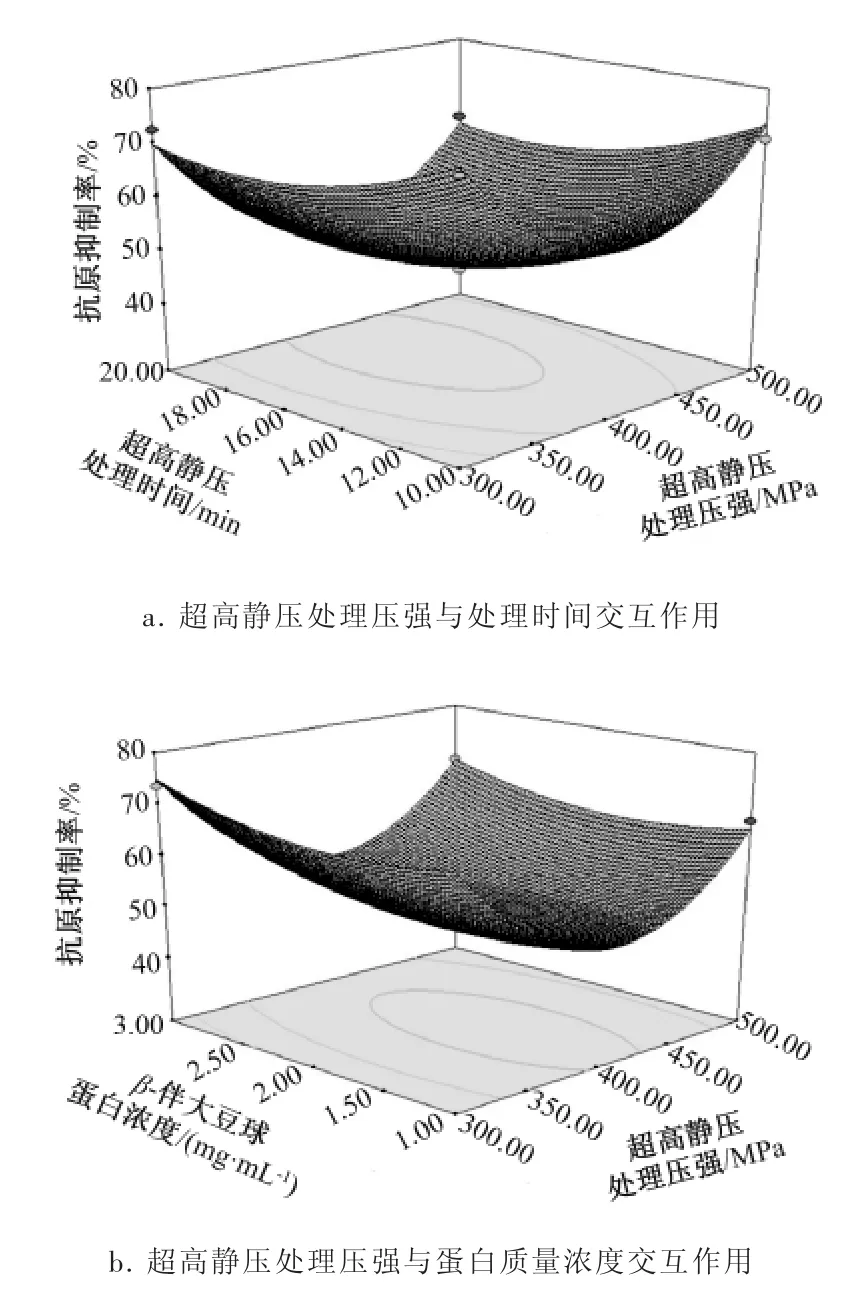
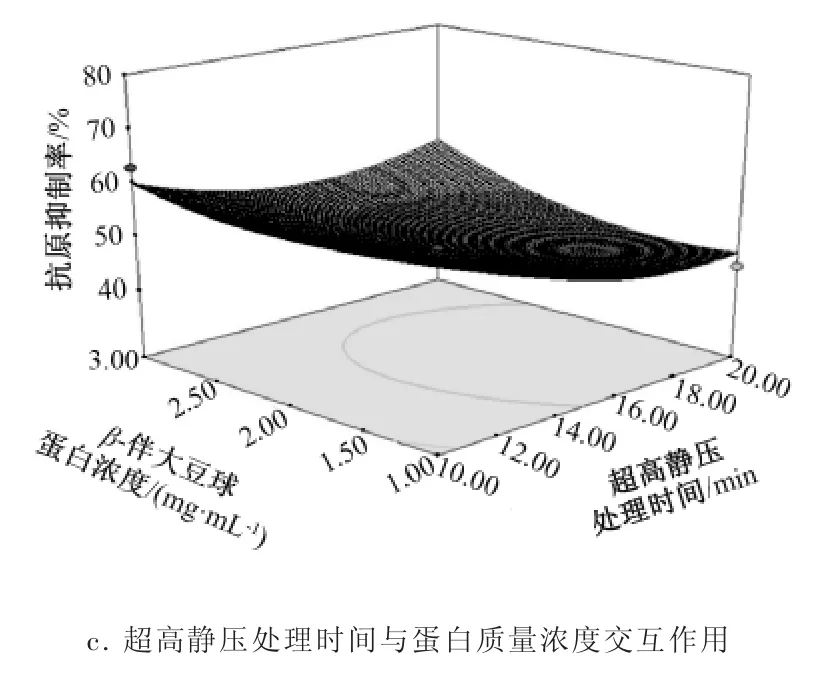
图4 各因素交互作用对β-伴大豆球蛋白抗原抑制率的影响Fig.4 The interactive effect of different factors on antigenicity of β-conglycinin
2.2.3 最优工艺条件的确定
分析得到最小响应值(R)时各因素对应实际值分别为超高静压处理压强454.95 MPa、时间18.05 min、蛋白质量浓度15.5 mg/mL,此条件下抑制率为49.59%。为方便实际操作,以超高静压处理压强455 MPa、超高静压处理时间18 min、β-伴大豆球蛋白质量浓度15 mg/mL对β-伴大豆球蛋白的抗原抑制率进行验证试验。3次平行试验得到的实际抗原抑制率为51.19%,与理论值相差不大,且测定结果稳定,说明利用响应面法优化β-伴大豆球蛋白超高静压处理条件参数真实可靠,具有实际意义。
3 结论
本文在单因素试验的基础上,以响应面法优化β-伴大豆球蛋白超高静压处理条件。结果表明:超高静压处理压强、超高静压处理时间、压强的平方项、时间的平方项和质量浓度的平方项对β-伴大豆球蛋白抗原抑制率的影响显著。说明超高静压处理压强、处理时间和蛋白质量浓度对抗原抑制率的影响不是简单的线性关系。
根据响应面中心组合设计理论对β-伴大豆球蛋白超高静压处理条件进行优化的试验结果得出:超高静压处理时间对β-伴大豆球蛋白的抗原抑制率的影响最大,压强次之,蛋白质量浓度最小。
优化结果得到β-伴大豆球蛋白超高静压处理的最佳条件为:超高静压处理压强455 MPa、处理时间18 min、β-伴大豆球蛋白质量浓度15 mg/mL,抗原抑制率实际为51.19%,相对误差为3.23%。试验值与理论值相差不大,说明该模型合理可靠。
[1]HANCOCK J D,CAO H,KIM I H,et al. Effects of processing technologies and genetic modifications on nutritional value of full-fat soybeans in pigs[J].Asian-Australasian Journal of Animal Sciences,2000,13(4):356-375.
[2]HE L,HAN M,QIAO S,et al.Soybean antigen proteins and their intestinal sensitization activities[J].CurrentProtein and Peptide Science,2015,16(7):613-621.
[3]冯彦娟,袁娟丽,佟平,等.大豆过敏原的检测方法研究进展[J].食品科学,2012,33(23):365-369.
[4]MA X,HE P,SUN P,et al.Lipoic acid:an immunomodulator that attenuates glycinin induced anaphylactic reactions in a rat model[J]. Journal of Agricultural and Food Chemistry,2010,58(8):5086-5092.
[5]朱翠,蒋宗勇,郑春田,等.大豆抗原蛋白的组成及其致敏作用机理[J].动物营养学报,2011,23(12):2053-2063.
[6]MEINLSCHMIDTP,SCHWEIGGERT-WEISZ U,BRODE V,et al.Enzyme assisted degradation of potential soy protein allergens with special emphasis on the technofunctionality and the avoidance of a bitter taste formation[J]. LWT-Food Science and Technology,2016,68:707-716.
[7]LIU B,TENG D,YANG Y,et al.Development of a competitive ELISA for the detection of soybean α subunit of β-conglycinin[J].Process Biochemistry,2012,47(2):280-287.
[8]WANG X S,TANG C H,LI B S,et al.Effects of high pressure treatment on some physicochemical and functional properties of soy protein isolates[J].Food Hydrocolloids,2008,22(4):560-567.
[9]LI H J,ZHU K X,ZHOU H M,et al.Effects of high hydrostatic pressure treatment on allergenicity and structural properties of soybean protein isolate for infantformula[J].Food Chemistry,2012,132(2):808-814.
[10]LI H J,ZHU K X,ZHOU H M,et al.Effects of high hydrostatic pressure on some functional and nutritional properties of soy protein isolate for infant formula[J].Journal of Agricultural and Food Chemistry,2011,59(22):12028-12036.
[11]PENAS E,GOMEZ R,FRIAS J,et al.High hydrostatic pressure effects on immunoreactivity and nutritional quality of soybean products[J]. Food Chemistry,2011,125(2):423-29.
[12]贺梦雪,席俊,闫慧丽,等.β-伴大豆球蛋白的分离纯化及免疫活性鉴定[J].河南工业大学学报(自然科学版),2016,37(6):24-27.
[13]ZHANG M,ZHENG J,GE K,et al.Glycation of α-lactalbumin with different size saccharides: Effect on protein structure and antigenicity[J]. International Dairy Journal,2014,34(2):220-228.
[14]张楠,布冠好,朱婷伟,等.糖基化反应对大豆蛋白-乳糖复合物抗原性及结构的影响[J].现代食品科技,2015,31(8):117-121.
[15]吴有炜.试验设计与数据处理[M].苏州:苏州大学出版社,2002:115-154.
[16]MESSENS W,CAMP J V,HUYGHEBAERT A.The use of high pressure to modify the functionality of food proteins[J].Trends in Food Science and Technology,1997,8(4):107-112.
[17]ZHANG H K,LI L T,MITTAL G S.Effects of high pressure processing on soybean beta-conglycinin[J].Journal of Food Process Engineering,2010,33(3):568-583.
[18]MOLINA E,PAPADOPOULOU A,LEDWARD D A.Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J].Food Hydrocolloids,2001,15(3):263-269.
[19]OMI Y,KATO T,ISHIDA K I,et al.Pressureinduced release ofbasic 7S globulin from cotyledon dermal tissue of soybean seeds[J]. Journal of Agricultural and Food Chemistry,1996,44(12):3763-3767.
OPTIMIZATION OF HIGH HYDROSTATIC PRESSURE PARAMETERS FOR REDUCING ANTIGENICITY OF β-CONGLYCININ BY RESPONSE SURFACE METHODOLOGY
HE Mengxue,XI Jun,PI Jiangyi
(School of Food Science and Technology,Henan University of Technology,Zhengzhou 450001,China)
β-conglycinin is the major component of the globulin,and is an important soybean antigen protein. The present study was to investigate the optimal high hydrostatic pressure treatment parameters for reducing Antigenicity of β-conglycinin by response surface methodology.Based on the single-factor experiments,the effects of HHP treatment pressure,HHP treatment time and β-conglycinin concentration on the antigenicity of β-conglycinin were studied.The results showed that the optimal high hydrostatic pressure parameters process conditions were as follows:HHP treatment pressure of 455 MPa,HHP treatment time of 18 min and β-conglycinin concentration of 15 mg/mL.Under these conditions,the predicted and observed antigenicity inhibition rates of β-conglycinin were 49.59%and 51.19%,respectively.The standard deviation was 1.07%,which implied that the optimal conditions of HHP treatment obtained by response surface methodology was reliable.
β-conglycinin;high hydrostatic pressure(HHP);antigenicity of β-conglycinin;response surface methodology
TS201.2
B
1673-2383(2017)02-0069-06
http://kns.cnki.net/kcms/detail/41.1378.N.20170420.1409.024.html
2016-08-30
国家自然科学基金项目 (31671778);河南省高等学校重点科研项目(16A550001)
贺梦雪(1992—),女,河南沁阳人,硕士研究生,研究方向为食品安全与品质控制。
*通信作者

