红曲色素生物活性研究进展
苏东晓,张瑞芬,张名位1,*,李 利,陈 莎
(1.长江大学 生命科学学院食品科学与工程系,湖北 荆州 434025;2.广东省农业科学院蚕业与农产品加工研究所,广东 广州 510610;3.长江大学 荆楚特色食品研发中心,湖北 荆州 434020)
红曲色素生物活性研究进展
苏东晓1,3,张瑞芬2,张名位1,2*,李 利1,3,陈 莎1,3
(1.长江大学 生命科学学院食品科学与工程系,湖北 荆州 434025;2.广东省农业科学院蚕业与农产品加工研究所,广东 广州 510610;3.长江大学 荆楚特色食品研发中心,湖北 荆州 434020)
红曲色素是红曲霉菌生长过程中产生的次级代谢产物,是由红、橙和黄等多种色素组成的混合物。红曲色素属于天然食用色素,作为添加剂在食品工业中使用广泛。随着市场需求细化,人们对红曲色素生物活性和安全性的认识逐步加深,红曲色素面临新的挑战和发展机遇。综述了红曲红、橙和黄色素的组成结构及其对光、热和pH的稳定性,着重介绍了不同颜色色素降血脂和抗癌等生物活性,并探讨了红曲色素研究的发展方向。
红曲;红曲色素;降血脂;抗癌;生物活性
网络出版时间:2017-4-20 14:10:10
1 红曲简介
红曲霉菌,属于真菌界,子囊菌门,子囊菌纲,散囊菌目,红曲科,由法国科学家 Van Tieghem于1884年分类并命名[1]。红曲发酵产品——红曲米在中国始于唐朝,用于民间医药、食品着色剂、发酵剂、红米酒和腐乳已超千年[2-5]。目前有58个红曲霉菌株保存在美国典型培养物保藏中心(ATCC),然而根据Hawksworth和Pit建立的分类方法,大多数红曲菌株属于3种,即红色红曲霉(M.ruber)、烟色红曲霉(M.pilosus)和紫色红曲霉(M.purpureus)[2,6]。红曲霉代谢产生的次级代谢产物是一类化学成分复杂的混合物,已分离鉴定的有莫纳可林(monacolins,其中monacolin K又名洛伐他汀)、红曲色素、二氢莫纳可林(dihydromonacolins)、麦角固醇(ergosterol)、桔霉素(citrinin)、酶类和γ-氨基丁酸(γ-aminobutyric acid,GABA)等[4,6-8]。
2 红曲色素
2.1 红曲色素组成
天然色素较合成色素安全性高,国际市场需求巨大,微生物发酵生产天然色素具有价格优势[9-10]。红曲色素一直是天然食品色素中国内外学者研究的热点。红曲色素是多种色素的混合物,经光谱和波谱解析鉴定,其是化学结构不同的一系列聚酮类化合物,由红、橙、黄3类色素组成[11-12],仅红色素就被鉴定出有十多种[13]。应用价值主要集中在6种醇溶性的色素(见表1和图1):红色的红斑红曲胺(Rubropunctamine)和红曲玉红胺(Monascrubramine),橙色的红斑红曲素 (Rubropunctatin)和红曲玉红素(Monascorubrin),黄色的安卡红曲黄素(Ankaflabin)和红曲素(Monascin)[13-16]。新的色素不断被鉴定,印度学者Mukherjee等[17]从液态深层发酵紫色红曲霉(M.purpureus)中分离鉴定出新的红色色素,分子式C21H29NO5,相对分子质量375,其结构与红斑红曲素和红曲玉红素相近,但其C-3和C-9位被羟烷基取代。另有2种新的黄色素Xanthomonascin A和YellowⅡ已被探明[18]。红曲色素中的黄色成分约占5%,其性质比较稳定,但因其含量低,所以红曲色素仍呈现红色[19]。
2.2 红曲色素组成影响因素
红曲色素及其制品具有降血脂、降血压、抗突变、防腐保鲜、抗肿瘤、抗人免疫缺陷病毒、抗氧化、抗炎及其他特征活性等生理活性[3,20],其作用机理主要是通过抑制不同酶的活性[8]。红曲色素的生物活性与其所含色素组分有关,红曲色素产量和种类受菌株、培养基组成、发酵时间、pH值、搅拌和光照等条件影响[17,21-24]。不同谷物基质培养基固态发酵紫色红曲霉(M.purpureus)主要色素产物不同,脱皮高粱培养基主要色素产物是红斑红曲胺(Rubropunctamine),而高粱米糠培养基的主要产物是黄色2号(YellowⅡ)[21]。巴西学者采用甘油作为培养基通过液态深层发酵红色红曲霉(M.ruber)生产红色红曲色素[25]。深层液态发酵采用三级不同曝气量工艺较恒定曝气量能够显著提高红曲色素产量29.6%,并降低桔霉素浓度79.5%[26]。微胶囊化处理液态深层发酵体系,模拟固态发酵环境,可以提高色素产量2倍以上[27]。Kang等[28]通过调节培养基初始pH值,配合硫酸铵或谷氨酸钠作为氮源控制发酵终点pH值,建立了低pH值液体深层发酵生产不含桔霉素的橙色Monascus色素工艺。
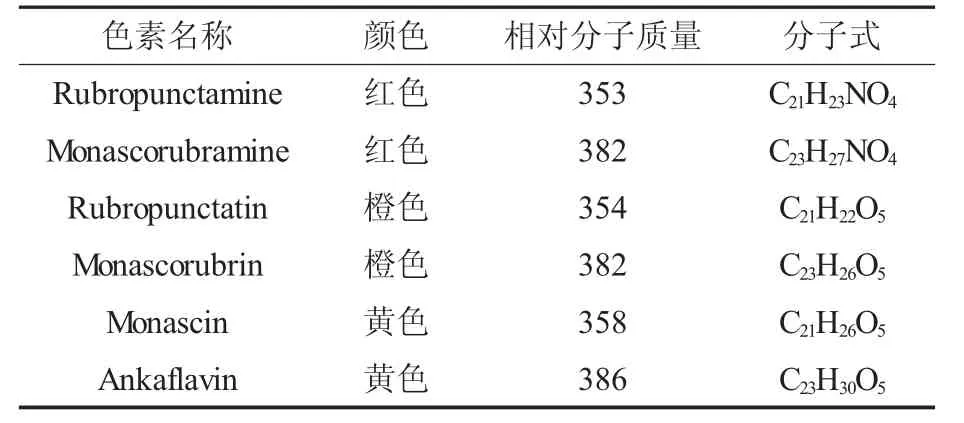
表1 红曲色素的种类及分子式Table 1 Species and molecular formula of Monascus pigment

图1 红、橙、黄三类色素的结构式Fig.1 Structural formula of red,orange and yellow pigments of Monascus
2.3 红曲色素稳定性
研究发现pH值、光照等会影响色素稳定性[12]。较高pH值会加速橙色素降解,低pH有利于色素稳定,当pH为4.8,加热温度为75℃,加热时间为58.5 h时色素仍可保留一半,而提高pH至5.5,加热温度降低到53.8℃,色素半数保留时间为55.9 h。红色素受pH的影响与橙色素相反,提高pH可以抑制色素降解。75℃时,pH值由6.91降低到4.08,色素降解反应速率常数由0.048 h-1提高到0.435 h-1,降解速率提高 9倍[12]。连喜军[29]采用紫外光照射红曲红、橙、黄三类色素的甲醇溶液,发现黄色素光稳定性最强,其次为红色素,橙色素对光最不稳定。赵倩[30]发现连续光照可显著降低红曲色素的保存率,而避光贮藏则可有效保护红曲色素。王昌禄等[31]报道可以通过在红曲色素中添加槲皮素、芝麻酚林衍生物、酚酸和黄酮类化合物等物质,令红曲红色素结构中酮基与上述化合物的羟基在水溶液中形成化学键稳定其构象,改变光照条件下因能量跃迁发生结构变化,进而稳定红曲色素的颜色。红曲色素热降解特性研究发现经121℃加热40 min处理红曲色素后,黄色素保存率较高为71.3%,而红色素仅剩45.2%[30]。
近年来,随着国内外学者对红曲色素研究的深入,已有相当多的文献报道红曲的功能,本文主要对红曲色素的生物活性研究成果进行综述。
3 红曲色素生物活性
3.1 降血脂作用
红曲最重要的功能活性之一是降低血脂和胆固醇含量。研究显示,降低胆固醇最重要的活性物质为monacolin K及其类似物[32],作为HMG-CoA还原酶竞争性抑制剂,抑制胆固醇的合成,从而降低胆固醇水平[33]。也有研究报道,红曲色素具有降血脂功效。Kumari等[34]以M.purpureus MTCC 410红曲霉菌发酵的红曲米喂食白化大鼠,研究红曲米急性和亚慢性毒性,未观察到任何毒性作用或死亡,且大鼠摄食量、体质量、器官质量、血液学指标等均无明显改变,血清临床酶水平也无显著差异。此外,喂食红曲米的试验组大鼠的重要器官和血清的胆固醇和三酰甘油酯含量降低。经硅胶层析柱分离纯化获得的红曲色素单体7个组分,其中色价最高的组分对脂肪酶活力具有显著抑制作用,可使酶活下降86.78%[35]。
红曲黄色素降血脂:红曲嗜氮酮结构的黄色色素Monascin和Ankaflavin具有降血脂和提高高密度脂蛋白胆固醇的活性。Lee等[36]研究发现,Monascin和ankaflavin能够显著降低血清 TC、TG和LDL-C水平,肝脏组织和粪便中胆固醇含量也显著降低,上述两种色素可能是通过抑制胆固醇的合成发挥降低胆固醇含量的活性。此外,Monascin和Ankaflavin还能显著提高高密度脂蛋白胆固醇含量,此结果阐明红曲代谢产物提高高密度脂蛋白胆固醇含量的特定功能物质基础是Monascin和Ankaflavin,而非Monacolin K[36]。
红曲红色素降血脂:红曲橙色色素经47种不同的胺基衍生转变为红色色素。其中16种红曲色素胺衍生物抑制3T3-L1脂肪细胞分化,而8种促进脂肪细胞生长。抑制脂肪细胞分化活性高的胺基衍生色素可以改变脂滴形态。给予高脂饲料喂养的C57BL/6小鼠活性高的胺基衍生色素,可降低小鼠体质量、总胆固醇和低密度脂蛋白胆固醇含量。同时发现小鼠附睾脂肪组织和肝脏组织中脂肪含量减小[37]。红曲橙色素Monascus的L或 D型氨基酸衍生物能够显著抑制猪胰脂肪酶活性[38]。体外试验研究发现红曲橙色素苏氨酸衍生物具有抑制HMG-CoA还原酶活性,与橙色Monascus色素抑制活性相当,达36%以上[39]。红曲橙色色素Monascus的L-色氨酸衍生物能够显著减少肥胖小鼠体质量、脂肪质量以及皮下脂肪和肝脏脂肪的含量[40]。动物试验研究发现给予雌性C57BL/6小鼠红曲橙色素及其苏氨酸衍生物,小鼠血清总胆固醇和低密度脂蛋白胆固醇含量分别降低8%~16%和18%~26%,而高密度脂蛋白胆固醇含量升高1%~9%,动脉粥样硬化指数下降23%~27%。红曲橙色素及其苏氨酸衍生物抗动脉粥样硬化作用主要是通过降低血清而非肝脏脂质含量[39]。
3.2 抗炎、抗癌作用
红曲色素具有抗炎和抑癌活性。Hsu等[41]从Monascus purpureus NTU 568红曲霉菌代谢产物中分离出6种聚酮类衍生物,这6种化合物均对一氧化氮诱导的小鼠脂多糖型炎症具有抑制作用,而其中4种化合物对人咽喉癌细胞(HEp-2)和人结肠前列腺癌细胞(WiDr)具有较强抑制作用。
橙色素抗癌活性:研究发现红曲橙色素红斑红曲素(Rubropunctatin)、红曲玉红素(Monascorubrin)[42]对人胃癌细胞 (SH-SY5Y、BGC-823、AGS和MKN45)具有显著抑制效果,其中红斑红曲素的抑制效果较紫杉醇好,而且其对人胃正常上皮细胞GES-1毒性较紫杉醇小。分析发现Rubropunctatin三环结构中的6-内醚、4-羰基和共轭双键是其抗癌活性的关键[42]。郑允权等[43]从红曲霉发酵产品中分离纯化获得一种橙色素,通过液质和核磁共振鉴定为Monascorubrin。体外细胞试验研究表明,该色素能有效抑制人胃癌细胞 AGS,5 μmol·L-1Monascorubrin处理AGS 24 h,93.70%的细胞进入凋亡前期,细胞凋亡程度与给药浓度呈正相关。而且该色素对AGS细胞生长抑制效果显著优于紫杉醇,且对人正常胃上皮细胞的毒性作用较紫杉醇小。红曲橙色色素具有较好抑制SP2/0、Hep G2和Hela细胞增殖的功能,在一定浓度范围内随着时间的延长和色素浓度的增加,抑制效果增强[44]。
黄色素抗癌活性:黄色素Ankaflavin对人肝癌细胞Hep G2和肺癌细胞A549具有抑制作用,而对正常细胞MRC-5和WI-38没有毒性[45]。然而其类似物Monascin对上述癌细胞没有抑制作用[45]。然而,Akihisa等[46]报道,灌胃给予小鼠Monascin,能够显著抑制过氧化亚硝酸盐或紫外线B诱导的小鼠皮肤癌。近年来研究报道,黄色色素4种新的嗜氮酮的衍生物,Monascuspiloin、Monapurpyridine A、Monaphilones A和B具有抗癌活性。细胞试验研究发现,Monascuspiloin能够显著抑制雄激素依赖性LNCaP和雄激素非依赖性PC-3人前列腺癌细胞。Monascuspiloin通过衰减PI3K/Akt/mTOR通路诱导LNCaP细胞凋亡;通过AMPK途径诱导PC-3细胞G2/M期阻滞和细胞自噬性死亡[47]。Monapurpyridine A诱导人乳腺癌细胞MCF-7凋亡,且对正常乳腺上皮细胞的M10无显著毒副作用[48]。Monaphilones A和B具有抑制人喉癌细胞株HEp-2细胞和人结肠腺癌细胞系WiDr增殖活性,并对正常人肺细胞WI-38和MRC-5无毒副作用[49]。
红曲色素以红色素为主,安全无毒,且具有多种生物活性。然而有研究报道对小鼠T细胞具有免疫活性的Rubropunctatin和Monascorubrin,对鸡胚胎具有毒性和致畸作用[8]。此外,有报道称Rubropunctamine、Monascorubramine、Monascopyridines A和B纯品对永生化人肾细胞具有细胞毒性作用[50]。尽管红曲黄色素与橙色素结构相似,然而,红曲黄色素的致畸作用较橙色素小[19]。因此,关于红曲色素不同组分生物活性及其安全剂量,有待进一步深入研究。
3.3 抑菌活性
红曲中具有抑菌活性的物质有Monascidin A、Ankalactone、糖肽类物质和红曲色素及其衍生物等[51]。不同颜色红曲色素抑菌活性差异较大。Mukherjee等[17]从紫色红曲霉(M.purpureus)液态深层发酵液中分离鉴定出新的红色色素,发现其能够抑制芽孢杆菌(Bacillus),但对大肠杆菌(E.coli)和沙门氏菌(Salmonella spp.)无显著效果,表明红曲红色素具有抑制革兰氏阳性菌活性。Patakova等[8]报道M.purpureus发酵产红曲色素具有抑制细菌以及一些酵母和丝状真菌活性,此活性与其所含嗜氮酮类橙色色素Rubropunctatin和Monascorubrin有关。Kim等[52]研究了红曲色素不同氨基酸衍生物的抑菌效果,以电泳淌度为指标,考察抑菌活性与细菌细胞表面色素衍生物吸附量之间的关系,结果表明,随着色素衍生物吸附量的增加,电泳淌度成比例地增大,其抑菌活性增强。而且疏水性的苯丙氨酸和酪氨酸衍生物的抑菌效果优于亲水性的谷氨酸和谷氨酰胺衍生物的抑菌效果。含有苯环的氨基酸衍生物具有较高抗菌活性。橙色色素各组分对金黄色葡萄球菌和李斯特菌等革兰氏阳性菌具有抑制效果,增加抑制作用增强;对大肠杆菌、志贺菌和沙门菌等革兰氏阴性菌也有一定的抑制作用[44]。红色色素组分对革兰氏阳性菌也有一定的抑制作用,但是对革兰氏阴性菌的抑制效果不好。
3.4 抗氧化活性
红曲色素为一类聚酮类化合物,化合物结构相近,已知的6种主要色素,其分子结构均无酚羟基,抗氧化活性较弱。Yang等[53]比较了红曲发酵精米和脱壳稻米的甲醇提取物抗氧化性,发现在抑制过氧化、亚铁离子螯合能力和DPPH自由基清除能力及多酚含量等指标方面,红曲米均高于普通脱壳稻米,表现出较好的抗氧化性能。进一步分析发现其抗氧化活性与总酚含量有密切关系。Wada等[54]比较了葡萄籽提取物、红萝卜色素、红曲红色素、栀子黄和栀子蓝等天然色素清除活性氧的效果,结果表明,上述天然色素均具有一定的抗氧化作用,其中葡萄籽提取物和红萝卜色素的清除活性氧的效果最好,红曲红色素清除能力较弱。然而,屈炯[44]报道红曲红色色素组分和橙色色素组分都有很强的·OH、O2·-和DPPH自由基清除能力。
4 红曲发酵副产物桔霉素
1995年法国学者Blanc等[55]报道红曲霉在代谢产生红曲色素的同时,会伴随产生一种具有肾毒性和致畸性的真菌毒素——桔霉素。由于桔霉素的存在,红曲色素制品的食用安全性受到质疑,导致红曲色素生产销售受到严重冲击,大大限制了其在食品工业中的推广使用。如何控制及去除桔霉素一直是红曲色素研究领域的热点[56]。
Blanc等[55]同时指出,并非所有红曲霉菌种都会产生桔霉素,而且即使某一产桔霉素的菌种,改变生产方法,桔霉素的含量也会发生变化,有时甚至检不出桔霉素。桔霉素的生物合成是受到多种酶的调控,编码酶的基因决定其处于激活表达或沉默抑制状态,因此可以通过突变或基因工程等方法选育不产桔霉素的菌株[57-58]。也可以通过种内的原生质体融合以及基因手段增加特定色素产量[4,59]。此外,微生物次级代谢产物还受碳氮源和 pH等过程参数的影响,从而改变次级代谢产物的生物合成[56,60]。因此,可以通过调整优化发酵工艺参数控制桔霉素含量。
5 展望
目前对红曲色素的生产工艺和生物活性的研究已取得较大进展,但其相关产品的色素组成及安全剂量仍需进一步深入研究。因此,揭示红曲色素生物合成途径,从基因组学和代谢组学等分子水平上对红曲霉产红曲色素和桔霉素等代谢产物进行调控;建立新的检测分析方法,进一步分离鉴定红曲色素的化学成分;通过动物试验,评价其安全性,发掘其生物功效及其作用机制;生产开发成分明确、稳定性好、性能优异且不含桔霉素的色素产品,将是未来红曲色素的研究方向。
[1]FENG Y L,SHAO Y C,CHEN F S.Monascus pigments [J].Applied Microbiology and Biotechnology,2012,96(6):1421-1440.
[2]SHAO Y,LEI M,MAO Z,et al.Insights into Monascus biology at the genetic level[J]. Applied Microbiology&Biotechnology,2014,98(9):3911-3922.
[3]YASUDA M,TACHIBANA S,KUBA-MIYARA M.Biochemical aspects of red koji and tofuyo prepared using Monascus fungi[J].Applied Microbiology and Biotechnology,2012,96(1): 49-60.
[4]CHEN W,HE Y,ZHOU Y,et al.Edible filamentousfungifrom thespeciesMonascus: Early traditional fermentations,modern molecular biology,and future genomics[J].Comprehensive Reviews in Food Science&Food Safety,2015,14(5):555-567.
[5]YANG C W,MOUSA S A.The effect of red yeast rice (Monascus purpureus)in dyslipidemia and other disorders[J].Complementary Therapies in Medicine,2012,20(6):466-474.
[6]LIN Y L,WANG T H,LEE M H,et al.Biologically active components and nutraceuticals in the Monascus-fermented rice:a review[J]. Appl Microbiol Biotechnol,2008,77(5):965-973.
[7]陈春艳.功能红曲与红曲色素的研究进展[J].湖南科技学院学报,2007,28(9):40-42.
[8]PATAKOVA P.Monascus secondary metabolites: production and biological activity[J].Journal of Industrial Microbiology&Biotechnology,2013,40(2):169-181.
[9]DUFOSS魪L,FOUILLAUD M,CARO Y,et al.Filamentous fungi are large-scale producers of pigments and colorants for the food industry[J].Current Opinion in Biotechnology,2014,26(26):56-61.
[10]NIGAM P S,LUKE J S.Food觃dditives:Production of microbial pigments and their antioxidant properties[J].Current Opinion in Food Science,2016,7:93-100.
[11]YANG T,LIU J W,LUO F J,et al.Anticancer properties of Monascus metabolites[J].Anti-Cancer Drugs,2014,25(7):735-744.
[12]SINGH N,GOEL G,SINGH N,et al.Modeling the red pigment production by Monascus purpureus MTCC 369 by artificial neural network using rice water based medium[J]. Food Bioscience,2015,11:17-22.
[13]LIAN X,WANG C,GUO K.Identification of new red pigments produced by Monascus ruber[J].Dyes&Pigments,2007,73(1):121-125.
[14]PATTANAGUL P,PINTHONG R,PHIANMON GKHOL A,et al.Mevinolin,citrinin and pigments of adlay angkak fermented by Monascus sp.[J].International Journal of Food Microbiology,2008,126(1-2):20-23.
[15]BABITHA S,SOCCOL C R,PANDEY A.Solid-state fermentation forthe production of Monascuspigmentsfrom jackfruitseed[J]. Bioresource Technology,2007,98(8):1554-60.
[16]PANESAR R,KAUR S,PANESAR P S.Production of microbial pigments utilizing agroindustrial waste:a review[J].Current Opinion in Food Science,2015(1):70-76.
[17]MUKHERJEE G,SINGH S K.Purification and characterization of a new red pigment from Monascus purpureus in submerged fermentation[J].Process Biochemistry,2011,46(1):188-192.
[18]SANTIS D D,MORESI M,GALLO A M,et al.Assessmentofthe dyeing propertiesof pigments from Monascus purpureus[J].Journal ofChemicalTechnology & Biotechnology,2005,80(9):1072-1079.
[19]ZHONG S,ZHANG X,WANG Z.Preparation and characterization of yellow Monascus pigments[J].Separation&Purification Technology,2015,150(9):139-144.
[20]LEE B H,PAN T M.Benefit of Monascusfermented products for hypertension prevention: a review[J].Applied Microbiology and Biotechnology,2012,94(5):1151-1161.
[21]SRIANTA I,ZUBAIDAH E,ESTIASIH T,et al.Comparison of Monascus purpureus growth,pigment production and composition on differentcerealsubstrates with solid state fermentation[J].Biocatalysis& Agricultural Biotechnology,2016,7:181-186.
[22]VELMURUGAN P,YONG H L,VENIL C K,et al.Effect of light on growth,intracellular and extracellular pigment production by five pigment-producing filamentous fungi in synthetic medium[J].Journal of Bioscience&Bioengineering,2010,109(109):346-350.
[23]DANURI H.Optimizing Angkak pigments and lovastatin production by Monascus purpureus[J].Hayati Journal of Biosciences,2008,15(1):65-70.
[24]王昌禄,张晓伟,陈勉华,等.红光对红曲霉生长及次级代谢产物的影响[J].天然产物研究与开发,2009,21(01):91-95.
[25]MEINICKE R M,VENDRUSCOLO F,MORITZ D E,etal.Potentialuse ofglycerolas substrate for the production of red pigments by Monascus ruber in submerged fermentation[J]. Biocatalysis & Agricultural Biotechnology,2012,1(3):238-242.
[26]YANG J,CHEN Q,WANG W,et al.Effect of oxygen supply on Monascus pigments and citrinin production in submerged fermentation[J].Journal of Bioscience&Bioengineering,2015,119(5):564-569.
[27]LIU J.Repeated-batch cultivation of encapsulated Monascuspurpureusbypolyelectrolytecomplex for natural pigment production[J].中国化学工程学报(英文版),2010,18(6): 1013-1017.
[28]KANG B,ZHANG X,WU Z,et al.Production of citrinin-free Monascus pigments by submerged culture at low pH[J].Enzyme&Microbial Technology,2014,55(91):50-57.
[29]连喜军.红曲色素光稳定性的研究[D].天津:天津科技大学,2005.
[30]赵倩.红曲色素热稳定性的研究[D].武汉:华中农业大学,2009.
[31]王昌禄,王莹,陈勉华,等.红曲色素不同成分的光稳定性研究[J].食品研究与开发,2008,29(10):189-192.
[32]LEE C L,PAN T M.Development of Monascus fermentation technology for high hypolipidemic effect[J].Applied Microbiology&Biotechnology,2012,94(6):1449-1459.
[33]雷萍,金宗濂.红曲中生物活性物质研究进展[J].食品工业科技,2003,24(09):86-89.
[34]KUMARI H P M,NAIDU K A,VISHWANATHA S,et al.Safety evaluation of Monascus purpureus red mould rice in albino rats[J].Food& Chemical Toxicology,2009,47(8):1739-1746.
[35]董夏莲.红曲色素对脂肪酶活力的影响[D].大连:大连工业大学,2012.
[36]LEE C L,KUNG Y H,WU C L,et al.Monascin and ankaflavin act as novel hypolipidemic and high-density lipoprotein cholesterol-raising agents in red mold dioscorea[J].Journal of A-gricultural&Food Chemistry,2010,58(16): 9013-9019.
[37]CHOE D,LEE J,WOO S,et al.Evaluation of the amine derivatives of Monascus pigment with anti-obesity activities[J]. Food Chemistry,2012,134(1):315-323.
[38]KIM J H,KIM H J,KIM C,et al.Development of lipase inhibitors from various derivatives of monascus pigment produced by Monascus fermentation[J].Food Chemistry,2007,101(1):357-364.
[39]JEUN J,JUNG H,KIM J H,et al.Effect of the Monascus pigment threonine derivative on regulation of the cholesterol level in mice[J]. Food Chemistry,2008,107(3):1078-1085.
[40]NAM K,CHOE D,SHIN C S.Antiobesity effectofa jelly food containing the L-tryptophan derivative of Monascus pigment in mice[J].Journal of Functional Foods,2014,9(7):306-314.
[41]HSU Y W,LICHUAN H,CHANG C L,et al. New anti-Inflammatory and anti-proliferative constituents from fermented red mold rice Monascus purpureus NTU 568[J].Molecules,2010,15(11):7815-7824.
[42]ZHENG Y,XIN Y,SHI X,et al.Cytotoxicity of Monascus pigments and their derivatives to human cancer cells[J].Journal of Agricultural &Food Chemistry,2010,58(17):9523-9528.
[43]郑允权,信亚文,石贤爱,等.红曲橙色素对人胃腺癌细胞AGS诱导凋亡的作用[J].福州大学学报(自然科学版),2010(6): 922-926.
[44]屈炯.红曲色素组分分离及其功能的初步研究[D].武汉:华中农业大学,2008.
[45]SU N W,LIN Y L,MINHSIUNG L A,et al. Ankaflavin from Monascus-fermented red rice exhibits selective cytotoxic effect and induces cell death on hep G2 cells[J].Journal of Agricultural&Food Chemistry,2005,53(6): 1949-54.
[46]AKIHISA T,TOKUDA H,UKIYA M,et al. Anti-tumor-initiating effects of Monascin,an azaphilonoid pigment from the extract of Monascus pilosus fermented rice(red-mold rice)[J].Chemistry&Biodiversity,2005,2(10):1305-1309.
[47]CHEN R J,HUNG C M,CHEN Y L,et al. Monascuspiloin induces apoptosis and autophagic cell death in human prostate cancer cells via the Akt and AMPK signaling pathways[J].JournalofAgricultural& Food Chemistry,2012,60(29):7185-7193.
[48]HSU L C,HSU Y W,LIANG Y H,et al. Induction of apoptosis in human breast adenocarcinoma cells MCF-7 by monapurpyridine A,a new azaphilone derivative from Monascus purpureus NTU 568[J].Molecules,2012,17(1):664-673.
[49]HSO Y W,HSU L C,LIANG Y H,et al. Monaphilones A-C,three new antiproliferative azaphilone derivatives from Monascus purpureus NTU 568[J].Journal of Agricultural&Food Chemistry,2010,58(14):8211-8216.
[50]KNECHT A,HUMPF H U.Cytotoxic and antimitotic effects of N-containing Monascus meta bolites studied using immortalized human kidney epithelial cells[J].Molecular Nutrition& Food Research,2006,50(4-5):406-412.
[51]邹宇,侯红漫.红曲霉抑菌活性物质与桔霉素的研究进展[J].食品研究与开发,2005,26(01):20-22.
[52]KIM C,JUNG H,KIM J H,et al.Effect of Monascuspigmentderivativeson the electrophoretic mobility of bacteria,and the cell adsorption and antibacterial activities of pigments[J].Colloids& Surfaces B Biointerfaces,2006,47(2):153-159.
[53]YANG J H,TSENG Y H,LEE Y L,et al. Antioxidant properties of methanolic extracts from monascal rice[J].LWT-Food Science and Technology,2006,39(7):740-747.
[54]WADA M,KIDO H,OHYAMA K,et al.Chemiluminescent screening of quenching effects of natural colorants against reactive oxygen species:Evaluation of grape seed,monascus,gardenia and red radish extracts as multi-functionalfood additives[J].Food Chemistry,2007,101(3):980-986.
[55]BLANC P J,LAUSSAC J P,BARS J L,et al. Characterization of monascidin A from Monascus as citrinin[J].International Journal of Food Microbiology,1995,27(2-3):201-213.
[56]岳建明,杨强,肖潇,等.铵盐对紫色红曲霉合成代谢红曲色素及桔霉素的影响[J].食品科学,2016,37(05):102-107.
[57]XU M J,YANG Z L,LIANG Z Z,et al.Construction ofa Monascus purpureus mutant showing lower citrinin and higher pigment production byreplacementofctnA with pks1 without using vector and resistance gene[J]. JournalofAgricultural& Food Chemistry,2009,57(20):9764-8.
[58]XIE N,LIU Q,CHEN F.Deletion of pigR gene in Monascus ruber leads to loss of pigment production[J].Biotechnology Letters,2013,35(9):1425-1432.
[59]KLINSUPA W,PHANSIRI S,THONGPRADIS P,et al.Enhancement of yellow pigment production byintraspecificprotoplastfusion of Monascus spp.yellow mutant(ade-)and white mutant(prototroph)[J].Journal of Biotechnology,2015,217(1):62-71.
[60]熊旭.红曲色素转化及低桔霉素的发酵调控[D].广州:华南理工大学,2015.
BIOLOGICAL ACTIVITIES OF MONASCUS PIGMENTS:A REVIEW
SU Dongxiao1,3,ZHANG Ruifen2,ZHANG Ming-wei1,2,LI Li1,3,CHEN Sha1,3
(1.Department of Food Science and Engineering,College of Life Science,Yangtze University,Jingzhou 434025,China;2.Sericultural&Agri-Food Research Institute,Guangdong Academy of Agricultural Sciences,Guangzhou 510610,China;3.Research and Development Center of Special Food of Jingchu,Yangtze University,Jingzhou 434020,China)
Monascus pigments are secondary metabolites of monascus fungus breeding,and are a mixture consisting of red,orange and yellow pigments.Monascus pigments belong to the natural edible pigments,and are widely used in the food industry as food additives.With the continuous refinement of market demand and the gradually deepened understanding of the biological activities and safety of Monascus pigment,the pigment is confronted with new challenge and development opportunity.In this review,the components of red,orange and yellow Monascus pigment and their stability with light,temperature and pH value were introduced,and the hypolipidemic and anticancer activities of different color pigments were emphatically introduced.In addition,the research development of Monascus pigments was discussed.
Monascus;Monascus pigments;hypolipidemic;anticancer;biological activity
TS201.2
A
1673-2383(2017)02-0129-07
http://kns.cnki.net/kcms/detail/41.1378.N.20170420.1410.044.html
2016-10-07
国家自然科学青年基金项目(31501453);长江大学青年科研支持计划基金项目(2015CQN62);荆楚特色食品研发中心开放基金项目(2015JSF01)
苏东晓(1982—),男,陕西绥德人,博士,讲师,研究方向为功能食品研发。
*通信作者

