小麦赤霉病菌FgRab7调控Tri基因表达及DON毒素合成
王亚君,翟焕趁,张帅兵,刘新影,蔡静平
(河南工业大学 生物工程学院,河南 郑州 450001)
小麦赤霉病菌FgRab7调控Tri基因表达及DON毒素合成
王亚君,翟焕趁*,张帅兵,刘新影,蔡静平*
(河南工业大学 生物工程学院,河南 郑州 450001)
运用ELISA法测定了小麦赤霉病菌野生型和FgRab7敲除突变体菌株在不同基质中脱氧雪腐镰刀菌烯醇(DON)毒素的积累情况,结果显示,同一培养时期,FgRab7敲除突变体合成的DON毒素均显著低于野生型菌株(P<0.05),表明FgRab7影响DON毒素的生物合成。通过荧光定量PCR检测了不同培养阶段中DON生物合成相关Tri基因的表达,结果表明,Tri基因在野生型菌株中的相对表达量逐渐升高,在FgRab7敲除突变体中的相对表达量一直处于极低水平;相同的生长时期,Tri基因在FgRab7敲除突变体中的相对表达量明显低于野生型菌株。说明FgRab7通过调控DON合成途径相关Tri基因的表达而影响DON毒素的生物合成。
赤霉病菌;FgRab7;调控;Tri;脱氧雪腐镰刀菌烯醇
网络出版时间:2017-4-20 14:09:27
0 前言
脱氧雪腐镰刀菌烯醇 (Deoxynivalenol,DON)也称呕吐毒素,是一种 B型单端孢霉烯族 (Trichothecene)毒素,主要由小麦赤霉病菌(Fusarium graminearum)产生[1-3]。DON毒素可抑制真核生物细胞蛋白质的合成,破坏人和动物的免疫系统,在发生过赤霉病或其他镰刀菌病害的谷物如小麦、玉米、大麦及其制品中普遍存在[4],并且含有的DON毒素浓度大都超过国家限量标准,对食品安全构成了严重威胁[5-6],这一问题已引起世界各国政府和研究者的重点关注。目前,DON毒素的生物合成途径已逐步被研究清楚,一些与DON毒素生物合成相关的基因及其功能也被揭示[7-8],如单端孢霉烯族毒素合酶(Tri5)、P450单加氧酶(Tri4)、转录调控因子(Tri6)[9]、15-O-乙酰基转移酶(Tri3)[10]、酯酶(Tri8)、毒素输送泵(Tri12)等,还有一些基因的功能未知,如Tri1、Tri101等。DON毒素的生物合成不仅受到物理因素和化学因素的影响,还受到一些生物大分子如cAMP、TOR、FGK3等蛋白激酶的调控[11-13],一些小G蛋白也调控DON毒素的生物合成,如禾谷镰刀菌Rac1(FgRac1)负调控DON的合成,而FgRho4正调控DON的合成[14],FgRab7蛋白与FgRac1、FgRho4同属于Ras超家族蛋白中的小G蛋白,且FgRab7蛋白与小麦赤霉病菌的致病性有关[15],因此,FgRab7也可能调控DON毒素的合成。本研究选取小麦赤霉病菌野生型与FgRab7缺失突变体作为研究对象,测定它们在不同培养时期合成的DON量,分析DON毒素合成途径下各Tri基因在它们生长过程中的相对表达量,期望揭示小麦赤霉病菌FgRab7对DON毒素的调控机制,为从分子水平防治小麦赤霉病,控制DON毒素污染提供基础依据。
1 材料与方法
1.1 材料与试剂
小麦赤霉病菌野生型PH-1菌株由美国普渡大学徐金荣教授惠赠,FgRab7敲除突变体(△F-gRab7)和互补突变体(FgRab7-c)由福建农林大学功能基因组研究中心惠赠。DON毒素ELISA检测试剂盒购自江苏苏微微生物研究有限公司。氯仿/异戊醇(24∶1)、酚/氯仿(25∶24)购自北京索来宝科技有限公司。RNAiso Plus、SYBR Premix Ex TaqTM、PrimeScriptTM II 1st Strand cDNA Synthesis Kit购自大连宝生物工程公司。
1.2 试验仪器
KMF(E 2.5)BINDER恒温恒湿培养箱:德国BINDER公司;QYC-2102C摇床:上海福玛实验设备有限公司;ELx800吸收光酶标仪、Epoch型微孔板扫描分光光度计:美国伯腾仪器有限公司;analytikjena EasyCycler PCR仪:德国耶拿分析仪器股份公司;DYY-6C型电泳仪:北京六一仪器厂;TGL-20bR高速冷冻离心机:上海安亭科学仪器厂;Eppendorf Mastercycler nexus PCR仪:Eppendorf中国有限公司。
1.3 方法
1.3.1 小麦赤霉病菌FgRab7的系统发育分析
根据小麦赤霉病菌基因组数据库搜索FgRab7(FGSG_05141.3)的CDS序列,根据其编码的蛋白序列在Pfam 30.0[16]Blast搜索与其同源的真核生物的蛋白序列,NCBI CDD预测这些蛋白的保守结构域,利用Clustal X软件进行多重序列比对,利用Mega6.0对序列构建系统发育树。
1.3.2 菌株的培养
将保存的赤霉病菌菌株野生型PH-1、FgRab7敲除突变体和互补突变体分别接种到CM固体培养基(蔗糖10 g/L,酸水解酪蛋白6 g/L,酵母粉6 g/L,琼脂粉20 g/L)上,于28℃静置培养3~5 d。
(1)小麦籽粒培养基培养:装50 g(湿质量)灭菌麦粒于250 mL的三角瓶中,每个菌株试验设置3个重复,加入用灭菌的打孔器挑取的直径为0.5 cm的菌丝5块,每天振荡麦粒使得赤霉病菌在小麦籽粒中发酵均匀,在28℃ 条件下培养35 d,分别收集培养7 d、14 d、21 d、28 d和35 d时的小麦籽粒样品。
(2)产毒液体培养基培养:用灭菌的打孔器取5块菌丝,接种至100 mL产毒液体培养基(硝酸钠3 g/L,磷酸氢二钾1 g/L,硫酸镁0.5 g/L,氯化钾0.5 g/L,硫酸亚铁 0.01 g/L,蔗糖 30 g/L,蛋白胨10 g/L,pH为7.5)中,在28℃、120 r/min摇床培养35 d。
1.3.3 DON毒素测定
用灭菌纱布分别过滤收集野生型菌株PH-1和FgRab7突变体菌株在产毒培养基中培养不同时期的菌丝,用吸水纸将菌丝吸干称质量,滤液用ELISA法测定细胞外的DON毒素,计算单位质量菌丝产生的DON毒素量;将不同培养阶段的小麦籽粒样品粉碎,取5 g放置于250 mL的三角瓶中,加入25 mL去离子水,在振荡器上充分振荡15 min,转移至50 mL离心管中,常温下5 000 r/min离心5 min,取上清液用于DON毒素的测定,DON毒素测定方法参照 ELISA试剂盒说明。
1.3.4 DON合成途径Tri基因的荧光定量表达
将收集的培养不同阶段的菌丝放入液氮中快速研磨,采用Takara TRizol法提取总RNA,利用琼脂糖凝胶电泳检测RNA的完整性,微孔板分光光度计检测其纯度和浓度,反转录 cDNA采用TaKaRa两步法试剂盒 PrimeScriptTMII 1st Strand cDNA Synthesis Kit进行,cDNA的质量可以用小麦赤霉病菌的内参Actin基因检测。
根据DON合成途径中Tri基因的CDS序列设计引物(如表1),扩增长度在80~250 bp之间,引物由上海生工生物公司合成。荧光定量PCR反应体系为25 μL,含有SYBR Green 12.5 μL,正反向引物(10 μM)各0.5 μL,各阶段模板cDNA 10 ng,加无菌水至25 μL。荧光定量PCR程序为95℃,10 min;95℃ 15 s,60℃ 1 min,40个循环。每个模板稀释成一系列浓度梯度进行实时定量PCR反应扩增,反应结束后进行标准曲线分析。以小麦赤霉病菌野生型PH-1和FgRab7缺失突变体不同时期的cDNA为模板,以Tublin作为内参基因,每个样品重复3次,根据PCR反应的Ct值采用2-ΔΔCt法[17]进行各基因的相对表达量分析。

表1 Tri基因实时定量PCR所用的引物序列Table 1 Tri genes primers of quantitative real-time PCR
2 结果与分析
2.1 小麦赤霉病菌FgRab7的功能预测
为研究小麦赤霉病菌FgRab7在调控DON毒素方面的功能,我们将小麦赤霉病菌FgRab7蛋白序列在Pfam中进行Blast同源比对,获得了部分真菌的 Rab7蛋白,这些蛋白与小麦赤霉病菌的FgRab7蛋白序列经NCBI CDD分析发现,FgRab7编码的蛋白都含有Ras超家族蛋白特有的保守结构域,因此,小麦赤霉病菌的FgRab7可能和Ras家族中Rac、Rho[14]一样具有调控DON毒素生物合成的功能。对这些蛋白序列进行系统发育分析显示(结果见图1),它们处于3个不同分支:小麦赤霉病菌Fusarium graminearum PH-1、FgRab7蛋白与假禾谷镰孢菌(Fusarium pseudograminearum)、尖孢镰刀菌(Fusarium oxysporum)、粗糙脉孢菌(Neurospora crassa)和稻瘟病菌(Magnaporthe oryzae)Rab7蛋白聚在同一个进化分支中,与假禾谷镰孢菌进化关系最近,最新研究发现该菌种也是小麦赤霉病的病原菌[18],它们可能在赤霉病发生中执行相同的生理功能;构巢曲霉(Aspergillus nidulans)、黄曲霉(Aspergillus flavus)、青霉(Penicillium)、棒曲霉(Aspergillus clavatus)和烟曲霉(Aspergillus fumigatus)等具有产毒特性的真菌处在同一个分支,它们可能与小麦赤霉病菌中的FgRab7具有相似的功能;酿酒酵母菌(Saccharomyces cerevisiae)单独处于一个分支,其为非丝状真菌,且不产生毒素,与小麦赤霉病菌的FgRab7关系最远。由此推测,随真菌的分化Rab7逐渐分化成具有调控毒素功能的基因。

图1 小麦赤霉病菌和部分真菌物种Rab7蛋白的系统发育分析Fig.1 Phylogenetic analysis of Fusarium graminearum and partial fungal Rab7 protein
2.2 小麦赤霉病菌FgRab7对DON毒素合成的影响
对小麦赤霉病菌野生型和FgRab7突变体菌株的生长状况进行比较,结果见图2。两个菌株在CM培养基中生长5 d,野生型PH-1菌株的生长速率明显高于FgRab7敲除突变体,两者的菌落直径相差约4倍,且野生型菌株的气生菌丝更发达;进一步观察FgRab7敲除突变体互补菌株,发现其菌丝生长基本恢复到野生型的水平,表明FgRab7可以影响小麦赤霉病菌的生长过程。

图2 小麦赤霉病菌野生型PH-1和FgRab7突变体菌株的菌落形态Fig.2 Colony morphology of the wild type PH-1 and the FgRab7 gene mutants
将小麦赤霉病菌野生型菌株PH-1、FgRab7敲除突变体和FgRab7互补突变体菌株分别接种到小麦籽粒和产毒液体培养基中,ELISA法检测不同培养时期的DON毒素含量,结果如图3所示。在接种野生型菌株的小麦中,培养21 d时DON含量显著升高(P<0.05),然后以较高的速率持续产毒,35 d时小麦中DON含量达到1 006 mg/kg;FgRab7缺失突变体DON毒素的产生比较缓慢,产DON毒素能力显著低于野生型菌株(P<0.05),35 d时小麦中的DON毒素积累量仅为58 mg/kg。当在小麦中接种FgRab7互补突变体时,可发现其产毒能力有较大程度地恢复,35 d时小麦中的DON毒素积累量达690 mg/kg。将3个不同菌株接种到液体产毒培养基中进行产毒试验比较,发现其产毒的趋势与在小麦基质中完全一致。这说明FgRab7基因在DON毒素合成中有非常重要的作用。

图3 小麦赤霉病菌野生型和FgRab7突变体在不同基质中DON毒素的含量变化Fig.3 The production of DON by the wild type and FgRab7 mutants in different mediums
2.3 FgRab7对DON毒素生物合成途径中Tri基因的调控
2.3.1 RNA提取
提取小麦赤霉病菌野生型PH-1和FgRab7敲除突变体在不同生长时期的RNA,部分样品电泳结果如图4所示,28S、18S条带清楚,表明总RNA无降解,完整性较好;测定RNA质量浓度分别为1 764和1 179 ng/μL,260/280 OD值分别为1.97和2.05,可用于进行下一步试验。
2.3.2 DON合成途径中Tri基因的RT-PCR分析
小麦赤霉病菌DON毒素合成基因簇包括很多Tri基因,不同的基因的表达最终合成不同的DON毒素类型,如DON、3-DON、15-DON等。因此,我们在野生型菌株培养7 d时的cDNA中扩增Tri基因,结果显示(图5),Tri5、Tri4、Tri101、Tri11、Tri6、Tri3、Tri1和Tri8等基因都能扩增出单一清晰的条带,大小分别为 1 128、1 563、1 416、1 479、657、1 458、1 849、1 338 bp。这些 Tri基因在野生型PH-1菌株中是正常表达的,它们的表达决定着DON毒素的生物合成。
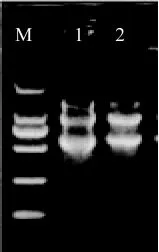
图4 小麦赤霉病菌RNA电泳图Fig.4 Electrophoresis validation of RNA in the Fusarium graminearum
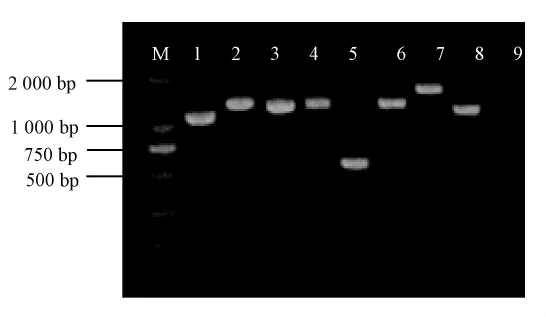
图5 Tri基因在PH-1菌株cDNA中的扩增Fig.5 The amplification of Tri genes in the PH-1 cDNA
2.3.3 Tri基因在野生型和FgRab7缺失突变体菌株中的实时定量分析
为揭示FgRab7调控DON毒素生物合成的机制,我们在小麦赤霉病菌中对Tri基因在培养的各个时期进行实时定量PCR分析,结果见图6。由图6可见,在野生型菌株PH-1中,各Tri基因相对表达量逐渐上升,相同的培养时期,FgRab7敲除突变体中Tri基因的相对表达量比野生型明显降低,这与两种菌株中DON毒素的合成量的相对多少相吻合。在 FgRab7缺失突变体中,Tri5、Tri4、Tri101、Tri11、Tri3相对表达量随着时间的延长逐渐下降,Tri1、Tri8的表达量一直处于很低的水平。Tri1、Tri8处于DON合成途径中Tri3基因的下游,这说明FgRab7基因的缺失对Tri基因的表达有影响,对Tri3下游基因影响最大,暗含着FgRab7通过与FgTri3基因相互作用影响其下游Tri基因的表达。在野生型菌株PH-1中,Tri5在整个培养期间的表达量相对较高,由于DON的合成反应起始于法尼基焦磷酸,在Tri5编码的trichodiene合成酶的催化作用下完成,因此,Tri5的表达影响着DON毒素的整个合成过程。Tri6是全局调控因子,当Tri3下游基因表达降低,它将调控其上游的基因表达逐渐减弱,最终使全部Tri基因表达降低,DON毒素合成下降。因此,在小麦赤霉病菌中Rab7是通过调控与DON合成途径直接作用的Tri基因簇的表达而影响DON合成的。
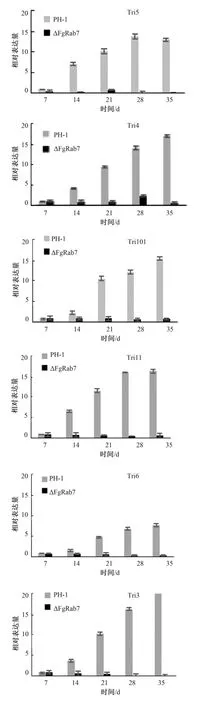
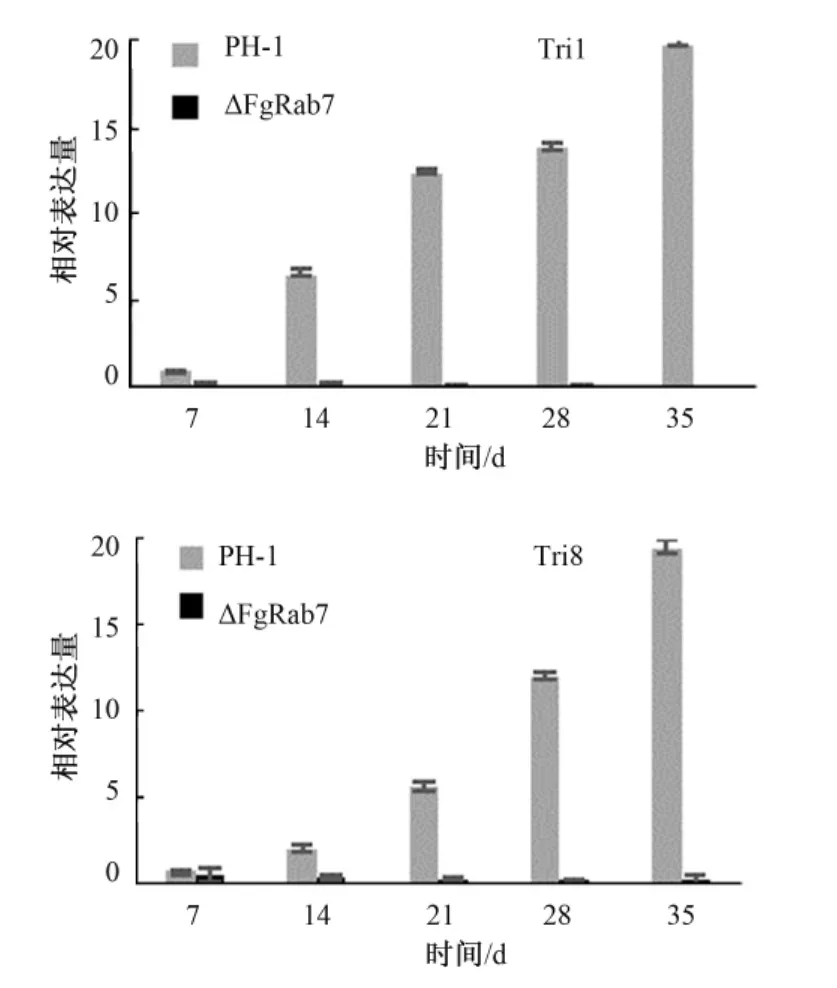
图6 Tri基因在PH-1和FgRab7敲除突变体中的相对表达量Fig.6 Relative expression of Tri genes in the wild type and△FgRab7
3 结论
本研究通过预测小麦赤霉病菌FgRab7蛋白的结构域和分析FgRab7对DON毒素生物合成和Tri基因相对表达量的影响,显示FgRab7含有Ras超家族蛋白保守结构域,FgRab7的缺失使小麦赤霉病菌的DON毒素合成明显减少,Tri基因表达量显著下降,表明FgRab7是影响DON合成的重要因子,具有调控Tri基因簇表达和DON毒素生物合成的作用。研究结果对揭示小麦赤霉病菌的致病机制和防治小麦赤霉病具有重要指导意义,为更好地降低赤霉病菌毒素给食品及粮食安全带来的风险提供了理论基础。
[1]ZHANG J B,WANG J H,GONG A D,et al.Natural occurrence of Fusarium head blight,mycotoxins and mycotoxin-producing isolates of Fusarium in commercialfieldsofwheatin Hubei[J].Plant Pathology,2013,62(1): 92-102.
[2]BORMANN J,BOENISCH M J,BRUCKNER E,et al.The adenylyl cyclase plays a regulatory role in the morphogenetic switch from vegetative to pathogenic lifestyle of Fusarium graminearum on wheat[J].Plos One,2014,9(3):e91135.
[3]PALAZZINI J,FUMERO V,YERKOVICH N,et al.Correlation between Fusarium graminearum and deoxynivalenol during the 2012/13 wheat Fusarium head blight outbreak in Argentina[J].Cereal Research Communications,2015,43(4):627-637.
[4]PESTKA J J.Deoxynivalenol:mechanisms of action,human exposure,and toxicological relevance[J].Archives of toxicology,2010,84(9):663-669.
[5]ZHAO H F,WANG Y Q,ZOU Y,et al.Natural occurrence ofdeoxynivalenolin soy sauces consumed in China[J].Food Control,2013,29(1):71-75.
[6]ZHANG S B,ZHAI H C,HU Y S,et al.A rapid detection method for microbial spoilage of agro-products based on catalase activity[J]. Food Control,2014,42:220-224.
[7]MCCORMICK S P,STANLEY A M,STOVER N A,et al.Trichothecenes:from simple to complex mycotoxins[J].Toxins,2011,3:802-814.
[8]ALEXANDER N J,PROCTOR R H,MCCORMICK S P,et al.Genes,gene clusters,and biosynthesis of trichothecenes and fumonisins in Fusarium[J].Toxin Review,2009,28(2-3): 198-215.
[9]NASMITH C G,WALKOWIAK S,WANG L,et al.Tri6 is a global transcription regulator in the phytopathogen Fusarium graminearum[J]. Plos Pathogen,2011,7(9):e1002266.
[10]GARVEY G S,MCCORMICK S P,ALEXANDER N J,et al.Structural and functional characterization of Tri3 trichothecene 15-O-acetyltransferase from Fusarium sporotrichioides[J].Protein Science,2009,18(4):747-761.
[11]BOUTIGNY A L,WARD T J,BALLOIS N,et al.Diversity of the Fusarium graminearum species complex on french cereals[J]. European Journal of Plant Pathology,2014,18:133-148.
[12]YU F W,GU Q,YUN Y Z,et al.The TOR signaling pathway regulates vegetative development and virulence in Fusarium graminearum[J].New Phytologist,2014,20(31):219-232.
[13]QIN J,WANG G H,JIANG C,et al.Fgk3 glycogen synthase kinase is important for development,pathogenesis,and stress responses in Fusarium graminearum[J].Scientific Reports,2015,5:8504.
[14]ZHANG C K,WANG Y,WANG J Q,et al. Functional characterization of rho family small gtpases in Fusarium graminearum[J].Fungal Genetics and Biology,2013,61:90-99.
[15]ZHENG H W,ZHENG W H,WU C X,et al.Rab gtpases are essential for membrane trafficking-dependent growth and pathogenicity in Fusarium graminearum[J].Environmental Microbiology,2015,17(1):4580-4599.
[16]FINN R D,COGGILL P,EBERHARDT R Y,etal.The Pfam protein familiesdatabase: towards a more sustainable future[J].Nucleic Acids Research,2015,44(database issue): D279-D285.
[17]BUSTIN SA,BENES V,GARSON JA,et al. The miqe guidelines:minimum information for publication of quantitative real-time PCR experiments[J].Clinical Chemistry,2009,55: 611-622.
[18]XU F,SONG YL,YANG G Q,et al.First Report of Fusarium pseudograminearum from wheat heads with fusarium head blight in north China plain[J].Plant Disease,2015,99(1): 156-156.
REGULATION ON Tri RELATIVE EXPRESSION AND DON BIOSYNTHESIS OF FGRAB7 IN FUSARIUM GRAMINEARUM
WANG Yajun,ZHAI Huanchen,ZHANG Shuaibing,LIU Xinying,CAI Jingping
(School of Biological Engineering,Henan University of Technology,Zhengzhou 450001,China)
The production of Deoxynivalenol(DON)by wild-type Fusarium graminearum and its FgRab7 knockout mutant cultivated in different media were detected by ELISA.The results showed that the content of DON produced by FgRab7 knockout mutant was significantly less than that of wild-type F.graminearum,which indicated that the toxin-producing capability of F.graminearum was affected by FgRab7.The relative expression of Tri genes related to DON biosynthesis were analyzed in different developmental stages of the two strains through fluorescence quantitative PCR,and results showed that the expression of Tri genes rose gradually in the wild-type strain,but in a very low level in the FgRab7 knockout mutant.Compared with the wild type strain,the relative expression of Tri genes in the FgRab7 knockout mutant was significantly lower than the wild-type strain in the same growth period.The study confirmed that the FgRab7 gene could regulate the expression of Tri gene and thereby influence the biosynthesis of DON toxin.
Fusarium graminearum;FgRab7;regulation;Tri gene;deoxynivalenol
S435.121
A
1673-2383(2017)02-0057-06
http://kns.cnki.net/kcms/detail/41.1378.N.20170420.1409.020.html
2016-10-13
国家重点基础研究发展计划(973计划)(2013CB127804);河南省教育厅自然科学项目(14A180004);河南省科技攻关项目(162102210191)
王亚君(1991—),女,河南商丘人,硕士研究生,研究方向为粮食微生物。
*通信作者

