谷氨酸氧化酶高产菌株的筛选鉴定及催化生产α-酮戊二酸
刘 佳,徐继嗣,罗秋玲,陈修来,刘立明
(1.江南大学食品科学与技术国家重点实验室工业生物技术教育部重点实验室,江苏无锡214122;2.张家港市华天制药有限公司,江苏张家港215633)
谷氨酸氧化酶高产菌株的筛选鉴定及催化生产α-酮戊二酸
刘 佳1,徐继嗣2,罗秋玲1,陈修来1,刘立明1
(1.江南大学食品科学与技术国家重点实验室工业生物技术教育部重点实验室,江苏无锡214122;2.张家港市华天制药有限公司,江苏张家港215633)
采用简易的偶联终点显色反应(Trinder显色反应),从土壤中分离出高产谷氨酸氧化酶(LGOX)的菌株不透明红球菌RhodococcusopacusFMME1-41,并对此菌株的产酶特性进行研究。结果表明:该菌株所产LGOX主要分泌在发酵液中,对L-谷氨酸具有较强的底物专一性,最适pH 6.5,最适温度为35 ℃,Mn2+是该酶的激活剂。通过发酵培养基优化,培养30 h时LGOX活力达到6.4 U/mL。利用该酶转化L-谷氨酸生产α-酮戊二酸,在最佳转化条件下转化20 h,α-酮戊二酸产量达到91.2 g/L,转化率为91.8%,α-KG生产强度为4.56 g/(L·h)。
L-谷氨酸氧化酶;不透明红球菌;α-酮戊二酸;酶法转化
α-酮戊二酸(α-KG) 是三羧酸循环和氨基酸代谢中重要的二元羧酸,能为人体和动物提供营养,具有特殊的生理功能,在医药、食品、精细化工等领域[1-2]被广泛应用。通过菌株筛选、过程优化和代谢工程改造,发酵法生产α-KG已经有了很大进展。微生物发酵法生产α-KG的菌种包括[3]:荧光假单胞菌(Pesudomonasfluorescens)、沙雷氏菌(Serratiamarcescens)、石蜡节杆菌(Arthrobacterparaffineus) 和谷氨酸棒杆菌(Corynebacteriumglutamicum)等细菌以及光滑球拟酵母(Torulopsisglabrata)、解脂亚洛酵母(Yarrowialipolytica)等真菌。光滑球拟酵母利用葡萄糖发酵64 h时可积累43.7 g/L α-KG[4];以廉价甘油为碳源Y.lipolytica发酵117 h积累186 g/L α-KG[5],由于该法存在发酵周期长、杂酸副产物过多、下游产品分离纯化困难等诸多的生产瓶颈问题,尚未实现α-KG发酵的工业化。
近年来,国内L-谷氨酸钠存在产能过剩现象,亟待寻找解决方法。根据L-谷氨酸与α-KG结构特点,可将L-谷氨酸中氨基氧化为酮基生成α-KG,实现L-谷氨酸的高值化和α-KG的清洁和可持续生产。目前,用于生产α-KG的酶制剂主要包括L-氨基酸氧化酶(L-amino acid oxidase,LAAO,EC1.4.3.2)和L-谷氨酸氧化酶(L-glutamate oxidase,LGOX,EC1.4.3.11)两种。两者均能催化氧化L-谷氨酸生成α-KG,同时生成NH3和H2O2[6]。LAAO都以非共价结合的黄素腺嘌呤二核苷酸(FAD)为辅酶,除了来自海单胞菌(Marinomonasmediterranea) 的赖氨酸氧化酶[7]外,大多数LAAO具有广泛的底物谱[8]。LGOX在转化过程中不需要外源添加辅因子,对L-谷氨酸有很强的底物专一性。LOGX本身也是一种具有应用价值的工具酶,应用于制备疾病诊断试剂盒和生物传感器中的酶膜[9-10]。LGOX主要存在于链霉菌属中,1983年,Kamei等[11]首次在浅紫链霉菌(Streptomycesviolascens)中发现了能专一性氧化L-谷氨酸的LGOX,但酶活低导致其实用价值不高。同年Kusakabe等[12]在Streptomycessp.X-119-6中发现了底物专一性更高且耐热的LGOX。随后,Bohmer等[13]从内涂链霉菌中分离纯化出对L-谷氨酸完全特异的由2个亚基构成的LGOX,并对该酶的生物学性质进行初步研究,该酶稳定性好,实用性较强,只有Ag+和Hg2+能够抑制其活性。之后Arima等[14]对Streptomycessp.X-119-6中的LGOX晶体结构进行了分析,通过与LAAO蛋白序列和晶体结构比较发现,蛋白活性部位在蛋白中心、底物和产物进出通道较窄以及活性部位残基不同造成底物专一性强。目前,尽管已有多株产LGOX的微生物菌株,但其产酶能力都很低,不具备工业应用潜质。
本研究通过自主筛选获得1株高产LGOX的不透明红球菌RhodococcusopacusFMME1-41,对LGOX酶学性质进行分析,在此基础上利用发酵粗酶液转化生产α-KG,为酶法转化L-谷氨酸生产α-KG提供新的菌株来源。
1 材料与方法
1.1 材料
1.1.1 样品来源
味精厂废水废物排放处的土壤。
1.1.2 培养基
基础培养基(g/L):酵母粉5,胰蛋白胨5,味精10。
种子培养基(g/L):酵母粉1,大豆蛋白胨0.3,葡萄糖5,味精2.5,NaCl 5,KH2PO43。
发酵培养基(g/L):酵母膏5,胰蛋白胨2,(NH4)2SO42,葡萄糖25,K2HPO40.5,KH2PO40.8,MgSO40.5,MnSO40.1,味精2.5。
以上培养都在115 ℃条件下灭菌20 min。
1.2 方法
1.2.1 培养方法
菌株经斜面活化后接种于装液量25 mL的250 mL三角瓶中,在30 ℃、200 r/min条件下培养18 h,然后按照8%的接种量接种至装液量50 mL的250 mL三角瓶中,在30 ℃、200 r/min条件下培养30~35 h。
1.2.2 产酶菌株的筛选
1)菌株的初步分离纯化。从味精厂废水废物排放的土壤中多地点取样,放置于无菌袋中。称取样品1 g碾碎,溶解于含有基础培养基的10 mL无菌培养基中,30 ℃振荡培养1 h,梯度稀释涂布于固体基础培养基中,30 ℃倒置培养3~5 d。
2)产酶菌株初筛。将培养的单菌落点种于基础培养基平板上,于30 ℃下培养36 h。根据Trinder反应[15],将反应液均匀喷洒至平板表面,于37 ℃培养箱中静置观察,出现紫红色的菌落即为LGOX生产菌株。挑取变色圈直径大、颜色深、显色快的菌落进行复筛。
3)产酶菌株复筛。将初筛菌株在装有基础培养基的24孔板中培养,在30 ℃、200 r/min条件下振荡培养36 h时间后,离心取上清液按照酶活测定方法于96孔板做显色反应,测定其LGOX酶活力,酶活最高菌种即为目的菌株。
1.2.3 酶活检测方法
LGOX酶活性测定通过Trinder反应(4-氨基安替比林体系) 测定[15-16]。1 U LGOX酶活定义:在37 ℃条件下每分钟反应生成1 μmol H2O2所需的酶量。
过氧化氢酶活测定参照文献[17],1 U过氧化氢酶活定义:在37 ℃条件下每分钟分解1 μmol H2O2所需酶量为1个酶活单位。
1.2.4 菌种鉴定方法
1)菌落形态与生理生化实验。参照《伯杰氏细菌鉴定手册》对筛选菌株进行菌落形态和生理生化鉴定。
2)16S rDNA序列分子生物学鉴定。16S rDNA序列测定和分析参照文献[18]进行,按照细菌基因组提取方法提取筛选菌株基因组DNA,以基因组DNA为模板,采用细菌通用引物(16S rDNA-F:5′-AGAGTTTGAI,CCTGGCTCAG-3′、16S rDNA-R:5′-TACGGCIACCTTGTTACGACTT-3′)扩增16S rDNA,琼脂糖凝胶电泳检测的阳性扩增片段送至生工生物工程(上海)有限公司测序。将所得序列与NCBI的GenBank数据库中序列进行BLAST分析比对。
1.2.5 LGOX的细胞定位与酶学性质
使用分子量2.0×104超滤膜对发酵上清液进行浓缩,使用脱盐柱脱盐后,冻干即得到粗酶粉。LGOX的进一步纯化与酶学性质测定参照文献[16,19]中相关方法进行。
1.2.6 转化条件
转化体系中添加一定体积的上清液,一定浓度L-谷氨酸钠、H2O2酶和金属离子,调节pH为6.5,于装液量50 mL的500 mL三角瓶中,在35 ℃、200 r/min条件下转化20 h。
1.2.7 LGOX底物谱测定
酶活检测的显色液中的L-谷氨酸钠用不同氨基酸代替,按照酶活测定的方法测定LGOX针对不同底物的酶活。结果以L-谷氨酸为底物测定的活性定义为100%,得到不同底物的相对活性。
1.2.8 α-KG和琥珀酸浓度测定方法
α-KG和琥珀酸利用高效液相色谱(HPLC)测定[20]。色谱柱为Aminex HPX-87H,流动相为5 mmol/L H2SO4,流速为0.6 mL/min,温度为35 ℃,进样量为10 μL,检测器为紫外检测器。
2 结果与讨论
2.1 平板显色反应筛选LGOX高产菌株
将分离菌株点种于平板中,根据Trinder反应,挑取显色快、变色圈直径大的79株菌株。将79株菌株进一步进行发酵复筛验证,有3株产酶能力超过1.0 U/mL。进一步进行发酵实验,最终确定菌株FMME1-41为最佳产酶菌株,测得LGOX酶活为2.9 U/mL。
2.2 产酶菌株菌种鉴定
2.2.1 形态与培养特征
FMME1-41的菌落形态和电镜图片如图1。由图1可知:在营养肉汤固体培养基上,菌株FMME1-41菌落呈红色(图1(a)),圆形不透明,表面光滑,边缘整齐。显微镜下显示细胞形态为球状和短杆状,不产芽孢(图1(b));革兰氏染色为阳性(图1(c))。

图1 FMME1-41的菌落形态与电镜照片Fig.1 The phenotypes and electron microscope images of FMME1-41
2.2.2 生理生化特征鉴定结果
筛选菌株的生理生化特性,如表1所示。由表1可知:该菌株不能液化明胶,不能水解淀粉,接触酶试验阳性、V-P试验阳性、甲基红反应阴性、能还原硝酸盐,可以利用葡萄糖、果糖、麦芽糖、甘露醇、木糖、阿拉伯糖多种碳源生长。

表1 筛选菌株生理生化特征
注:“+”为阳性;“-”为阴性。
2.2.3 16S rDNA鉴定结果
以基因组DNA为模板,以细菌鉴定16S rRNA通用引物进行PCR扩增,琼脂糖凝胶电泳检测目的条带大小为1 000~2 000 bp(图2)。16S rDNA 测序结果为1 461 bp,将该序列与GenBank 数据库中的核苷酸序列进行同源性分析,得到亲缘关系最近的菌种为Rhodococcusopacus,同源性达99%,确定筛选菌株为不透明红球菌,命名为R.opacusFMME1-41。

M为标准DNA;1~2为菌株FMME1-41的PCR结果图2 16S rDNA PCR阳性克隆鉴定电泳图Fig.2 PCR amplification fragment of FMME1-41 16S rDNA
2.3 FMME1-41生产LGOX的发酵过程与细胞定位
采用单因素和正交实验对发酵培养基碳源、氮源和金属离子浓度进行优化,得到最优发酵产酶培养基(g/L):酵母膏5,胰蛋白胨2,(NH4)2SO42,葡萄糖25,K2HPO40.5,KH2PO40.8,MgSO40.5,MnSO40.1。R.opacusFMME1-41发酵产酶过程曲线如图3。由图3可知:LGOX酶活与菌体生长是同步的,随着菌浓增加酶活不断增加,发酵30 h,LGOX酶活达到6.4 U/mL,酶活比优化前提高了1.2倍,此时上清液酶活与菌体酶活的比例为5.8∶ 0.6(29∶ 3)。由此可以看出,90%的LGOX分泌表达至细胞外,10%存在于细胞内,该菌生产的LGOX属于胞外酶。
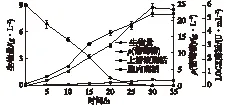
图3 R. opacus FMME1-41发酵生产LGOX 过程变化曲线Fig.3 Growth curves of R.opacus FMME1-41 fermentation for LGOX production
2.4 LGOX的酶学性质
2.4.1 LGOX酶液底物谱
将适量粗提酶粉溶于去离子水中,考察LGOX对底物专一性,结果见表2。由表2可知:该酶对L-谷氨酸催化酶活较高,对L-谷氨酰胺和L-组氨酸相对于L-谷氨酸分别具有7.8%和3.4%的相对酶活,余下氨基酸作为底物时并没有检测到酶活。同时,该酶催化L-谷氨酸生产α-KG不需要添加FAD,且对L-谷氨酸具有较强的底物专一性。

表2 LGOX底物谱检测
2.4.2 LGOX的最适pH
考察不同pH对LGOX活性的影响,结果见图4。由图4可知:R.opacusFMME1-41生产的LGOX在pH 6.0~7.0时,可以维持86%以上的酶活,而pH为6.5时相对酶活最高。由此,可以推断LGOX的最适pH为6.5。

图4 不同pH对LGOX酶活的影响Fig.4 Effects of different pH on LGOX production
2.4.3 LGOX最适温度与温度稳定性
考察温度对LGOX活性的影响及LGOX的热稳定性,结果见图5和图6。由图5和图6可知:该酶最适温度为35 ℃,在30~40 ℃可以维持80%以上的酶活,具有较宽的温度稳定性。将粗酶液在4 ℃保温在0~12 h时,酶活没有显著变化,继续放置7 d后酶活损失13%,30 d后酶活损失40%;在35和50 ℃条件下放置20 h,酶活分别损失15%和78%。综上可知,LGOX在低温和最适温度下较稳定。

图5 不同温度对LGOX酶活的影响Fig.5 Effects of different temperatures on LGOX production
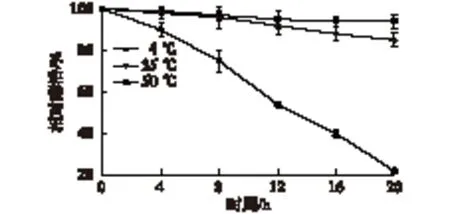
图6 不同温度下LGOX的热稳定性Fig.6 Thermal stability of LGOX under different temperature
2.5 LGOX转化L-谷氨酸生产α-KG
2.5.1 H2O2酶加量对LGOX转化L-谷氨酸生产α-KG的影响
LGOX在催化L-谷氨酸生产α-KG的反应中,会生成H2O2,H2O2会抑制LGOX的酶活,并且可以将酮戊二酸氧化生成琥珀酸。R.opacusFMME1-41发酵液中含有分泌表达的H2O2酶,但是酶活偏低(8.2~11.0 U/mL),因此转化体系中需要额外添加H2O2酶。在L-谷氨酸投料50 g/L、LGOX酶活3.0 U/mL条件下,考察H2O2酶加量对LGOX转化L-谷氨酸生产α-KG的影响,结果见图7。由图7可知:不添加H2O2酶时,琥珀酸积累13.2 g/L,α-KG产量为20.4 g/L;α-KG产量随着H2O2酶加量增加而增加。当添加H2O2酶是LGOX酶活120倍时,H2O2被及时分解,此时转化液中几乎检测不到琥珀酸,α-KG产量达39.8 g/L,摩尔转化率为80.1%。

图7 不同H2O2酶加量对LGOX转化生产α-KG的影响Fig.7 Effects of catalase concentration on the production of α-KG production by LGOX transformation
2.5.2 金属离子对LGOX转化L-谷氨酸生产α-KG的影响
考察不同金属离子对LGOX生产α-KG的影响,结果见图8。由图8可知:Zn2+、Fe2+、Ca2+、Cu2+和Ag+对LGOX酶具有抑制作用;K+、Mg2+对转化几乎没有影响;Mn2+对转化有促进作用,在加入Mn2+条件下,α-KG产量比不添加Mn2+提高了9.5%。在发酵培养基优化时也发现添加Mn2+可以提高发酵液中LGOX酶活,与Niu等[21]报道Mn2+对LGOX具有激活作用一致。进一步考察转化体系中添加不同浓度Mn2+对生产α-KG的影响,发现当添加3 mmol/L的MnCl2时,转化20 h,α-KG产量最高为45.8 g/L,此时L-谷氨酸摩尔转化率为92.2%,比不添加Mn2+时产量提高了15.0%。

图8 不同金属离子和Mn2+浓度对LGOX 生产α-KG的影响Fig.8 Effects of different ions (a) and different concentration of Mn2+ (b) on α-KG production by LGOX transformation
2.5.3 L-谷氨酸浓度对LGOX转化生产α-KG的影响
在转化体系中添加3 U/mL LGOX、360 U/mL H2O2酶、3 mmol/L MnCl2,控制pH 6.5,反应温度35 ℃,考察不同底物浓度的L-谷氨酸对转化生产α-KG的影响,结果见图9。由图9可知:当L-谷氨酸质量浓度为50~100 g/L时,α-KG浓度与谷氨酸浓度正相关,谷氨酸的摩尔转化率基本维持不变;当谷氨酸质量浓度高于100 g/L时,α-KG浓度不再增加,谷氨酸的摩尔转化率迅速下降。因此,最适谷氨酸质量浓度为100 g/L,此时α-KG产量为91.2 g/L,转化率为91.8%。

图9 L-谷氨酸浓度对LGOX转化生产 α-KG的影响Fig.9 Effects of L-glutamate concentration on α-KG production by LGOX transformation
3 结论
利用简易的平板显色反应和高通量筛技术得到1株高产LGOX的菌株R.opacusFMME1-41,LGOX以廉价L-谷氨酸为底物转化生产α-KG,不需要额外添加辅助因子,底物专一性强,稳定性佳。通过发酵和转化条件优化,LGOX发酵酶活提高1.2倍,达到6.4 U/mL,转化生产α-KG周期为20 h,产量为91.2 g/L,转化率为91.8%。本研究为获得LGOX提供了新的菌种来源,也为利用该酶催化L-谷氨酸生产α-KG奠定了工业化的基础。
[1] CHERNYAVSKAYA O G,SHISHKANOVA N V,IL′kCHENKO A P,et al.Synthesis of alpha-ketoglutaric acid byYarrowialipolyticayeast grown on ethanol[J].Appl Microbiol Biotech,2000,53(2):152-158.
[2] JINAP S,HAJEB P.Glutamate:its applications in food and contribution to health[J].Appetite,2010,55(1):1-10.
[3] OTTO C,YOVKOVA V,BARTH G.Overproduction and secretion of alpha-keto glutaric acid by microorganisms[J].Appl Microbiol Biotech,2011,92(4):689-695.
[4] LIU L M,LI Y,ZHU Y,et al.Redistribution of carbon fluxinTorulopsisglabrataby altering vitamin and calcium level[J].Metab Eng,2007,9(1):21-29.
[5] YOVKOVA V,OTTO C,AURICH A,et al.Engineering the alpha-ketoglutarate overproduction from raw glycerol by overexpression of the genes encoding NADP(+)-dependent isocitrate dehydro-genase and pyruvate carboxylase inYarrowialipolytica[J].Appl Microbiol Biotech,2014,98(5):2003-2013.
[6] 牛盼清,张震宇,刘立明.酶法转化L-谷氨酸生产α-酮戊二酸[J].生物工程学报,2014,30(8):1318-1322.
[7] LUCAS-ELIO P,GOMEZ D,SOLANO F,et al.The antimicrobial activity of marinocine,synthesized byMarinomonasmediterranea,is due to hydrogen peroxide generated by its lysine oxidase activity[J].J Bacteriol,2006,188(7):2493-2501.
[8] GEUEKE B,HUMMEL W.A new bacterial L-amino acid oxidasewith a broad substrate specificity:purification and characterization[J].Enzyme Microb Tech,2002,31(1-2):77-87.
[9] 郑强,严卫民,徐东,等.L-谷氨酸氧化酶的来源和特性及其在生化检验中的应用[J].检验医学教育,2003,10(2):32-35.
[10] KAMEI T,ASANO K,NAKAMURA S.Determination of serum glutamate oxaloacetate transaminase and glutamate pyruvate transaminase by L-glutamate oxidase[J].Chem Pharm Bull,1986,34(1):409-412.
[11] KAMEI T,ASANO K,KONDO H,et al.L-glutamate oxidase fromStreptomycesviolascens.Ⅱ:properties[J].Chem Pharm Bull,1983,31(10):8-12.
[12] KUSAKABE H,MIDORIKAWA Y,KNNINAKA K.A occurrence of a new enzyme,L-glutamate oxidase in a wheat bran culture extract ofStreptomycessp.X-119-6[J].Agric Biol Chem,1983,47(1):179-182.
[13] BOHMER A,MULLER A,PASSARGE M,et al.A novel L-glutamate oxidase fromStreptomycesendus:purification and properties[J].Eur J Biochem,1989,182(2):327-332.
[14] ARIMA J,SASAKI C,SAKAGUCHIi C,et al.Structural characterization of L-glutamate oxidase fromStreptomycessp X-119-6[J].FEBS J,2009,276(14):4318-4327.
[15] ALLAIN C C,POON L S,CHAN C S,et al.Enzymatic determination of total serum cholesterol[J].Clin Chem,1974,20(4):470-475.
[16] 卢婵,郑璞,孙志浩.一株产L-谷氨酸氧化酶的链霉菌分离鉴定及酶学性质分析[J].生物技术通报,2012(12):144-149.
[17] 张兴群,郑慧琳,疏翠,等.表达藤黄微球菌过氧化氢酶基因的工程大肠杆菌发酵条件优化[J].食品与药品,2012(5):153-158.
[18] 何剑,雍晓雨,周俊,等.一株γ-多聚谷氨酸生产菌的分离筛选与鉴定[J].生物加工过程,2014,12(4):87-93.
[19] ARIMA J,TAMURA T,KUSAKABE H,et al.Recombinant expression,biochemical characterization and stabilization through proteolysis of an L-glutamate oxidase fromStreptomycessp.X-119-6[J].J Biochem,2003,134(6):805-812.
[20] 占宏德,李江华,刘龙,等.离子交换法纯化α-酮戊二酸[J].食品与生物技术学报,2013,32(10):1043-1048.
[21] NIU P,DONG X,WANGE Y,et al.Enzymatic production of α-ketoglutaric acid from L-glutamic acid via L-glutamate oxidase[J].J Biotechnol,2014,179:56-62.
(责任编辑 荀志金)
Screening and identification of high yield strain of glutamate oxidaseand its enzymatic production of α-ketoglutarate
LIU Jia1,XU Jisi2,LUO Qiuling1,CHEN Xiulai1, LIU Liming1
(1.State Key Laboratory of Food Science & Technology,Key Laboratory of Industrial Biotechnology of the Ministry of Education,Jiangnan University,Wuxi 214122,China; 2.Huatian Pharmaceutical Co. Ltd.,Zhangjiagang 215633,China)
Using a simple Trinder color reaction,the high yield glutamate oxidase (LGOX) strainRhodococcusopacusFMME 1-41 was obtained from soil.The enzymatic properties ofR.opacusFMME 1-41 were studied.LGOX was an extracellular enzyme,its optimal pH was 6.5 and optimal temperature was 35 ℃.L-glutamate is specific substrate of the LGOX.LGOX could be activated by Mn2+.After medium optimization,LGOX activity could reach 6.4 U/mL for 30 h.A strategy for α-ketoglutaric acid (α-KG) production from L-glutamic acid by LGOX was developed.Under the optimal conditions,the yield of α-KG reached 91.2 g/L with the molar conversion ratio of 91.8% and production intensity 4.56 g/(L·h).
L-glutamate oxidase;Rhodococcusopacus;α-ketoglutarate; enzymatic transformation
10.3969/j.issn.1672-3678.2017.03.004
2016-10-24
江苏省科技支撑计划社会发展项目(BE2014652)
刘 佳(1988—),女,山东青岛人,助理实验师,研究方向:生物工程;刘立明(联系人),教授,E-mail:mingll@jiangnan.edu.cn
Q939.97
A
1672-3678(2017)03-0018-07

