仿生法制备氧化硅载体固定化苏氨酸脱氨酶及其酶学性质
李巧丽,赵 哲,徐建妙
(浙江工业大学生物工程学院,浙江杭州310014)
仿生法制备氧化硅载体固定化苏氨酸脱氨酶及其酶学性质
李巧丽,赵 哲,徐建妙
(浙江工业大学生物工程学院,浙江杭州310014)
通过共沉淀法制备无机氧化硅载体,然后将其应用到苏氨酸脱氨酶的固定化研究中。用扫描电子显微镜对氧化硅载体进行表征,优化了固定化条件,当n(Si):n(N)为1∶ 1、偏硅酸浓度为0.03 mol/L、酶添加量为0.16 mg/mL 时,固定化的效率最高。接着对固定化酶和游离酶的酶学性质进行了考察,结果发现:固定化酶和游离酶的最适pH都是9.0,最适温度都是45 ℃,而相对于游离酶,固定化酶在pH 9.0~10.0和温度35~50 ℃范围内稳定性更好。固定化酶的米氏常数为7.48 mmol/L,重复使用15次后,酶活力保持80%以上。说明仿生氧化硅制备的固定化苏氨酸脱氨酶具有酶活回收率高、力学强度高和操作稳定性好等优势。
氧化硅; 苏氨酸脱氨酶; 固定化; 酶学性质; 纳米材料
酶的固定化技术在生物制药领域有着广泛的应用,由于其能有效地保持酶的活性,增加酶的稳定性,许多药物中间体都是利用固定化酶来制备生产的,如1-苯乙醇、6-氨基青霉烷酸和L-2-氨基丁酸等[1]。在工业规模生产时,由于温度、pH、稳定性及力学强度的问题使得固定化酶的使用受到限制。近年来,纳米材料因其良好的生物相容性、比表面积大、载酶量突出、颗粒直径小和传质阻力小等优点而广泛应用于酶的固定化研究,同时,它通过改善酶的适应性和稳定性,使酶能持续高效地进行催化反应[2-3]。在纳米材料中研究最多的是通过仿生法制备SiO2为固定化载体的固定化技术[3]。这种方法通过模拟天然生物产生SiO2的过程,在温和条件(接近中性和20 ℃)下添加含胺类物质诱导氧化硅前体在体外快速产生SiO2颗粒,同时通过对制备过程的控制以获得形态粒径各异的SiO2载体。Betancor等[4]通过将乙酰胆碱酯酶包埋在仿生SiO2纳米颗粒中,所制得的固定化酶酶活回收率达100%,固定化效率90%,而且力学稳定性良好。Forsyth等[5]将脂肪酶包埋在偏硅酸缩合形成的SiO2颗粒中,提高了固定化酶的稳定性,且固定化效率接近100%。仿生法由于其制备条件温和、快速、低成本、易于控制以及对环境友好等特点比其他固定化方法具有优势,使得其在食品和制药工业上具有极大的应用前景[6-7]。
本研究中,笔者以苏氨酸脱氨酶作为仿生SiO2纳米颗粒的固定化对象,催化L-苏氨酸转化生产2-丁酮酸,且以磷酸吡哆醛(PLP)作为辅酶。利用扫描电子显微镜(SEM)表征固定化颗粒的形态特征,同时通过条件优化,考察仿生氧化硅固定化颗粒的催化活性、操作稳定性以及储存稳定性,以期为工业化应用提供数据。
1 材料与方法
1.1 材料与仪器
所用菌株为笔者所在实验室成员构建的E.coliBL21(DE3)/PET28b(+)-F168V;无水偏硅酸钠、三乙烯四胺(TETA),百灵威科技有限公司;L-Thr,阿拉丁公司。
恒温水浴摇床、磁力搅拌器,美国Crystal公司;X-22型冷冻高速离心机,美国Beckman Coulter公司;ME104E型电子天平,Mettler-Toledo仪器有限公司;TM-1000型电子扫描电镜(SEM),日本Hitachi公司。
1.2 实验方法
1.2.1 固定化酶的制备
1)游离苏氨酸脱氨酶的制备。从甘油管中取1 mL重组大肠杆菌菌液,接种于50 mL LB液体培养基(含50 μg/mL卡那霉素)中,37 ℃摇床培养8 h作为种子液;以1%的接种量将种子液接种于100 mL LB液体培养基中,37 ℃摇床培养,当菌体的OD600为0.6~0.8时,加入0.12 g/mL IPTG 20 μL,然后28 ℃摇床培养10 h,离心收集菌体,生理盐水洗涤菌体3次。取1 g湿菌体,悬浮于10 mL磷酸盐缓冲液(PBS)中(pH 8.0,0.2 mol/L),在冰浴中超声破碎10 min,破1 s停1 s,功率240 W,超声破碎后将破碎液在4 ℃、8 000 r/min条件下离心10 min,取上清液即得到粗酶液。
2)酶的固定化。用仿生氧化硅固定化酶的过程中,以无水偏硅酸钠作为SiO2制备的前体,三乙烯四胺(TETA)作为添加剂[5,8],以一定的比例将前体和添加剂混合,向溶液中滴加3 mol/L HCl溶液,使溶液pH为7.0±0.1。立即添加一定量的酶液,并将所得的溶液温和地混匀搅拌15 min,然后8 000 r/min离心5 min,弃上清液,用无菌水重复洗涤2次,即制得固定化苏氨酸脱氨酶。
1.2.2 固定化酶制备条件的优化
在以无水偏硅酸钠为前体、三乙烯四胺(TETA)为添加剂的条件下,考察不同的硅氮比(1∶ 0.25、1∶ 0.5、1∶ 1、1∶ 1.5和1∶ 2)对固定化酶的影响;设置偏硅酸浓度为0.01、0.02、0.03、0.04、0.05和0.06 mol/L这6个梯度,考察前体的浓度对固定化酶的影响;设置酶添加量为0.04、0.08、0.12、0.16、0.20和0.24 mg/mL,考察酶添加量对固定化酶的影响。实验固定化酶制备条件的优化均为单因素实验优化。
1.2.3 固定化酶的形态观察
固定化酶样品经过前处理后,真空冷冻干燥保存,然后将样品喷金涂膜后,在真空条件下利用电子扫描电镜(SEM)检测[9]。
1.2.4 酶活的测定
用游离苏氨酸脱氨酶和固定化苏氨酸脱氨酶对L-Thr进行催化反应,准确称取2 mL游离酶液(10 mg/mL)和2 mL游离酶相对应量的固定化酶加入摇瓶中,以反应减少的L-Thr来计算酶的活力。在37 ℃、450 r/min条件下反应10 min,用氨基酸分析仪检测底物L-Thr的减少量,计算酶活。
酶活定义:在37 ℃、pH 8.0条件下每分钟催化1 μmol的L-Thr所需的酶量定义为1 U。
相对酶活=固定化酶酶活/固定化酶的最高酶活×100%
(1)
酶活回收率=固定化酶的总活力/加入酶液的总活力×100%
(2)
1.2.5 分析方法
采用Sykam全自动氨基酸分析仪,建立氨基丁酸标准程序(25 min)。色谱柱为LCA k06/Na;流速和泵压为S4300模块0.25 mL/min、0.5 MPa,S2100模块0.45 mL/min、4 MPa;温度为57 ℃;检测波长为570 nm;进样体积为0.05 mL,稀释倍数2 500。
流动相配方Buffer A (1 L):柠檬酸钠11.8 g,柠檬酸6.0 g,苯酚0.5 g,辛酸0.1 mL,甲醇65 mL,37%HCl 5.6 mL;pH 3.45。
流动相配方Buffer B (1 L):柠檬酸钠19.6 g,硼酸5.0 g,NaOH 3.1 g,辛酸0.1 mL;pH 10.85。
再生液(1 L):NaOH 20 g。
氨基糖苷类,主要针对抵抗革兰阴性菌所致的感染,价格低廉适用范围广,在妇产科中得到广泛应用。但是各大医院治疗时,仍将β-内酰胺类抗菌药作为首选。
茚三酮混合液 (1 L):茚三酮20 g,苯酚2 g,甲醇600 mL,K-Na Buffer 400 mL,抗坏血酸0.2 g。其中,K-Na Buffer(1 L):乙酸200 mL,三乙酸钠272 g,乙酸钾196 g;pH 5.51。
测得底物L-Thr的峰面积以标准曲线y=37 791x+451.01,R2=0.994 06(x为L-苏氨酸的浓度(mol/L),y为570 nm处的峰面积)进行浓度转换。
2 结果与讨论
2.1 固定化条件的选择
2.1.1 添加剂浓度对固定化酶活的影响
在利用仿生法制备SiO2固定化载体的过程中,添加剂的浓度会影响SiO2颗粒的大小和形状,从而会对固定化酶的催化活力产生影响,因此考察添加剂浓度对固定化酶的影响,以硅氮比作为参考依据,硅酸浓度设为0.03 mol/L,设置不同摩尔比的硅氮比进行反应,结果如图1所示。由图1可知:当硅氮比低于1∶ 1时,固定化过程中形成的SiO2颗粒相对较小,其凝结程度相对较低,致使固定化颗粒的力学强度偏低;而当硅氮比高于1∶ 1时,SiO2颗粒的凝结程度增大,固定化颗粒更加致密,形成了较大的颗粒尺寸,抑制系统的传质效应使得底物难以进一步渗透到颗粒中,导致其相对酶活偏低。当硅氮比为1∶ 1时,固定化酶的相对酶活最高,此时固定化酶凝结强度与孔径大小达到平衡[10]。

图1 添加剂浓度对固定化酶的影响Fig.1 Effect of additive concentration on immobilized enzyme activity
2.1.2 偏硅酸浓度对固定化酶活的影响
偏硅酸在溶液中呈阴离子状态,而蛋白链在pH7.0条件下带正电荷,向pH 7.0的偏硅酸溶液中加入酶蛋白诱导偏硅酸发生缩合,并且附着在酶蛋白表面,将其包埋。此时溶液中的偏硅酸需要处于相对较低的浓度,避免SiO2之间自发凝聚,影响包埋效果[8]。考察偏硅酸浓度对固定化酶活的影响,结果如图2所示。由图2可知:当偏硅酸浓度为0.03 mol/L时,相对酶活最高,当偏硅酸浓度较低时,不能有效地将酶全部包埋,形成的SiO2颗粒相对较少,造成游离酶的利用率偏低;而当偏硅酸浓度大于0.03 mol/L时,SiO2之间会自发缩聚形成沉淀,使得偏硅酸的有效利用率降低,从而降低了固定化酶的相对酶活。
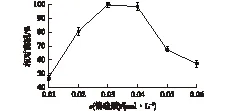
图2 偏硅酸钠浓度对固定化酶活的影响Fig.2 Effect of sodium metasilicate concentration on immobilized enzyme activity
2.1.3 酶添加量对固定化酶活的影响
纳米SiO2对于酶的承载能力是有一定限度的,添加的酶蛋白浓度过高会超过SiO2载体的包埋能力,导致酶蛋白的浪费。因此,考察酶蛋白浓度对固定化酶活的影响,结果如图3所示。由图3可知:当酶添加量为0.16 mg/mL时,固定化酶的相对酶活最高。当酶的添加量从0.04 mg/mL逐渐增加时,SiO2载体所包埋的酶量逐渐增加,其相对酶活也随之增加。当酶的添加量达到0.16 mg/mL时,载体的包埋限度达到最大,再继续添加酶蛋白,固定化酶的活力趋于稳定,不再继续上升。
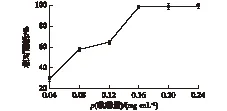
图3 酶添加量对固定化酶活的影响Fig.3 Effect of enzyme addition on immobilized activity
2.2 氧化硅固定化酶的表征
在利用偏硅酸形成SiO2沉淀的仿生学研究中,以三乙烯四胺(TETA)作为添加剂,在温和条件(pH=7.0,20 ℃)下加入酶蛋白诱导偏硅酸产生纳米级SiO2颗粒(这种添加剂可调节氧化硅表面积、粒度、孔隙率等性质)。利用扫描电子显微镜考察了空载体SiO2颗粒和包含苏氨酸脱氨酶的仿生SiO2纳米球的形态和粒度,结果如图4所示。由图4可知:包含酶的固定化SiO2颗粒相对于空载体颗粒结构更加致密,其在纳米级上成网状分布,平均直径为200 nm,属于大孔粒径(孔径>50 nm)[10],这种网状的大孔SiO2颗粒有利于保护酶的稳定性。

图4 空载体和固定化酶电镜照片Fig.4 SEM images of empty silica particles and immobilized threonine deaminase
2.3 固定化酶的酶学性质
2.3.1 固定化酶催化反应最适pH
调节反应体系的pH为7.0~11.0,称取一定量的固定化酶和游离酶进行催化反应,以酶活最高者为100%,考察固定化酶的最适pH,结果如图5所示。由图5可知,固定化酶和游离酶在pH 9.0时,相对酶活都是最高的。当pH从7.0逐渐趋近9.0时,相对酶活逐渐增大,且游离酶相对于固定化酶的适应性更强;当pH从9.0逐渐增大时,相对酶活逐渐降低,此时固定化酶的下降趋势比游离酶的趋势平缓。在pH为9.0~10.0时,固定化酶的相对酶活下降了3.67%,而游离酶下降了24.78%,这表明该酶被固定在载体上后可以明显提升对pH的耐受性,SiO2载体包埋酶可缓解高pH对酶分子的损害,这对工业化应用具有优势。

图5 pH对游离酶和固定化酶活力的影响Fig.5 Effects of pH on free enzyme and immobilized enzyme activity
2.3.2 固定化酶催化反应最适温度
在pH为9.0、底物浓度为0.5 mol/L的反应体系中,称取一定量的固定化酶和游离酶加入其中,考察固定化酶和游离酶的最适反应温度,以酶活最高者为100%,结果如图6所示。由图6可知:固定化酶和游离酶的相对酶活在45 ℃时,相对酶活都是最高的,当温度从30 ℃逐渐趋近45 ℃时,相对酶活逐渐增大,此时固定化酶相对于游离酶的适应性更高。当温度从45 ℃开始逐渐升高时,相对酶活逐渐降低,此时固定化酶的下降趋势相对游离酶更快。在温度为35~50 ℃时,固定化酶的相对酶活下降了8.8%,而游离酶则降低了26.36%,表明仿生SiO2载体为酶蛋白提供了稳定的微环境,避免了高温给酶分子带来的热变性,使得固定化酶的温度适应范围有所扩大。

图6 温度对游离酶和固定化酶活力的影响Fig.6 Effects of temperature on free enzyme and immobilized enzyme
2.3.3 固定化酶与游离酶的Km值比较
取浓度在0~2 mmol/L的L-Thr溶液10 mL,分别取0.2 g固定化酶和2 mL游离酶液(10 mg/mL),在45 ℃、pH 9.0条件下进行反应,测定L-Thr的减少量,按Lineweaver-Burk作图法求出游离酶和固定化酶的Km值和Vmax值,结果如图7所示。其中,v为表观初始反应速率,cs为底物浓度。由图7可知:游离酶的Km值为3.54 mmol/L,而固定化酶的Km值为7.48 mmol/L,表明固定化酶与底物的亲和力较游离酶小,因为酶经过SiO2颗粒的包埋后,使得酶与底物之间产生了空间隔离,由于空间隔离以及扩散阻力的影响,使得固定化酶的Km值较大。
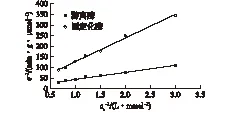
图7 游离酶和固定化酶的Lineweaver-Burk曲线Fig.7 Lineweaver-Burk curves of free enzyme and immobilized enzyme
2.3.4 固定酶辅酶PLP的添加量
PLP作为脱氨酶的辅酶,辅助脱氨酶脱去氨基,每个酶分子结合两分子的磷酸吡哆醛,大大提高了底物的转化效率[11-12]。在10 mL反应体系中,底物浓度为0.5 mol/L,固定化酶0.2 g,添加辅酶量在0~50 μmol/L时,考察辅酶PLP的添加量对固定化酶活的影响,结果如图8所示。由图8可知:当添加PLP浓度为0~30 μmol/L时,酶的催化活性迅速增加,其相对酶活增加了54.06%;当添加PLP浓度为30~50 μmol/L时,酶的催化活性增长速度放缓,其相对酶活增加了9.78%。这说明当PLP的浓度达到30 μmol/L时,苏氨酸脱氨酶结合辅酶的量已趋于饱和。

图8 添加辅酶PLP对固定化酶的影响Fig.8 Effect of coenzyme PLP on immobilized enzyme
2.3.5 固定化酶的操作稳定性研究
固定化酶的操作稳定性是很重要的一个参数,这直接关系到固定化酶能不能达到生产要求,设置实验反应体系:在pH 9.0、0.2 mol/L磷酸钠盐缓冲液体系中加入底物0.4 mol/L,固定化酶0.02 g/mL,PLP 100 μmol/L,45 ℃反应2 h。8 000 r/min离心5 min分离固定化酶,用pH 9.0、0.2 mol/L磷酸钠盐缓冲液洗涤后,再次加入0.4 mol/L底物,进行第二次反应。以此方式进行批次反应,每次反应结束后检测固定化酶的剩余酶活,直到剩余酶活降到80%以下,结果如图9所示。由图9可知:经过15次循环后,固定化酶的相对酶活保持在80%以上,表明经过SiO2包埋后的固定化酶对于温度和pH的稳定性有所提高,这可能由于酶被限制在微小的空间内,SiO2载体对于酶的空间结构有一定的支持作用,使得酶不容易变性[13]。另外,在pH保持稳定的情况下,苏氨酸脱氨酶与SiO2以及结合在SiO2里的胺相互作用,从而为苏氨酸脱氨酶提供了有利的微环境,减少了环境对酶的影响。同时,实验结果说明PLP能够被纳米SiO2固定化颗粒吸附,使其能够重复利用。在实验检测过程中相对酶活的降低,部分原因可归结于离心和固定化酶转移的因素。

图9 固定化酶的操作稳定性Fig.9 Operational stability of immobilized enzyme
2.3.6 储存稳定性
为了考察固定化酶的稳定性,将固定化酶和游离酶保存在4 ℃冰箱内。每隔2 d取出相同质量的固定化酶,在pH 9.0、0.2 mol/L磷酸钠盐缓冲液及45 ℃条件下测其酶活,以游离酶和固定化酶的酶活最高者为100%,结果如图10所示。由图10可知:游离酶在储存了6 d后酶活仅保留了51.5%,而固定化酶的相对酶活仍有89.4 %,储存10 d后其剩余酶活在85%以上。这说明氧化硅固定化苏氨酸脱氨酶其储存稳定性有了明显提高,此结果与Coradin等[8]的结果一致,使得此固定化方法在工业上应用具有很大的潜力。

图10 固定化酶和游离酶的储存稳定性Fig.10 Storage stability of immobilized enzyme and free enzyme
3 结论
1)通过仿生SiO2固定化方法,优化了固定化过程的3个重要参数,确定了偏硅酸的最适浓度为0.03 mol/L,添加剂的添加比例为n(Si)∶n(N)=1∶ 1,酶添加量为0.16 mg/mL,此时固定化的效果最好,固定化酶活回收率93.6%,说明仿生硅载体是固定化苏氨酸脱氨酶的良好载体。
2)固定化酶与游离酶相比,其适应性和稳定性得到改善。固定化酶的Km为7.48 mmol/L,比游离酶有所升高。在重复使用15批后,其相对酶活保持在80%以上,而且在4 ℃储存了10 d以后剩余酶活保持在85%以上,说明固定化酶具有优良的操作稳定性和储存稳定性。
采用仿生法制备SiO2对酶蛋白进行包埋的固定化方法,制备过程温和,设备要求简单,对环境友好,具有潜在的工业应用价值。
[1] 李兴.酶法合成L-2-氨基丁酸及酶的固定化研究[D].上海:华东理工大学,2013.
[2] 高启禹,徐光翠,陈红丽,等.纳米材料固定化酶的研究进展[J].生物技术通报,2013,34(6):20-24.
[3] BRUNNER E,LUTZ K,SUMPER M.Biomimetic synthesis of silica nanospheres depends on the aggregation and phase separation of polyamines in aqueous solution[J].Phys Chem Chem Phys,2004,6(4):854-857.
[4] BETANCOR L,LUCKARIFT H R.Bioinspired enzyme encapsulation for biocatalysis[J].Trends Biotechnol,2008,26(10):566-572.
[5] FORSYTH C,PATWARDHAN S V.Controlling performance of lipase immobilised on bioinspired silica[J].J Mat Chem B,2013,1(8):1164-1174.
[6] SWARTZ J D,MILLER S A,WRIGHT D.Rapid Production of nitrilase containing silica nanoparticles offers an effective and reusable biocatalyst for synthetic nitrile hydrolysis[J].Org Process Res Dev,2009,13(3):584-589.
[7] 李林.仿生氧化硅凝胶固定化β-D-葡萄糖醛酸苷酶的研究[D].天津:天津大学,2008.
[8] CORADIN T,LIVAGE J.Synthesis,characterization and diffusion properties of biomimetic silica-coated gelatine beads[J].Mat Sci Eng C,2005,25(2):201-205.
[9] 侯红萍,张茜.介孔分子筛SBA-15固定糖化酶的研究[J].中国食品学报,2011,11(2):147-151.
[10] LUCKARIFT H R,SPAIN J C,NAIK R R,et al.Enzyme immobilization in a biomimetic silica support[J].Nature Biotechnol,2004,22(2):211-213.
[11] 唐任天,郭永复,陈琦.L-缬氨酸生物合成调节机制的初步研究[J].生物化学与生物物理学报(英文版),1984(5):70-78.
[12] EISENSTEIN E.Cloning,expression,purification,and characterization of biosynthetic threonine deaminase fromEscherichiacoli[J].J Biol Chem,1991,266(9):5801-5807.
[13] ZHOU L,WANG C,JIANG Y,et al.Immobilization of papain in biosilica matrix and its catalytic property[J].Chin J Chem Eng,2013,21(6):670-675.
(责任编辑 荀志金)
Preparation of silica carrier immobilized threonine deaminase bybionic method and its enzymatic properties
LI Qiaoli,ZHAO Zhe,XU Jianmiao
(College of Biotechnology and Bioengineering,Zhejiang University of Technology,Hangzhou 310014,China)
The inorganic silica carrier was prepared by coprecipitation and used to immobilize threonine deaminase. The silica carrier was characterized by scanning electron microscopy.Then immobilization conditions were optimized withn(Si)∶n(N) at 1∶ 1,the concentration of silicic acid at 0.03 mol/L,the amount of enzyme at 0.16 mg/mL.The optimal pH of the immobilized enzyme and the free enzyme was both 9.0,the optimal temperature was 45 ℃.Furthermore,the immobilized enzyme was more stable than the free enzyme under the conditions of pH between 9.0 and 10.0,and temperature between 35 and 50 ℃.TheKmvalue of the immobilized enzyme was 7.48 mmol/L,and the enzyme activity was maintained at 80% after 15 times of repeated application.The results suggested that the immobilized threonine deaminase prepared by bionic silica has high activity recovery,high mechanical strength and stable operation conditions.
silica; threonine deaminase; immobilization; enzymatic properties; nano materials
10.3969/j.issn.1672-3678.2017.03.003
2017-02-08
浙江省公益性项目(2017C33157)
李巧丽(1991—),女,湖北孝感人,研究方向:生物化工;徐建妙(联系人),高级工程师,E-mail:xujianmiao@zjut.edu.cn
Q814.2
A
1672-3678(2017)03-0012-06

