海洋细菌有机磷酸酐水解酶在大肠杆菌中的分泌表达研究
肖运柱,杨 键,张 偲,龙丽娟
(1.中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室RNAM海洋微生物中心广东省海洋药物重点实验室,广东广州510301;2.中国科学院大学,北京100049)
海洋细菌有机磷酸酐水解酶在大肠杆菌中的分泌表达研究
肖运柱1,2,杨 键1,2,张 偲1,2,龙丽娟1,2
(1.中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室RNAM海洋微生物中心广东省海洋药物重点实验室,广东广州510301;2.中国科学院大学,北京100049)
为了考察一种海洋细菌来源的有机磷酸酐水解酶OPAA4301在大肠杆菌中胞外分泌表达生产的可能性,笔者分别从信号肽和发酵条件两方面对该酶在大肠杆菌中的产量及细胞定位情况进行观测和优化。结果发现,海洋细菌有机磷酸酐水解酶OPAA4301在大肠杆菌中可不依赖信号肽少量分泌至培养基上清中。以胞外酶产量为指标,对诱导剂和甘氨酸添加量进行优化,确定适宜的诱导剂浓度为0.8 mmol/L,适宜甘氨酸添加量为10 g/L。在优化条件下,重组酶蛋白的细胞定位主要由细胞内转变为细胞外,胞外酶活提高108.8倍,达0.28 U/mL,相当于重组蛋白胞外生产能力为0.72 g/L。本研究为重组海洋细菌有机磷酸酐酶的工程化发酵生产提供理论基础。
海洋细菌;有机磷酸酐水解酶;蛋白质分泌表达;大肠杆菌;甘氨酸
有机磷化合物是一类含有碳-磷键或磷酸的有机衍生物,其中以磷酸酯或磷酸硫醇类化合物最常见,该类化合物能特异性磷酸化乙酰胆碱酯酶活性中心的丝氨酸,对生物体具有急性毒性效应[1]。有机磷化合物广泛应用于杀虫剂、阻燃剂、增塑剂和石油添加剂等领域,由于大规模的生产和应用,在水体、土壤、食物、空气和近岸海洋等区域都能检测到有机磷化合物残留,它已成为全球主要有机污染物之一[2-3]。环境微生物已进化出多种可降解有机磷化合物的酶,这类酶可催化水解有机磷化合物中磷酸三酯键,从而将有机磷化合物转化成无毒或毒性较小的物质,具有生态修复应用前景[4]。有机磷酸酐水解酶(EC 3.1.8.2)是微生物生产的主要有机磷降解酶源之一,已报道的有机磷酸酐水解酶主要分离自嗜盐细菌Alteromonas属,可以水解有机磷神经毒剂沙林(sarin)、索曼(soman)和塔崩(tabun)等,并且能催化水解有机磷化合物的P-F、P-O和P-CN键[5-8]。
大肠杆菌是酶蛋白表达首选异源宿主之一。相较于其他物种宿主,大肠杆菌生产重组蛋白一般产量高,容易实现异源蛋白的超表达。然而,大肠杆菌主要以生产胞内蛋白为主,且存在形成无活性包涵体、存在内毒素及分离成本高等问题。实现大肠杆菌胞外生产重组蛋白可在多方面弥补大肠杆菌表达系统现存的不足[9]:可减少胞内蛋白酶对重组蛋白的降解作用[10];在分泌胞外的过程中可促进重组蛋白的正确折叠,减少包涵体的产生[11];还可以大幅降低重组蛋白生产下游分离纯化成本。目前,常用的大肠杆菌胞外分泌表达重组蛋白的手段主要包括两个方面,一是在蛋白N端插入信号肽序列,通过经典分泌途径如Sec系统、Tat系统等,将重组蛋白泵出细胞质[12];二是在发酵培养基中添加提高细胞膜通透性的物质,如蔗糖、Triton X-100和甘氨酸等,促进重组蛋白的释放[13]。
笔者前期从南海沉积物细菌Pseudoalteromonassp.SCSIO 04301中鉴定了一条可编码有机磷酸酐水解酶活性的基因opaa4301,确定该基因催化水解有机磷化合物的功能由古老肽酶家族蛋白进化而来,纯酶催化水解对氧磷的比活力为0.39 U/mg[14]。
本研究中,笔者侧重探讨该基因在大肠杆菌中的异源分泌表达,以期为该酶的工程化生产提供理论基础。
1 材料和方法
1.1 材料
1.1.1 菌种与质粒
菌株Pseudoalteromonassp.SCSIO 04301,克隆宿主EscherichiacoliTOP10、表达宿主E.coliRosseta(DE3)、表达载体pET-22b(+)均保藏于热带海洋生物资源与生态重点实验室。
1.1.2 主要试剂、培养基
细菌基因组和质粒小提试剂盒,天根生化科技有限公司;蛋白电泳试剂、蛋白分子量标准和氨苄青霉素钠,上海生工生物工程股份有限公司;蛋白胨和酵母提取物,英国Oxoid 公司;EasyTaq® PCR SuperMix DNA聚合酶、TransStart® FastpfuDNA聚合酶和pEASY-Uni Seamless Cloning and Assembly Kit,北京全式金生物技术有限公司;其他试剂为市售国产分析纯。
引物委托上海生工生物工程股份有限公司合成。
LB培养基(g/L):蛋白胨 10.0,酵母粉 5.0,NaCl 10.0。
1.2 表达载体的构建
以Pseudoalteromonassp.SCSIO 04301基因组DNA为模板,分别使用两对引物22bOPAA4301-F:GAAGGAGATATACATATGGATAAATTAGCGGTGTT、22bOPAA4301-R:GTGGTGGTGGTGGTGATCTAAGTGTAGATCACGGGTCATA;22bSPOPAA4301-F:GAAGGAGATATACATATGAAATACCTGCTGCCGAC、22bSPOPAA4301-R:GTGGTGGTGGTGGTGATCTAAGTGTAGATCACGGGTCATA扩增Pseudoalteromonassp.SCSIO 04301中有机磷酸酐水解酶基因opaa4301,下划线部分为同源臂序列,用于与载体片段进行无缝连接。以pET-22b(+)质粒为模板,使用引物22b-F(CACCACCACCACCACCACTGAGAT)/22b-R(ATGTATATCTCCTTCTTAAAG)和22bSP-F(CACCACCACCACCACCACTGAGAT)/22bSP-R(ATGTATATCTCCTTCTTAAAGTTAAACA)反向扩增质粒pET-22b(+)获得线性载体片段pLET-22b(去除信号肽)和pLET-22bSP(包含信号肽)。PCR反应均使用高保真DNA聚合酶,扩增程序:95 ℃ 10 min;94 ℃ 30 s,50 ℃ 45 s,72 ℃ 1 kb/30 s,32个循环;72 ℃ 10 min。PCR产物经过1%琼脂糖凝胶电泳检测,并切胶回收目的片段。
扩增获得的具有同源臂有机磷酸酐水解酶基因opaa4301分别与线性载体进行无缝连接,构建重组质粒分别命名为pET22b-opaa4301和pET22bSP-opaa4301,如图1所示。无缝连接反应体系:2×Assembly Mix 5.0 μL,目的片段1.0 μL,线性载体3.0 μL,双蒸水1.0 μL。50 ℃水浴保温15 min后将反应液置于冰上冷却数秒。连接产物直接用于转化至E.coliTOP10细胞,氨苄青霉素抗性平板筛选,挑取转化子进行PCR筛选及基因测序验证。

图1 重组载体构建示意图Fig.1 Schematic diagram for the recombinant plasmids construction
1.3 基因opaa4301在大肠杆菌中的诱导表达
将构建好的重组质粒pET22b-opaa4301和pET22bSP-opaa4301转化至表达宿主E.coliRosseta(DE3)。将重组菌在直形瓶中37 ℃、180 r/min振荡培养过夜,以1%的接种量转接至100 mL新鲜LB液体培养基(含50 μg/mL氨苄青霉素)中。在37 ℃、180 r/min摇床中剧烈振荡培养2~3 h至OD600达到0.6时,加入IPTG至终浓度为0.1 mmol/L,降温至25 ℃,180 r/min摇床继续振荡培养48 h。每隔8 h检测有机磷酸酐水解酶胞内、胞外酶活力,并进行蛋白胶检测。
1.4 SDS-PAGE分析重组蛋白定位
取2.0 mL发酵8 h的发酵液,5 000 r/min、4 ℃离心20 min。获得发酵上清液和细胞沉淀。发酵上清液过0.45 μm滤膜,加入三氯乙酸至终质量分数为10%,4 ℃沉淀过夜后10 000 r/min、4 ℃离心30 min收集沉淀,冰冻预冷的丙酮洗涤沉淀重复3次。收集沉淀于40 ℃烘干,即得胞外总蛋白。细胞沉淀用50 mmol/L Tris-HCl (pH 8.5)缓冲液重悬,冰上放置预冷20 min,超声破碎后12 000 r/min离心5 min,获得胞内上清和不溶细胞沉淀。
上述胞外总蛋白和不溶细胞沉淀使用少量8 mol/L尿素助溶后加入50 μL 50 mmol/L Tris-HCl (pH 8.5)缓冲液。取各细胞组分溶液20 μL,加入5 μL 的上样缓冲液,沸水处理10 min,12 000 r/min离心5 min,取上清进行SDS-PAGE电泳分析,分离胶浓度为12%,浓缩胶浓度为5%,考马斯亮蓝R-250染料染色。
1.5 酶活测定
通过测定有机磷酸酐水解酶水解对氧磷生成对硝基苯酚的量来检测酶活性[15]。取稀释适当倍数的酶液25 μL,加入200 μL 50 mmol/L甘氨酸-NaOH缓冲液(pH 8.5)和25 μL 5 mmol/L对氧磷母液(溶于丙酮),反应体系为250 μL。55 ℃水浴40 min,迅速放入沸水浴中终止反应。12 000 r/min离心上述反应液5 min,取200 μL上清液在405 nm波长下测定吸光值。对照管的处理以同样量的甘氨酸-NaOH缓冲溶液取代酶液,其余操作与测定管相同。有机磷酸酐水解酶酶活力单位(U)定义:在55 ℃、pH 8.5的条件下,每分钟水解1.0 μmol底物即产生1.0 μmol对硝基苯酚所需要的酶量。有机磷酸酐水解酶酶活力计算见式(1)。
有机磷酸酐水解酶酶活力=
(1)
式中:A405为反应液405 nm吸光值;0.000 7为对硝基苯酚标准曲线截距;250为反应总体积(μL);N为酶液稀释倍数;0.010 5为对硝基苯酚标准曲线斜率;1 000为单位换算倍数;25为吸取酶液的体积(μL);t为反应时间(min)。
1.6 发酵条件对重组菌产酶性能的影响
1.6.1 IPTG浓度对产酶性能的影响
将构建好的不含信号肽的重组菌株E.coliRosseta (DE3)-pET22b-opaa4301接种到含50 μg/mL氨苄青霉素的LB培养基中,37 ℃、180 r/min过夜培养得种子液。种子培养液按1%接种量转接至50 mL新鲜LB培养基的摇瓶中,37 ℃培养至OD600为0.6,分别加入不同浓度的IPTG(终浓度0、0.2、0.4、0.6、0.8、1.0和1.2 mmol/L)诱导,25 ℃条件下继续培养24 h。测定菌悬液的OD600、有机磷酸酐水解胞内酶活及胞外酶活。
1.6.2 甘氨酸添加对产酶性能的影响
将不含信号肽的重组菌株E.coliRosseta (DE3)-pET22b-opaa4301的种子液按1%接种量接种到50 mL LB培养基(含氨苄青霉素终质量浓度50 μg/mL)中,37 ℃培养至OD600为0.6时,添加不同浓度的甘氨酸(0、5、10、15、20、25和30 g/L),继续37 ℃培养2 h,然后加入IPTG至终浓度为0.8 mmol/L,于25 ℃、180 r/min摇床中继续振荡培养24 h,测定菌液的OD600、有机磷酸酐水解酶总酶活及胞外酶活。
2 结果与讨论
2.1 有机磷降解酶OPAA4301的胞外分泌表达不依赖信号肽的引导
利用SignalP 4.0 server (http://www.cbs.dtu.dk/services/SignalP/)对海洋细菌Pseudoalteromonassp. SCSIO 04301来源的有机磷酸酐水解酶OPAA4301进行信号肽预测,根据预测结果推测该酶N端不存在可引导蛋白分泌的氨基酸序列。为了实现该酶的异源分泌表达,考察在其N端添加信号肽对其分泌效应的影响,分别构建OPAA4301融合与不融合PelB信号肽的重组表达载体pET22bSP-opaa4301和pET22b-opaa4301,并转入大肠杆菌中诱导表达。在0.1 mmol/L IPTG诱导8 h后,分别取发酵液上清和细胞裂解液,以对氧磷为底物检测酶活力,结果如图2所示。由图2可知:重组有机磷酸酐水解酶OPAA4301主要以胞内酶形式表达,N端融合PelB信号肽会使重组酶的表达量下降,总酶活(22bOPAA4301-T)(胞内酶活与胞外酶活(E)之和)从0.40 U/mL下降为0.22 U/mL。携带信号肽序列的有机磷酸酐水解酶OPAA4301未能分泌至大肠杆菌细胞外,而N端未融合信号肽的有机磷水解酶反而能在大肠杆菌中实现分泌表达,其胞外酶活力为2.37×10-4U/mL。这种不通过信号肽实现重组蛋白在大肠杆菌胞外分泌是十分罕见的,与文献[16]报道的带信号肽的重组菌胞外都能分泌重组酶,而不带信号肽的重组质粒菌胞外检测不到酶活,这样的结论不同。
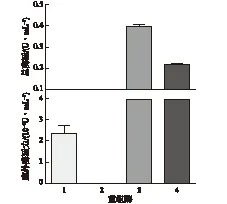
1—22bOPAA4301-E;2—22bSPOPAA4301-E;3—22bOPAA4301-T;4—22bSPOPAA4301-T图2 重组酶活性分布情况Fig.2 Distribution of recombinant enzyme activity
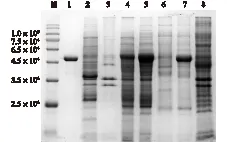
M—标准蛋白;1—NTA-Ni 纯化后OPAA4301蛋白;2—22bSPOPAA4301胞内不溶性蛋白;3—22bOPAA4301胞内不溶性蛋白;4—22bSPOPAA4301胞内可溶性蛋白;5—22bPOPAA43011胞内可溶性蛋白;6—22bSPOPAA4301发酵液上清;7—22bOPAA4301发酵液上清;8—含pET22b的E.coli Rosseta (DE3)全细胞蛋白图3 重组菌株发酵上清、胞内上清及胞内不溶物的 SDS-PAGE分析Fig.3 SDS-PAGE analysis of fermentation supernatant, intracellular supernatant and intracellular insoluble protein
2.2 SDS-PAGE分析确定重组酶OPAA4301的细胞定位
对诱导表达获得的重组菌22bOPAA4301和22bSPOPAA4301发酵上清液、胞内上清液和胞内不溶物进行SDS-PAGE分析,结果如图3所示。由图3可知,无信号肽重组菌发酵胞外上清在约5.0×104处存在重组酶的特异性条带(第7孔道),而含有信号肽的重组菌发酵上清液中没有发现该现象,说明无信号肽重组菌发酵8 h后可以把重组酶分泌到胞外,而有信号肽的重组菌在对应位置无明显蛋白条带。SDS-PAGE分析结果与前述酶活测定结果一致,证实重组大肠杆菌22bOPAA4301可在无信号肽引导的情况下分泌有机磷酸酐水解酶OPAA4301至细胞外。这种分泌机制有可能是细胞内的重组蛋白发生非特异性渗漏到达细胞外,细胞的非特异性渗漏对重组蛋白的胞外分泌是非常重要的。造成重组蛋白渗漏的原因可能是:在培养过程中由于细胞分裂导致重组蛋白渗漏[17];重组蛋白在细胞内大量积累导致胞内形成高渗透压,从而产生跨外膜驱动力[18];重组蛋白的产生导致细胞膜产生混乱,从而影响了细胞膜的选择渗透性,并可能引起细胞破裂[19-20]。此外,无信号肽和有信号肽的重组菌胞内不溶物的SDS-PAGE图谱上都没有特异性条带(第2、3孔道),说明重组菌在发酵过程中几乎不形成由于错误折叠而形成的不溶性包涵体。
2.3 重组菌产有机磷酸酐水解酶的发酵条件优化
2.3.1 诱导剂IPTG添加浓度对产酶性能的影响
前面的实验结果表明,有机磷酸酐水解酶OPAA4301基因在大肠杆菌中异源表达时,其N端不添加信号肽序列不仅总表达量较高,还能使一部分的重组酶分泌至细胞外。为了考察发酵条件的改变能否进一步提高胞外重组酶的产量,本部分从诱导剂和甘氨酸的添加两方面对发酵培养基成分进行优化。
发酵培养基中分别添加不同终浓度的IPTG(0~1.2 mmol/L),25 ℃诱导培养24 h,考察IPTG浓度对重组菌产重组酶22bOPAA4301酶活力的影响,结果如图4所示。由图4可知:在不添加IPTG的情况下,重组菌的表达存在微量泄露。随着诱导剂IPTG浓度的增加,重组菌对有机磷酸酐水解酶基因的表达量逐渐上升;当IPTG浓度为0.8 mmol/L时,胞外酶活达到最高为2.64×10-3U/mL;IPTG浓度为1.0 mmol/L时,胞内酶活达到最高为0.66 U/mL;当IPTG浓度高于1.0 mmol/L时,大肠杆菌对重组酶的表达量有下降趋势,可能是因为高浓度的IPTG对细胞具有一定毒性,会影响大肠杆菌正常生长繁殖和代谢功能,从而导致重组酶的表达下调[21]。
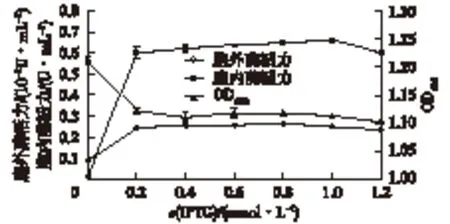
图4 IPTG浓度对重组大肠杆菌胞外酶活、 胞内酶活和细胞浓度的影响Fig.4 Effects of IPTG concentration on the extracellular enzyme activity,intracellular enzyme activity and cell concentration of recombinant strain

图5 甘氨酸浓度对重组菌胞外酶活、 总酶活和细胞浓度的影响Fig.5 Effects of glycine concentration on the extracellular enzyme activity,total enzyme activity and cell concentration of recombinant strain
2.3.2 甘氨酸浓度对有机磷酸酐水解酶酶活的影响
在大肠杆菌发酵表达重组酶的过程中,向培养基添加能够改变细胞膜通透性的化学物质,如Mg2+、Ca2+、EDTA、甘氨酸和Triton X-100等,能促进重组酶透过细菌双层膜向胞外分泌[9,22],其中,以甘氨酸促进大肠杆菌分泌表达的报道最为常见。在发酵培养基中添加不同浓度的甘氨酸,考察其对重组菌株分泌表达有机磷酸酐水解酶的影响,结果如图5所示。由图5可知:甘氨酸的添加可显著促进重组酶在大肠杆菌中的胞外分泌,当甘氨酸为10 g/L时,在诱导24 h后,培养基上清中有机磷酸酐水解酶酶活达到0.28 U/mL(相当于重组酶的分泌表达产量达0.72 g/L),比没有添加甘氨酸条件下的胞外酶活提高108.8倍,且胞外重组蛋白占总重组酶表达量的近80%。添加甘氨酸能促进重组蛋白分泌,但会降低细胞浓度,10 g/L的甘氨酸添加量可使细胞浓度下降近1倍,且随着甘氨酸浓度的增加,发酵液中细胞浓度会进一步降低。低浓度的甘氨酸可以作为一种营养物质,促进重组酶的合成及细菌的生长繁殖,而当甘氨酸浓度过高,细胞膜通透性增加超过细菌承载能力,降低了细胞膜对细胞的保护作用,表现为细胞浓度的迅速下降[23-25]。刘军彤等[26]研究了甘氨酸浓度对蔗糖异构酶胞外酶活和总酶活的影响,发现补加甘氨酸质量浓度为5 g/L时,蔗糖异构酶的总酶活和胞外酶活最高;当补加甘氨酸质量浓度为10 g/L时,蔗糖异构酶的分泌效率最高,但细胞生长受到明显影响。
3 结论
本研究首次报道海洋细菌Pseudoalteromonassp.SCSIO 04301来源的有机磷酸酐水解酶可在大肠杆菌中不依赖信号肽直接分泌至发酵液中,同时通过发酵条件的优化将重组酶以胞内表达为主转变为以胞外表达为主,胞外重组蛋白产量提高108.8倍,胞外酶蛋白生产能力达0.72 g/L。今后的研究将集中在两方面,一是对重组蛋白分泌机理的深入探讨。在大肠杆菌中通过不依赖经典分泌系统的途径实现胞外分泌较为罕见,本文研究的有机磷酸酐水解酶是一种兼具酯酶和肽酶活性的多功能酶,是否该酶还能破坏大肠杆菌的细胞膜、细胞壁这有待更严谨的实验证实。二是进一步优化发酵工艺。本文仅从诱导剂和甘氨酸添加两个方面对发酵培养基进行优化,实现胞外重组蛋白生产能力已经大幅提高,我们认为该酶的产量还有进一步提高的空间。优化发酵过程的其他参数,并进行上罐实验,期望重组蛋白的胞外产量达克级以上水平。
[1] SUZUKI H,TOMIZAWA M,ITO Y,et al.A potential target for organophosphate insecticides leading to spermatotoxicity[J].J Agric Food Chem,2013,61(41):9961-9965.
[2] DRAGUN J,KUFFNER A C,SCHNEITER R W.Groundwater contamination:1.transport and transformations of organic chemicals[J].Chem Eng,1984,91:65-70.
[3] SINGH B K.Organophosphorus-degrading bacteria:ecology and industrial applications[J].Nat Rev Microbiol,2009,7(2):156-164.
[4] SINGH B K,WALKER A.Microbial degradation of organo-phosphorus compounds[J].FEMS Microbiol Rev,2006,30(3):428-471.
[5] CHENG T C,DEFRANK J J,RASTOGI V K.Alteromonasprolidase for organophosphorus G-agent decontamination[J].Chem Biol Interact,1999,119:455-462.
[6] CHENG T C,RASTOGI V K,DEFRANK J J,et al.G-type nerve agent decontamination byAlteromonasprolidase[J].Ann NY Acad Sci,1998,864(1):253-258.
[8] KITCHENER R L,GRUNDEN A M.Prolidase function in proline metabolism and its medical and biotechnological applications[J].J Appl Microbiol,2012,113(2):233-247.
[9] CHOI J H,LEE S Y.Secretory and extracellular production of recombinant proteins usingEscherichiacoli[J].Appl Microbiol Biotechnol,2004,64(5):625-635.
[10] 任增亮,堵国成,陈坚,等.大肠杆菌高效表达重组蛋白策略[J].中国生物工程杂志,2007,27(9):103-109.
[11] 钟向阳,石歆莹,周宏灏.外源蛋白在大肠杆菌中的表达定位策略[J].生物工程进展,2001,21(6):50-53.
[12] 王光强.枯草芽孢杆菌中Sec分泌途径底物特性及非经典分泌途径的研究[D].无锡:江南大学,2013.
[13] 李彬.软化芽孢杆菌α-环糊精葡萄糖基转移酶在大肠杆菌中胞外分泌的优化[D].无锡:江南大学,2010.
[14] XIAO Y Z,YANG J,TIAN X P,et al.Biochemical basis for hydrolysis of organophosphorus by a marine bacterial prolidase[J].Process Biochem,2017,52:141-148.
[15] HIBLOT J,GOTTHARD G,CHABRIERE E,et al.Characterisation of the organophosphate hydrolase catalytic activity of SsoPox[J].Sci Rep(UK),2012,2:779.
[16] 蔡海松,林晓栩,郭永华,等.信号肽及化学通透剂对环糊精葡萄糖基转移酶胞外分泌的影响[J/OL].[2017-02-04].http://www.cnki.net/kcms/detail/11.1996.Q.20160907.1459.002.html.
[17] MERGULHAO F J M,TAIPA M A,CABRAL J M S,et al.Evaluation of bottlenecks in proinsulin secretion byEscherichiacoli[J].J Biotechnol,2004,109(1):31-43.
[18] HASENWINKLE D,JERVIS E,KOPS O,et al.Very high-level production and export inEscherichiacoliof a cellulose binding domain for use in a generic secretion-affinity fusion system[J].Biotechnol Bioeng,1997,55(6):854-863.
[19] PUGSLEY A P,FRANCETIC O,POSSOT O M,et al.Recent progress and future directions in studies of the main terminal branch of the general secretory pathway in gram-negative bacteria:a review[J].Gene,1997,192(1):13-19.
[20] SLOS P,SPECK D,ACCART N,et al.Recombinant cholera toxin B-subunit inEscherichiacoli:high-level secretion,purification,and characterization[J].Protein Expr Purif,1994,5(5):518-526.
[21] 周晓玲,张娟,陈坚,等.双歧杆菌胆盐水解酶基因的重组表达、纯化与酶学性质[J].食品与生物技术学报,2016,35(8):792-800.
[22] TANG J,YANG H,SONG S,et al.Effect of glycine and Triton X-100 on secretion and expression of ZZ-EGFP fusion protein[J].Food Chem,2008,108(2):657-662.
[23] CHENG J,WU D,CHEN S,et al.High-level extracellular production of α-cyclodextrin glycosyltransferase with recombinantEscherichiacoliBL21 (DE3)[J].J Agric Food Chem,2011,59(8):3797-3802.
[24] ZOU C,DUAN X,WU J.Enhanced extracellular production of recombinantBacillusderamificanspullulanase inEscherichiacolithrough induction mode optimization and a glycine feeding strategy[J].Bioresour Technol,2014,172:174-179.
[25] 苏平安,王莹,李尚勇,等.κ-卡拉胶酶CgkX高效重组表达菌株的构建和发酵优化[J].中国海洋药物,2015,34(4):1-6.
[26] 刘军彤,吴敬,陈晟.分散泛菌蔗糖异构酶在大肠杆菌中的表达及发酵优化[J].生物工程学报,2016,32(8):1070-1080.
(责任编辑 管珺)
Expression of a marine bacterial organophosphorusacid anhydrolase inEscherichiacoli
XIAO Yunzhu1,2,YANG Jian1,2,ZHANG Si1,2,LONG Lijuan1,2
(1.Guangdong Key Laboratory of Marine Materia Medica,RNAM Center for Marine Microbiology,CAS Key Laboratory of Tropical Marine Bio-Resources and Ecology,South China Sea Institute of Oceanology,Chinese Academy of Sciences,Guangzhou 510301,China; 2.University of the Chinese Academy of Sciences,Beijing 100049,China)
To realize the expression of recombinant marine bacterial organophosphorus acid anhydrolase OPAA4301 inEscherichiacoli,we optimized fermentation production.Two factors,signal peptide and culture condition,were assumed critical in secretion of recombinant enzymes.Our results showed that detectable organophosphorus acid hydrolase was found in the culture supernatant of recombinantE.coliconstructed without signal peptide at the N-terminal of the enzyme.Using the secretory expression level as target,we studied the effects of supplementation of inducer and glycine.The optimized concentrations of inducer and glycine were determined to be 0.8 mmol/L and 10 g/L.Under the optimized conditions,the cellular localization of recombinant enzyme was converted from intracellular to extracellular,and the extracellular enzyme expression level improved by 108.8 folds.The maximum extracellular enzyme activity reached 0.28 U/mL,which is the equivalent of 0.72 g/L for the production capacity of recombinant enzyme.Our study can provide theoretical basis for producing recombinant marine bacterial organophosphorus acid anhydrolase.
marine bacterial; organophosphorus acid anhydrolase; protein secretion and expression;Escherichiacoli; glycine
10.3969/j.issn.1672-3678.2017.03.001
2017-02-05
国家自然科学基金青年基金(41406193);广东海洋经济创新发展区域示范项目(GD2012-D01-002);中科院战略性先导科技专项(XDA10030404、XDA13020301)
肖运柱(1988—),男,江西吉安人,博士研究生,研究方向:海洋生物学;龙丽娟(联系人),研究员,E-mail:longlj@scsio.ac.cn.
Q851
A
1672-3678(2017)03-0001-06

