植物乳杆菌YM-2菌株胞外多糖生物合成工艺优化
司天昭,柳陈坚,秦晓萌,李晓然,罗义勇,杨 恩
植物乳杆菌YM-2菌株胞外多糖生物合成工艺优化
司天昭,柳陈坚,秦晓萌,李晓然,罗义勇,杨 恩*
(昆明理工大学生命科学与技术学院,云南 昆明 650500)
对从云南传统发酵豆豉分离得到的植物乳杆菌YM-2(Lactobacillus plantarum YM-2)菌株胞外多糖(exopolysaccharide,EPS)生物合成条件进行优化。首先对培养基成分中的碳源、氮源种类进行筛选;然后利用单因素试验分析碳源含量、氮源含量、培养时间以及培养温度对EPS产量的影响;最后采用Box-Behnken法进行四因素三水平响应面分析以确定其最优工艺条件。结果表明,植物乳杆菌YM-2菌株生物合成EPS最佳条件为碳源(葡萄糖)含量30 g/L、氮源(酵母粉)含量30 g/L、培养时间30.05 h、培养温度36.36 ℃,在此工艺条件下,植物乳杆菌YM-2 EPS产量为257.362 mg/L。
植物乳杆菌;胞外多糖;条件优化;响应面法
乳酸菌利用的历史悠久,是一种公认的安全型微生物。当前乳酸菌在食品行业中应用广泛,与人体健康关系密切[1]。乳酸菌胞外多糖(exopolysaccharide,EPS)是一种次生代谢产物,与细胞松散连接,并且可以直接分泌至细胞外环境中[2]。与植物多糖和动物多糖相比,由于微生物EPS的生产受地理环境及气候条件等自然因素的影响较小,并且其产量及质量稳定,性价比较高。另外EPS除具有良好的增黏性、耐盐性、抗温性、抗剪切性等理化特性外,还具有免疫调节、抗肿瘤、抗氧化[3]以及改善胃肠道机能[4]等多种生理机能,因此在食品和制药领域具有广阔的应用前景。但是,当前乳酸菌EPS的应用还很有限,主要原因是多糖产量过低,生产和提取成本很高。通过合成条件的研究可以发现影响EPS产量的关键因素,加之基因工程技术能够定向改造乳酸菌的遗传物质,这些方法都可以有效提高多糖产量并降低成本。
自然界中很多乳酸菌可以生物合成EPS,植物乳杆菌就是其中一类。乳酸菌EPS产量受诸多因素影响,乳酸菌菌株本身起决定性作用。不同乳酸菌在乳培养基中产EPS的范围不同,如噬热链球菌EPS产量为50~360 mg/L,干酪乳杆菌EPS产量为50~60 mg/L[5]。不同植物乳杆菌在MRS培养基中,EPS产量不同。EPS产量的范围为29.86~324.80 mg/L[6-9]。优化条件后G1德氏乳杆菌保加利亚亚种EPS产率提高17.8%[10],干酪乳杆菌LC2W在优化培养成分后,EPS产量提高28.75%[11],Lactobacillus reuteri-YR在最优发酵条件下,EPS实际产量可高达7 214.4 mg/L[12],这就使EPS的工业应用成为可能。除菌种因素外,培养基组成、培养条件等都会影响乳酸菌EPS产量[5],因此可以通过优化EPS生物合成的条件提高多糖产量。
本研究以EPS产量作为指标,通过单因素试验对EPS的培养基成分及培养条件进行研究,并通过Box-Behnken响应面法分析各因素之间交互作用对EPS产量的影响,进一步确定从云南传统发酵豆豉分离得到的植物乳杆菌YM-2菌株(Lactobacillus plantarum YM-2)[13]生物合成EPS的最优条件,从而提高其EPS产量,为进一步研究EPS生物学活性提供良好基础。
1 材料与方法
1.1 材料与试剂
菌株:从云南传统发酵豆豉分离得到的Lactobacillus plantarum subsp. plantarum YM-2菌株[14]。
MRS培养基(微生物干粉培养基质控图解手册):蛋白胨10.0 g、牛肉粉8.0 g、酵母粉4.0 g、葡萄糖20.0 g、K2HPO42.0 g、柠檬酸三铵2.0 g、乙酸钠5.0 g、MgSO4·7H2O 0.2 g、MnSO4·4H2O 0.05 g、吐温1 mL、蒸馏水1 000 mL,pH 6.2~6.4,115 ℃灭菌20 min。
硫酸(分析纯) 重庆川东化工(集团)有限公司;三氯乙酸(分析纯) 天津市光复精细化工研究所;碳酸氢钠、苯酚(均为分析纯)天津市风船化学试剂科技有限公司;乙二胺四乙酸(分析纯) 生工生物工程(上海)有限公司;MD34透析袋(1 000 D) 上海有渔实验设备有限公司。
1.2 仪器与设备
3-18K离心机 美国Sigma公司;FD5-12真空冷冻干燥机 美国SIM公司;Ultrospec 2100 pro紫外-可见分光光度计 美国GE公司。
1.3 方法
1.3.1 植物乳杆菌EPS的提取纯化[15]
对活化的菌种用血球计数板进行细胞计数,通过稀释的方法保持接种前细胞数量一致,之后根据体积比接种。植物乳杆菌按体积分数2%的接种量接种于MRS液体培养基中,37 ℃培养24 h;培养液4 ℃、10 000×g离心30 min,取上清液;加三氯乙酸至质量分数为4%,10 000×g离心15 min,取上清液;3 倍体积的预冷无水乙醇-20 ℃沉淀过夜;4 ℃、12 000×g离心30 min收集沉淀;待乙醇完全蒸发,加入2 mL的双蒸水溶解沉淀,转移到经过前处理的透析袋中透析2 d,其间8 h换水一次;收集透析液,真空冷冻干燥得到植物乳杆菌的EPS。
1.3.2 EPS产量的测定
利用苯酚-硫酸法[16]测定EPS含量。以葡萄糖为标准品作标准曲线,得到回归方程为y=13.307x+0.023,R2=0.996 9,曲线拟合良好。通过回归方程计算植物乳杆菌YM-2的EPS产量。
1.3.3 产糖培养基成分的优化
1.3.3.1 最佳碳源的筛选
选取葡萄糖、果糖、蔗糖、乳糖以及果糖和蔗糖混合碳源替代MRS培养基中的碳源,其他成分不变。每种碳源类型的含量确定为20 g/L,37 ℃培养24 h。
1.3.3.2 最佳氮源的筛选
将MRS培养基中的蛋白胨、牛肉膏和酵母粉选定为研究因素,每种氮源的含量确定为20 g/L,除氮源外,培养基中其他成分不变。培养条件为37 ℃、24 h。
1.3.4 培养条件的优化
已报道的影响乳酸菌EPS产量的条件包括:碳源、氮源、培养时间、培养温度、培养基初始pH值等[17]。本研究首先通过单因素试验筛选发酵条件,再通过响应面试验[18],得出植物乳杆菌YM-2菌株生物合成EPS的最优培养条件。
1.3.4.1 单因素试验优化
根据优化结果,本研究选定葡萄糖、酵母粉分别作为培养的碳源和氮源。在接种量2%、其余成分与MRS培养基成分比例一致、37 ℃培养24 h条件下,测定不同葡萄糖含量(10、15、20、25、30 g/L)对EPS产量的影响。在接种量2%、葡萄糖含量20 g/L、37 ℃培养24 h条件下,测定不同酵母粉含量(10、15、20、25、30 g/L)对EPS产量的影响。在接种量2%、碳源为葡萄糖20 g/L、氮源为酵母粉20 g/L、37 ℃培养条件下,测定不同培养时间(12、16、24、30、36 h)对EPS产量的影响。在接种量2%、碳源为葡萄糖20 g/L、氮源为酵母粉20 g/L、培养24 h条件下,测定不同培养温度(32、35、37、40、42 ℃)对EPS产量的影响。
1.3.4.2 响应面试验设计
响应面优化可以通过拟合回归方程以构建连续变量曲面预测模型,从而能够对不同因素水平及其交互作用进行优化和评价,所需试验次数较少,因此被成功地应用于各种优化过程[19-20]。根据单因素试验结果,选取碳源含量、氮源含量、培养时间、培养温度4 个因素,以EPS产量为响应值,根据Box-Behnken试验设计原理[21],设计四因素三水平响应面试验。每组试验重复3次。
1.4 数据处理
单因素试验设计中每项因素试验重复3 次,数据结果使用SPSS 22.0软件对其进行方差分析(One-Way ANOVA)。具体选用事后多重比较中假定方差齐性为LSD和Duncan,选项statistics为描述性,缺失值选择按分析顺序排除个案。采用Design-Expert(Version 8.0.6)软件进行试验设计、模型建立和数据分析。
2 结果与分析
2.1 培养基营养成分对EPS产量的影响
2.1.1 碳源种类对EPS产量的影响
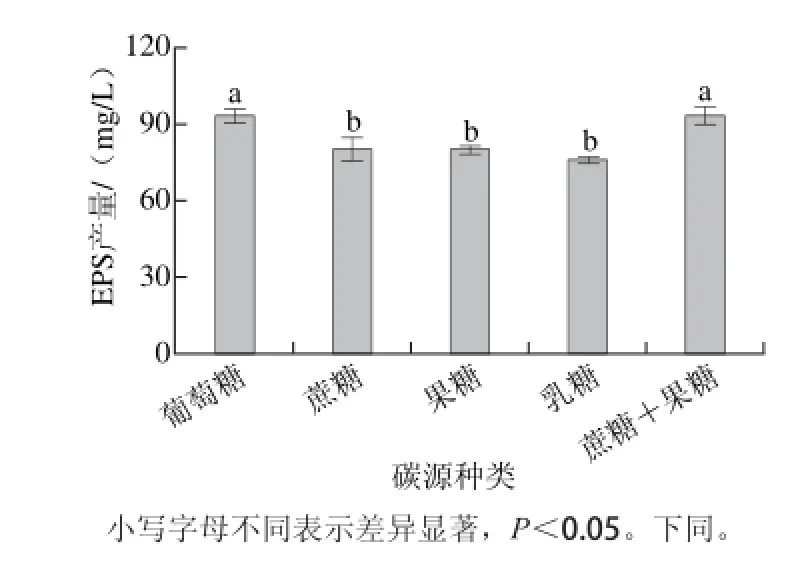
图 1 碳源种类对菌株YM-2 EPS产量的影响Fig. 1 Effects of carbon sources on the EPS yield of strain YM-2
由图1可知,植物乳杆菌YM-2能利用多种碳源生物合成EPS。当葡萄糖、蔗糖和果糖混合为碳源与蔗糖、果糖、乳糖为碳源两者存在显著差异(P<0.05)。当糖源为葡萄糖时,YM-2的EPS产量略高于糖源为蔗糖和果糖混合物,因此选择葡萄糖作为乳酸菌发酵的糖源。而从印度发酵饮料(Kyiad pyrsi)分离得到的菌株Leuconstoc lactis[22]当碳源为蔗糖时,EPS产量最高。Lactobacillus ke ranofaciens[23]、Lactobacillus strain A[24]当碳源为乳糖时,EPS产量最高。说明优势碳源的利用具有菌株差异性。
2.1.2 氮源种类对EPS产量的影响
氮源是乳酸菌合成EPS所必需的养分,不同的氮源和适量的添加量对菌体分泌EPS均有一定的影响[25]。由图2可知,该菌株能利用多种氮源进行发酵产糖。3 种不同的氮源对植物乳杆菌菌株YM-2 EPS产量的影响具有极显著性差异(P<0.001),当氮源为酵母粉时,该菌株的EPS产量最大,因此选择酵母粉作为乳酸菌发酵的氮源。氮源主要通过影响微生物生长速率影响EPS等代谢的合成[26]。与植物乳杆菌YM-2不同的是,从在奶酪乳清生长分离得到的kefiran[27]、从发酵穇子分离得到的Lactobacillus strain A[11]、Lactobacillus casei LC2W[28]在利用的氮源分别为酵母提取物、酪蛋白水解物、蛋白胨时,EPS产量达到最大值。说明优势 氮源的应用具有菌株差异性。
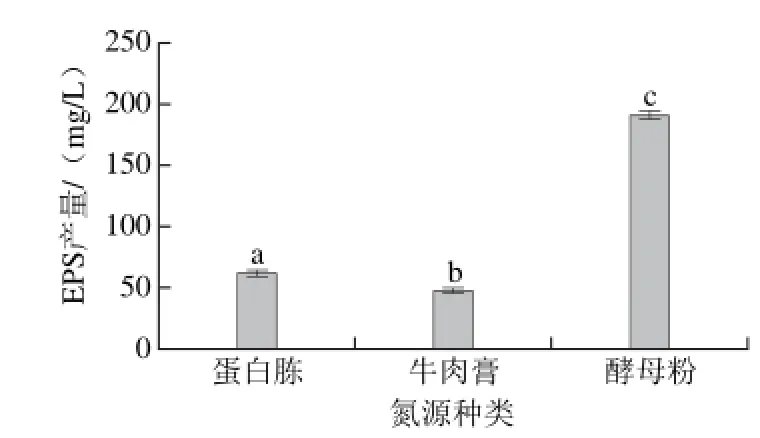
图 2 氮源种类对菌株YM-2 EPS产量的影响Fig. 2 Effects of nitrogen sources on the EPS yield of strain YM-2
2.2 培养条件的优化
2.2.1 单因素试验结果
2.2.1.1 葡萄糖含量对EPS产量的影响

图 3 葡萄糖含量对菌株YM-2 EPS产量的影响Fig. 3 Effects of glucose concentration in the medium on the EPS yield of strain YM-2
由图3可知,葡萄糖含量对植物乳杆菌EPS产量影响不大,当葡萄糖含量为10 g/L时,植物乳杆菌YM-2的EPS产量为(224.24±0.651)mg/L;当葡萄糖含量达到20 g/L时,EPS产量达到最大(228.684±0.483)mg/L;当葡萄糖含量达到25 g/L时,EPS产量有所下降;当葡萄糖含量为30 g/L时,EPS产量为(222.183±0.710)mg/L。葡萄糖含量较低时,EPS产量随着葡萄糖含量的提高而增多;当达到一定阶段时,EPS产量又随着葡萄糖含量的提高而下降。葡萄糖的含量较高时可以抑制乳酸菌EPS的合成。与此不同的是Lactobacillus cinfusus[28]在糖源含量高的条件下,EPS产量高。而Bacillus licheniformis[29]在糖源含量很低条件下,EPS产量反而会很高。这种现象是由于所研究的植物乳杆菌YM-2菌株中可能存在不同单糖转运与转化系统,乳酸菌可以通过这些转运系统控制进入细胞的碳源的量,转化系统又可以实现不同碳源的转化,使得菌体获得其所需要的糖。碳源表现的高浓度抑制EPS合成的现象表明菌体细胞中具有反馈抑制体系,这对EPS的生产应用是巨大的不利因素,因此研究碳源代谢体系,解除反馈抑制是另一个重要方面。
2.2.1.2 酵母粉含量对EPS产量的影响
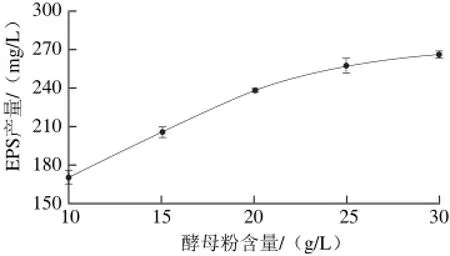
图 4 酵母粉含量对菌株YM-2 EPS产量的影响Fig. 4 Effects of yeast powder concentration in the medium on the EPS yield of strain YM-2
由图4可知,植物乳杆菌YM-2的EPS产量与酵母粉的含量呈正相关关系,当酵母粉含量为10 g/L时,EPS产量为(170.163±1.689)mg/L;随着酵母粉含量的增加,EPS产量不断增加,当酵母粉含量为30 g/L时,EPS产量达到(256.561±1.138)mg/L。当酵母粉含量较高时,EPS产量虽然还在增加,但增速有所减缓。在酵母粉含量在10~30 g/L范围内,植物乳杆菌YM-2的EPS产量没有下降趋势,因此可以确定氮源的种类和含量对EPS的合成起到了极为重要的作用。与之不同的是Lactobacillus LB 121[30]在高糖源(100 g/L)存在、缺乏氮源(MRS培养基配方中氮源)培养基中,EPS含量会升高。氮源对EPS合成的影响巨大,这可能是由于在植物乳杆菌YM-2中,氮源通过影响 EPS合成相关酶类的合成进而影响EPS的合成[31]。
2.2.1.3 培养时间对EPS产量的影响

图 5 培养时间对菌株YM-2 EPS产量的影响Fig. 5 Effect of culture time on the EPS yield of strain YM-2
由图5可知,培养时间对植物乳杆菌EPS的生物合成具有重要影响。当培养时间较短时,乳酸菌EPS产量随着时间的延长而提高;当某个时间点达到最大合成量后,EPS产量又随着时间的延长而下降。这说明随着时间的延长,当培养液的环境变得恶劣,营养物质无法满足乳酸菌的生长需要时,乳酸菌开始分解利用EPS以满足自身的生长。
2.2.1.4 培养温度对EPS产量的影响

图 6 培养温度对菌株YM-2 EPS产量的影响Fig. 6 Effect of culture temperature on the EPS yield of strain YM-2
由图6可知,培养温度对植物乳杆菌YM-2的EPS的生物合成具有重要影响。温度较低时,随着温度的提升EPS产量增加。当产量达到最大值后,温度再继续升高EPS产量出现下降。培养温度的影响表现为低温和高温都会抑制EPS的合成,只有在最适培养温度时EPS产量才能达到最高。
2.2.2 响应面试验结果
2.2.2.1 响应面试验设计与结果及方差分析
根据四因素三水平的响应面试验设计,共设立29 个试验点,试验方案及结果见表1。
表 1 响应面试验设计与结果Table 1 Experimental design and results for response surface analysis
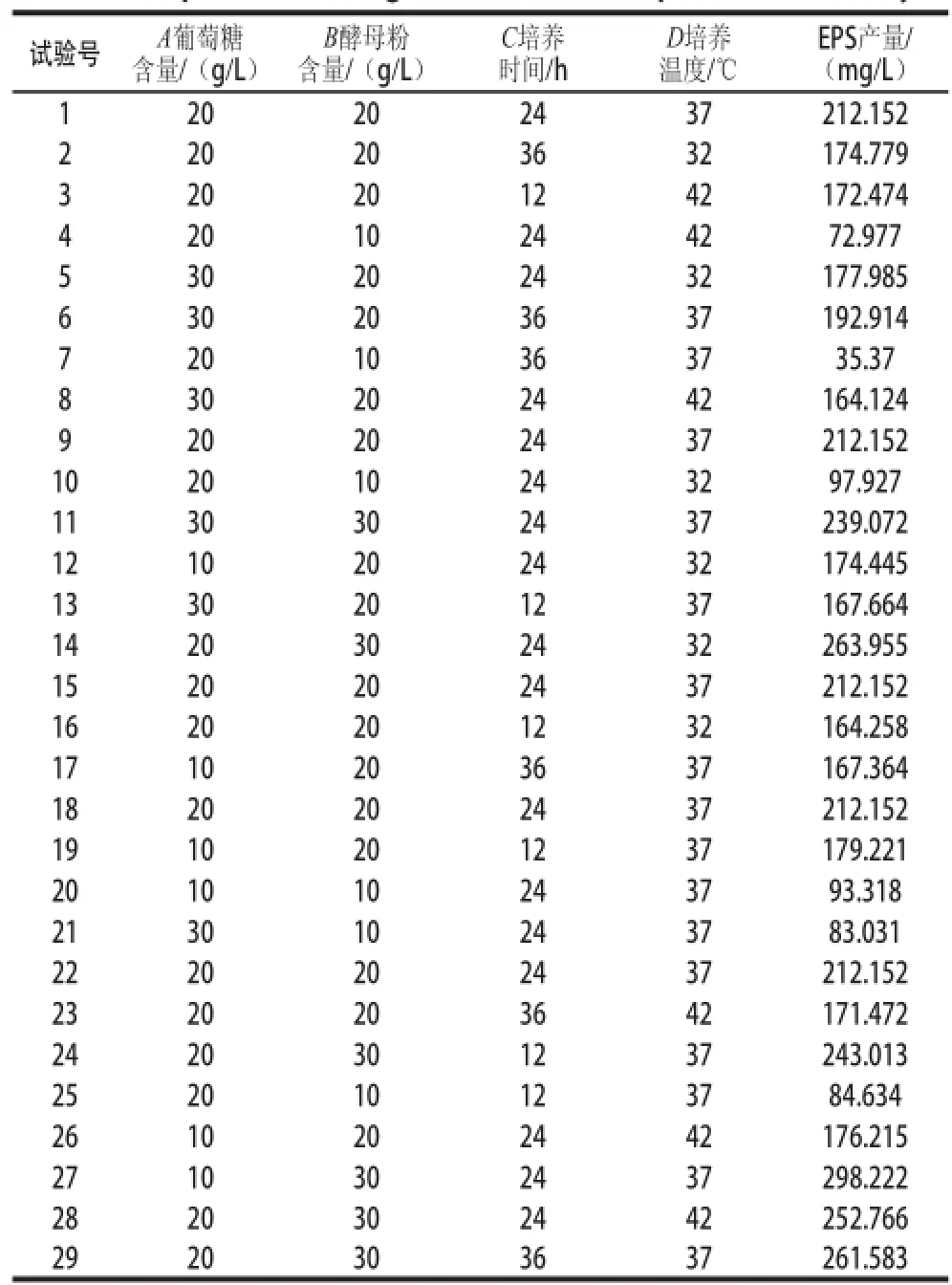
表 1 响应面试验设计与结果Table 1 Experimental design and results for response surface analysis
试验号 A葡萄糖含量/(g/L)EPS产量/(mg/L)120202437212.152 220203632174.779 320201242172.474 42010244272.977 530202432177.985 630203637192.914 72010363735.37 830202442164.124 9 20202437212.152 102010243297.927 1130302437239.072 1210202432174.445 1330201237167.664 1420302432263.955 1520202437212.152 1620201232164.258 1710203637167.364 1820202437212.152 1910201237179.221 201010243793.318 213010243783.031 2220202437212.152 2320203642171.472 2420301237243.013 252010123784.634 2610202442176.215 2710302437298.222 2820302442252.766 2920303637261.583 B酵母粉含量/(g/L)C培养时间/h D培养温度/℃
利用Design-Expert(Version 8.0.6)软件对表1试验数据进行回归拟合分析,得到植物乳杆菌YM-2菌株EPS产量(Y)对葡萄糖含量(A)、酵母粉含量(B)、培养时间(C)、培养温度(D)4 个因素的回归方程为:
Y=212.15-5.33A+90.95B-0.65C-3.61D-12.22AB+9.28AC-3.91AD+16.96BC+3.44BD-2.88CD-13.08A2-24.04B2-25.43C2-19.35D2

表 2 回归方程方差分析结果Table 2 Analysis of variance (AOVNA) of regression model
如表2所示,响应面方差分析所得的结果显著,说明试验结果可靠,预测结果与试验结果符合度很好,结果可信[21]。其中R2(0.980 8)与(0.961 6)值相近,而变异系数为6.83%,小于10%,说明模型可靠,在试验因素和水平条件下能够准确预测植物乳杆菌EPS的产量。
对回归方程各项进行方差分析,结合A、B、C、D各因素F值的大小,可以得出4 个因素对EPS产量影响的次序为:酵母粉含量>葡萄糖含量>培养温度>培养时间。其中B、B2、C2、D2对EPS产量的影响极显著,BC、A2对其影响显著,其余项对其影响不显著。
2.2.2.2 响应面交互作用结果
固定其中2 个因素,利用Design-Expert软件对试验数据进行二元多次回归拟合,所得方程响应面如图7所示。基于考察的试验条件范围内,结果显示:在葡萄糖含量与酵母粉含量的交互作用中,葡萄糖含量对EPS产量影响不大,不同葡萄糖含量条件下EPS产量相对稳定。而酵母粉含量对EPS的合成影响较大,酵母粉含量与EPS产量呈现正相关性(P<0.001),当酵母粉含量较高时EPS产量的增加有所减缓(图7a)。葡萄糖含量与培养时间互相作用明显,葡萄糖含量和培养时间水平增加到一定量时,EPS产量出现峰值随后下降(图7b)。葡萄糖含量与培养温度的交互作用中,EPS产量也呈现出相似的趋势(图7c)。
与酵母粉含量单因素试验相似,在酵母粉含量与培养时间的交互作用中,EPS产量与酵母粉含量具有正相关关系。而此时培养时间的作用与单因素试验不同,EPS产量只是在较短培养时间内和较长时间培养时略有下降,而在整个培养时间段内EPS产量变化并不大。在酵母粉含量与培养温度的交互作用中得到的结论也是相似的。EPS产量与酵母粉含量具有正相关关系。在较低和较高培养温度时EPS产量有所下降,而不同培养温度对EPS产量影响不大,没有单因素试验中的影响显著(图7d、7e)。
在培养时间和培养温度的交互作用中,培养时间与培养温度的作用都是显著的。在培养时间和培养温度都较低时,EPS产量随着培养时间或温度水平的提高而增加。当达到最大量后又随着时间或温度水平的提高而下降,时间和温度过低或过高时都会抑制EPS的合成(图7f)。


图 7 各因素交互作用对菌株YM-2 EPS产量的影响Fig. 7 Response surface plots showing the effects of various factors on the EPS yield of strain YM-2
由响应面优化得到EPS合成最优条件分别为葡萄糖含量30 g/L、酵母粉含量30 g/L、培养时间30.05 h、培养温度36.36 ℃,理论EPS产量为255.254 mg/L,这与验证实验获得的实际产量257.362 mg/L相近,因此认为通过响应面试验设计获得的模型是可信的。植物乳杆菌70810在发酵条件优化(蔗糖含量34 g/L、接种量5%、发酵温度31 ℃)后,EPS产量从64.17 mg/L[32]提高到425.16 mg/L[33]。植物乳杆菌C88经过发酵条件优化(初始pH 7.0、发酵温度37 ℃和添加2%果糖作为碳源),EPS产量从29.86 mg/L提高到40.96 mg/L[6]。植物乳杆菌YM11在优化的发酵条件下,EPS产量为129.915 mg/L[10]。本实验植物乳杆菌YM-2在优化培养条件后EPS产量由(25.450±1.389)mg/L提高到(257.362±0.781)mg/L,产量提高效率达到90.11%,与植物乳杆菌70810产量提高率(84.91%)和植物乳杆菌C88产量提高率(27.10%)均要高。这可能是因为在优化葡萄糖含量与培养温度的同时,也优化了酵母粉含量和培养时间。实验结果达到了预期结果,为今后更深入研究植物乳杆菌YM-2所产EPS的结构、生理功能以及机理的阐明提供研究基础,也为其进一步商业化发展提供了参考。
3 结 论
本实验通过单因素试验分析了植物乳杆菌YM-2合成EPS的最佳条件,并采用Box-Behnken设计及响应面分析,建立植物乳杆菌YM-2发酵条件的二次多项模型。经检验证明该模型具有可靠性,能较好地预测EPS产量。利用模型的响应面分析,得到最佳发酵条件为碳源(葡萄糖)含量30 g/L、氮源(酵母粉)含量30 g/L、培养时间30.05 h、培养温度36.36 ℃,此条件获得的实际EPS产量为257.362 mg/L。这为今后更深入研究植物乳杆菌YM-2结构、生理功能以及机理的阐明提供理论依据,也为其进一步商业化发展提供了参考。
[1] 张筠, 刘宁, 孟祥晨. 乳酸菌胞外多糖生物学活性[J]. 国外医学: 卫生学分册, 2004, 31(4): 227-230.
[2] RUAS-MADIEDO P, HUGENHOLTZ J, ZOON P. An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J]. International Dairy Journal, 2002, 12: 163-171. DOI:10.1016/S0958-6946(01)00160-1.
[3] JI W, XIAO Z, ZHENG T, et al. Characterization of an exopolysaccharide produced by Lactobacillus plantarum YW11 isolated from Tibet Kefir[J]. Carbohydrate Polymers, 2015, 125: 16-25. DOI:10.1016/j.carbpol.2015.03.003.
[4] NWODO U U, GREEN E, OKOH A I. Bacterial exopolysaccharides: functionality and prospects[J]. International Journal of Molecular Sciences, 2012, 13(11): 14002-14015. DOI:10.3390/ijms131114002.
[5] 邵丽. 产胞外多糖乳杆菌的筛选及其多糖的分离、结构和生物活性研究[D]. 无锡: 江南大学, 2015.
[6] 张岩春, 李盛钰, 罗永康, 等. 产胞外多糖植物乳杆菌C88发酵条件优化[J]. 中国乳品工业, 2010, 38(7): 18-21. DOI:10.3969/ j.issn.1001-2230.2010.07.005.
[7] WANG J, ZHAO X, TIAN Z, et al. Isolation and characterization of exopolysaccharide-producing Lactobacillus plantarum SKT109 from Tibet Kefir[J]. Polish Journal of Food and Nutrition Sciences, 2015, 65(4): 269-279. DOI:10.1515/pjfns-2015-0023.
[8] WANG J, ZHAO X, TIAN Z, et al. Characterization of an exopolysaccharide produced by Lactobacillus plantarum YW11 isolated from Tibet Kefir[J]. Carbohydrate Polymers, 2015, 125: 16-25. DOI:10.1016/j.carbpol.2015.03.003.
[9] ZHOU K, ZENG Y T, YANG M L, et al. Production, purification and structural study of an exopolysaccharide from Lactobacillus plantarum BC-25[J]. Carbohydrate Polymers, 2016, 144(25): 205-214. DOI:10.1016/j.carbpol.2016.02.067.
[10] 曹永强, 王辑, 赵笑, 等. 植物乳杆菌YW11生产胞外多糖的发酵条件研究[J]. 北京工商大学学报(自然科学版), 2016, 34(1): 42-49. DOI:10.3969/j.issn.2095-6002.2016.01.007.
[11] 艾连中, 郭本恒, 张灏, 等. 干酪乳杆菌LC2W合成胞外多糖培养基成分的优化[J]. 中国乳品工业, 2007, 35(2): 16-18. DOI:10.3969/ j.issn.1001-2230.2007.02.004.
[12] 陈晓燕. 胞外多糖高产乳杆菌的选育及其发酵条件的优化[D].兰州: 兰州大学, 2013.
[13] 秦晓萌. 植物乳杆菌胞外多糖的合成研究[D]. 昆明: 昆明理工大学, 2015.
[14] LIU C J, GONG F M, LI X R, et al. Natural populations of lactic acid bacteria in douchi from Yunnan province, China[J]. Journal of Zhejiang University Science B: Biomedicine & Biotechnology 2012, 13(4): 298-306. DOI:10.1631/jzus.B1100221.
[15] 王瑞琼, 张红星, 熊利霞, 等. 乳酸菌胞外多糖分离纯化方法研究进展[J]. 食品科学, 2008, 29(8): 700-703. DOI:10.3321/ j.issn:1002-6630.2008.08.172.
[16] KANMANI P, SATISH K R, YUVARAJ N, et al. Production and purification of a novel exoploysaccharide from lactic acid bacterium Streptococcus phocae PI80 and its functional characteristics activity in vitro[J]. Bioresource Technology, 2011, 102(7): 4827-4833.
[17] 王永菲, 王成国. 响应面法的理论与应用[J]. 中央民族大学学报(自然科学版), 2005, 14(3): 236-240. DOI:10.3969/ j.issn.1005-8036.2005.03.008.
[18] BAJPAI S, GUPTA S K, DEY A, et al. Application of central composite design approach for removal of chromium (Ⅵ) from aqueous solution using weakly anionic resin: modeling, optimization, and study of interactive variables[J]. Journal of Hazardous Materials, 2012, 227: 436-444. DOI:10.1016/j.jhazmat.2012.05.016.
[19] CHANDRA M, BARATA A, LOUREIORO V, et al. A response surface methodology study on the role of factors affecting growth and volatile phenol production by Brettanomyces bruxellensis ISA 2211 in wine[J]. Food Microbiology, 2014, 42(9): 40-46. DOI:10.1016/ j.fm.2014.03.002.
[20] 高慧娟, 刘志芳, 袁成玲, 等. 响应曲面法优化大盖G9菌丝体干重和胞外粗多糖的发酵条件[J]. 食品科技, 2014, 39(10): 57-62.
[21] BASKAN M B, PALA A. A Statistical experiment design approach for arsenic removal by coagulation process using aluminum sulfate[J]. Desalination, 2010, 254(1/2/3): 42-48. DOI:10.1016/ j.desal.2009.12.016.
[22] JOSHI S R, KOIJAM K. Exopolysaccharide production by a lactic acid bacteria, Leuconostoc lactis isolated from ethnically fermented beverage[J]. Natlonal Academy Science Letters-India, 2014, 37(1): 59-64. DOI:10.1007/s40009-013-0203-6.
[23] CHEIRSILP B, SHIMIZU H, SHIOYA S. Modelling and optimization of environmental conditions for kefiran production by Lactobacillus ke ranofaciens[J]. Applied Microbiology and Biotechnology, 2001, 57(5/6): 639-646.
[24] DESAIA K M, AKOLKARA S K, BADHEB Y P, et al. Optimization of fermentation media for exopolysaccharide production from Lactobacillus plantarum using artificial intelligence-based techniques[J]. Process Biochemistry, 2006, 41(8): 1842-1848. DOI:10.1016/j.procbio.2006.03.037.
[25] 纪鹃, 李伟, 陈晓红, 等. 瑞士乳杆菌MB2-1胞外多糖发酵条件优化[J]. 食品科学, 2014, 35(7): 95-101. DOI:10.7506/spkx1002-6630-201407020.
[26] 李彦岩, 张彩, 范熠, 等. 一株解淀粉芽孢杆菌产糖条件的优化[J]. 食品科学, 2013, 34(7): 185-189. DOI:10.7506/spkx1002-6630-201307039.
[27] GHASEMLOU M, KHODAIYAN F, JAHANBIN K, et al. Structural investigation and response surface optimisation for improvement of kefiran production yield from a low-cost culture medium[J]. Food Chemistry, 2012, 133(2): 383-389. DOI:10.1016/ j.foodchem.2012.01.046.
[28] SEESURIYACHAN P, KUNTIYA A, HANMOUNGJAI P, et al. Optimization of exopolysaccharide overproduction by Lactobacillus confusus in solid state fermentation under high salinity stress[J]. Bioscience Biotechnology and Biochemistry, 2012, 76(5): 912-917. DOI:10.1271/bbb.110905.
[29] LARPIN S, SAUVAGEOT N, PICHEREAU V, et al. Biosynthesis of exopolysaccharide by a Bacillus licheniformis strain isolated from Ropy Cider[J]. International Journal of Food Microbiology, 2002, 77(1/2): 1-9. DOI:10.1016/S0168-1605(02)00058-2.
[30] van GEEL-SCHUTTEN G H, FLESCH F, SMITH M R, et al. Screening and characterization of Lactobacillus strains producing large amounts of exopolysaccharides[J]. Applied Microbiology and Biotechnology, 1998, 50(6): 697-703.
[31] 张清丽. 酪蛋白活性肽对乳酸菌生长代谢及酸乳发酵影响的研究[D].广州: 华南理工大学, 2001.
[32] WANG K, LI W, RUI X, et al. Characterization of a novel exopolysaccharide with antitumor activity from Lactobacillus plantarum 70810[J]. International Journal of Biological Macromolecules, 2014, 63: 133-139. DOI:10.1016/j.ijbiomac.2013.10.036.
[33] 冯美琴, 邢家溧, 张琦, 等. 植物乳杆菌胞外多糖发酵条件的优化[J].食品科学, 2011, 32(23): 215-219.
Optimization of Biosynthesis Conditions for the Production of Exopolysaccharides by Lactobacillus plantarum YM-2
SI Tianzhao, LIU Chenjian, QIN Xiaomeng, LI Xiaoran, LUO Yiyong, YANG En*
(Faculty of Life Science and Technology, Kunming University of Science and Technology, Kunming 650500, China)
The fermentation conditions for the production of exopolysaccharides (EPS) by Lactobacillus plantarum YM-2, isolated from traditional fermented tempeh in Yunnan province, were optimized. Firstly, the carbon and nitrogen sources in the medium were screened. Secondly, the effects of carbon source concentration, nitrogen source concentration, culture time and culture temperature on EPS yield were studied through one-factor-at-a-time analysis. Finally, response surface methodology (RSM) based on a four-variable, three-level Box-Behnken design was used to determine the optimal culture conditions as follows: carbon source concentration, 30 g/L; nitrogen s ource concentration, 30 g/L; culture time, 30.05 h; and culture temperature, 36.36 ℃. Under these conditions, the yield of EPS was 257.362 mg/L.
Lactobacillus plantarum; exopolysaccharides (EPS); optimization; response surface methodology (RSM)
10.7506/spkx1002-6630-201710005
TS201.3
A
1002-6630(2017)10-0024-07
司天昭, 柳陈坚, 秦晓萌, 等. 植物乳杆菌YM-2菌株胞外多糖生物合成工艺优化[J]. 食品科学, 2017, 38(10): 24-30.
DOI:10.7506/spkx1002-6630-201710005. http://www.spkx.net.cn
SI Tianzhao, LIU Chenjian, QIN Xiaomeng, et al. Optimization of biosynthesis conditions for the production of exopolysaccharides by Lactobacillus plantarum YM-2[J]. Food Science, 2017, 38(10): 24-30. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201710005. http://www.spkx.net.cn
2016-07-06
国家自然科学基金地区科学基金项目(31560447)
司天昭(1992—),女,硕士研究生,研究方向为食品微生物。E-mail:xizhao_si@126.com
*通信作者:杨恩(1982—),女,讲师,博士,研究方向为食品微生物。E-mail:enen_yang@126.com

