枯草芽孢杆菌纤维素酶基因整合载体的构建
聂利波,王占彬,史敦胜,宋洋洋,李 旺
枯草芽孢杆菌纤维素酶基因整合载体的构建
聂利波,王占彬,史敦胜,宋洋洋,李 旺*
(河南科技大学动物科技学院,河南 洛阳 471003)
目的:以枯草芽孢杆菌(Bacillus subtilis)为宿主,构建纤维素酶基因整合表达载体,获得能够表达纤维素酶并且降解纤维素的工程菌。方法:通过聚合酶链式反应(polymerase chain reaction,PCR)从B. subtilis LN基因组中克隆同源片段M1、M2基因片段,以质粒pGEM-T为载体,将同源片段M1、M2、启动子P43和葡萄糖苷酶基因CelKg连接在一起构建整合载体pGEM-Kmpgmt,并采用双交换同源重组的方式将其转化进入B. subtilis LN基因组中。结果:通过PCR和双酶切验证整合载体构建完成,并成功整合到野生型B. subtilis LN中,获得重组菌B. subtilis Kpg。刚果红染色结果显示重组菌对羧甲基纤维素钠有降解作用。改良培养基37 ℃条件下摇瓶培养,重组菌B. subtilis Kpg生长至18 h时上清液中纤维素酶活力比野生型B. subtilis LN提高了115%。
同源重组;纤维素酶基因;枯草芽孢杆菌
纤维素是植物组织中最丰富的组成成分之一,但在饲料中的利用率较低。以秸秆丢弃和焚烧为例,既造成严重的环境污染,又浪费了大量的饲料资源[1-2]。但是除牛羊等反刍动物外,大多数畜禽对纤维素的利用率都很低。随着生物技术的发展,纤维素酶的生物转化为纤维素的利用提供新的方式。既可以高效转化纤维素类底物,创造经济利润[3-5],又可以为饲料资源的开发开辟新的方向,缓解了目前饲料资源紧张的局面[6-7]。此外,纤维素酶作为一种绿色添加剂,在提高饲料转化率的同时,也降低了对环境的影响。
为提高纤维素酶的活性,常借助分子技术构建高表达载体来改善酶活力。在以往载体构建的相关研究中,通常将外源基因直接以质粒的形式,转入受体菌来构建重组菌。但是由于质粒存在不稳定性,在细胞分裂过程中会引起质粒的丢失和分配不均,影响外源基因的表达[8]。同源重组技术可以将外源基因整合到宿主基因组中,避免了导入整个质粒带来的不确定性,并且改善了工程菌遗传的稳定性[9]。在宿主选择方面,为了获得高活性的外源酶产物,最初忽略了宿主的安全性。但是,随着人们安全意识的提高和在饲料中使用方便性的要求,越来越多的动物益生菌作为基因工程的宿主来使用[10]。
本实验采用动物消化道的野生型枯草芽孢杆菌(Bacillus subtilis)LN为宿主菌,利用同源重组的方式,将外源纤维素酶基因整合到宿主中构建重组菌,以期提高纤维素酶活力并为将来在饲料实践中使用提供材料。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒
大肠杆菌E.coli DH5α 天根生化科技(北京)有限公司;pGEM®-T Easy Vector载体 美国Promega公司;pGEM-P43质粒(含启动子P43基因)、pGEM-M1质粒(含同源片段M1基因)、pGEM-M2质粒(含同源片段M2基因)、pGEM-Kg质粒(含葡萄糖苷酶基因CelKg基因)、野生型B. subtilis LN 河南科技大学生物饲料与精准营养实验室构建保存。
1.1.2 试剂
质粒小提试剂盒、琼脂糖DNA凝胶回收试剂盒、细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司;限制性内切酶、DNA聚合酶、DNA连接酶 美国NEB公司;蛋白胨、酵母粉、羧甲基纤维素钠 洛阳博冠商贸有限公司。
1.1.3 仪器与设备
高速台式离心机 上海安亭科学仪器厂;台式冷冻离心机 美国Thermo Fisher Scienti c公司;基因扩增热循环仪 西安天隆科技有限公司;DYY-10C型电泳仪北京市六一仪器厂;凝胶成像分析系统 上海天能科技有限公司;电热恒温培养箱 上海新苗医疗器械制造有限公司;双人净化工作台 浙江苏净净化设备有限公司。
1.1.4 引物设计和合成
根据GenBank中启动子P43基因和同源片段M1、M2基因的序列,按照通常引物的设计原则,利用Vector NTI分析软件分别设计含有对应酶切位点的引物P4326F/ P4326R(P43基因)、M1tF/M1tR(M1基因)和M2tF/ M2tR(M2基因)。引物由上海生工生物工程股份公司合成(表1)。

表 1 引物名称与序列Table 1 Primer sequences used in this study
1.2 方法
1.2.1 含M1、P43、CelKg、M2基因pGEM-T重组载体的构建
通过聚合酶链式反应(polymerase chain reaction,PCR)技术,分别利用引物P4326F/P4326R、M1tF/M1tR和M2tF/M2tR从相应的质粒pGEM-P43、pGEM-M1和pGEM-M2中扩增获得启动子P43和同源片段M1、M2基因。通过1%琼脂糖凝胶电泳,将目的片段纯化回收。PCR回收产物分别使用对应的限制性内切酶NcoⅠ、SacⅡ(P43基因)ApaⅠ、AatⅡ(M1基因)SalⅠ、BstXⅠ(M2基因)进行双酶切,并将产物回收。双酶切回收产物依次插入质粒pGEM-Kg中,构建整合载体pGEM-Kmpgmt。将重组质粒进行测序,并通过VectorNTI软件和NCBI数据库对其序列进行分析。
1.2.2 野生型B. subtilis LN感受态的制备
野生型B. subtilis LN感受态的制备过程参考野生型枯草芽孢杆菌N4的spizizen转化法[11]。
1.2.3 含M1、P43、CelKg、M2基因重组菌B. subtilis Kpg的构建
将构建好的pGEM-Kmpgmt质粒10 μg与500 μL的B. subtilis感受态混合,37 ℃、210 r/min振荡培养40 min,然后加入500 μL LB液体培养基37 ℃、210 r/min振荡培养30 min,使菌体复苏。取100 μL菌液均匀涂布于LB固体培养基上,37 ℃恒温培养箱中倒置培养14~16 h。从LB固体培养基上挑取单菌落为模板,以P4326F/P4326R为引物,利用PCR技术进行检测,将显现有500 bp的单菌落样品进行保菌,记作B. subtilis Kpg。
1.2.4 重组菌B. subtilis Kpg的分离鉴定
将重组菌B. subtilis Kpg稀释103倍后取10 μL滴于含1%刚果红的羧甲基纤维素(carboxyl methyl cellulose,CMC)培养基上,倒置培养16 h,观察是否有透明圈的出现。将出现透明圈的菌落涂布于LB固体培养基上,挑取单菌落进行革兰氏染色,通过显微镜观察菌体形态。
1.2.5 重组菌B. subtilis Kpg纤维素酶活性的分析
从CMC培养基挑取透明圈直径最大的菌种,接种于LB液体培养基中37 ℃、210 r/min振荡培养至对数期,分成6 个实验组,按1∶100(V/V)接种于5 mL种子培养基中37 ℃、210 r/min进行培养。野生型B. subtilis LN作为对照组同样处理。在12、18、24、30、36、48 h时分别取3 mL菌液4 ℃、5 000 r/min离心30 min,上清液即为粗酶液。取粗酶液1 mL加入羧甲基纤维素酶底物溶液2 mL,50 ℃恒温水浴30 min,加入2.5 mL 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)染液沸水浴10 min,迅速用流水冷却至室温后定容至25 mL[12]。以不加酶液的相同底物为对照,测定540 nm波长处OD值。
1 个酶活力单位(U/mL)定义为50 ℃条件下,以1 mL纤维素酶粗酶液在1 min内水解羧甲基纤维素钠生成1 μg葡萄糖的酶量,酶活力(X)根据以下公式计算:

式中:N为酶样所稀释的倍数;k为葡萄糖标准曲线的斜率;t为反应时间/min;V为酶样体积/mL。
2 结果与分析
2.1 整合载体pGEM-Kmpgmt质粒的构建
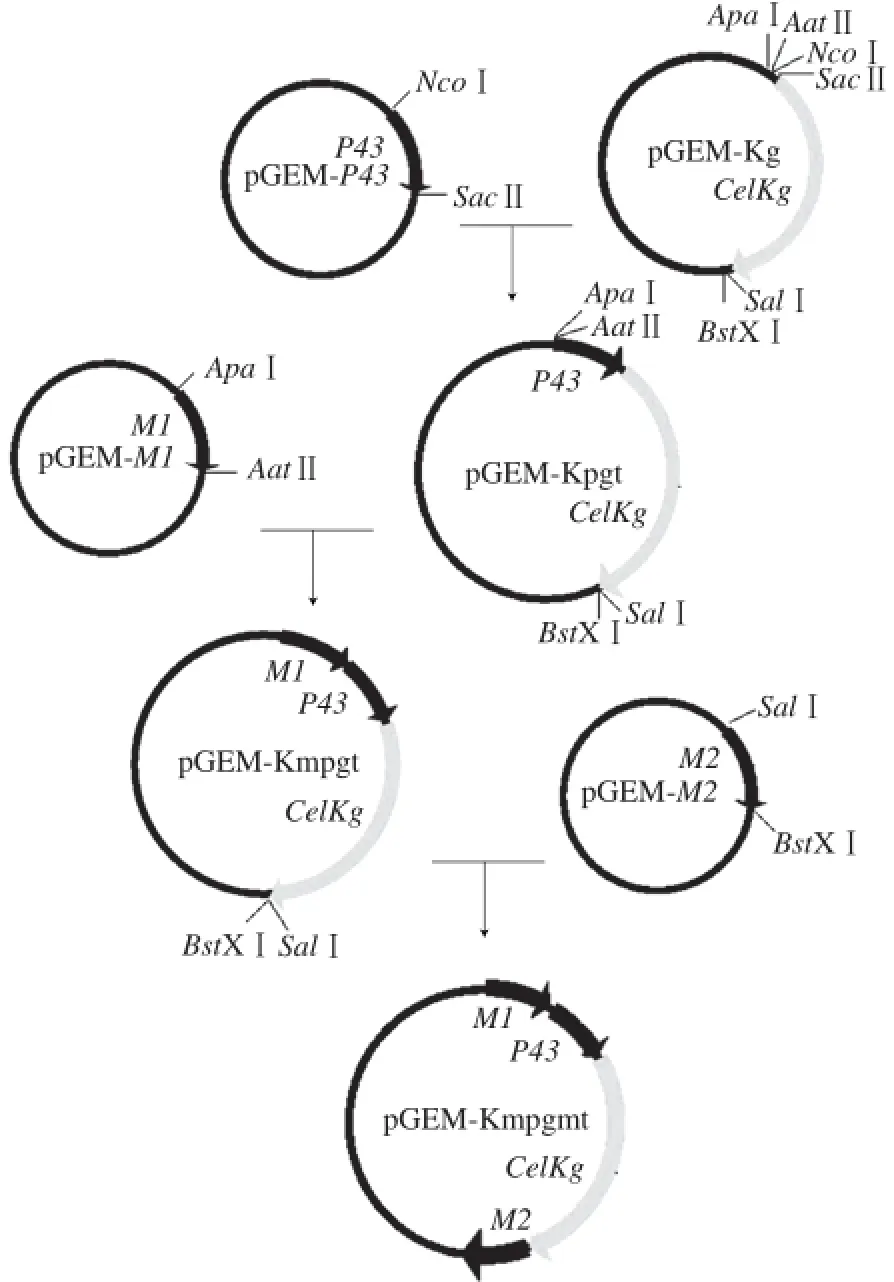
图 1 载体构建路线Fig. 1 Route for vector construction
将启动子P 4 3与同源片段M 1、M 2依次和含有葡萄糖苷酶基因C e l K g的载体p G E M-K g连接(图1),每次均利用蓝白斑筛选,挑菌提取质粒进行双酶切验证。通过酶切结果显示,利用NcoⅠ、SacⅡ双酶切后,菌落3获得大小约为477 bp和4 697 bp的两个片段(图2);利用ApaⅠ、AatⅡ双酶切后,菌落1、菌落3均获得大小约为500 bp和5 170 bp的两个片段(图3);利用SalⅠ、BstXⅠ双酶切后,菌落1获得大小约为500 bp和5 700 bp的两个片段(图4)。将连接成功的菌种保菌以便后续实验。通过以上酶切结果显示,在连接产物中成功地检测到相应的目的基因,证明每一步都达到预期的结果。将构建好的载体pGEM-Kmpgmt测序,测序结果显示启动子P43和同源片段M1、M2均已成功克隆到载体pGEM-Kg上。

图 2 质粒pGEM-Kpgt双酶切检验(NcoⅠ、SacⅡ)Fig. 2 Identification by double restriction-enzyme digestion of plasmid pGEM-Kpgt (Nco Ⅰ, SacⅡ)
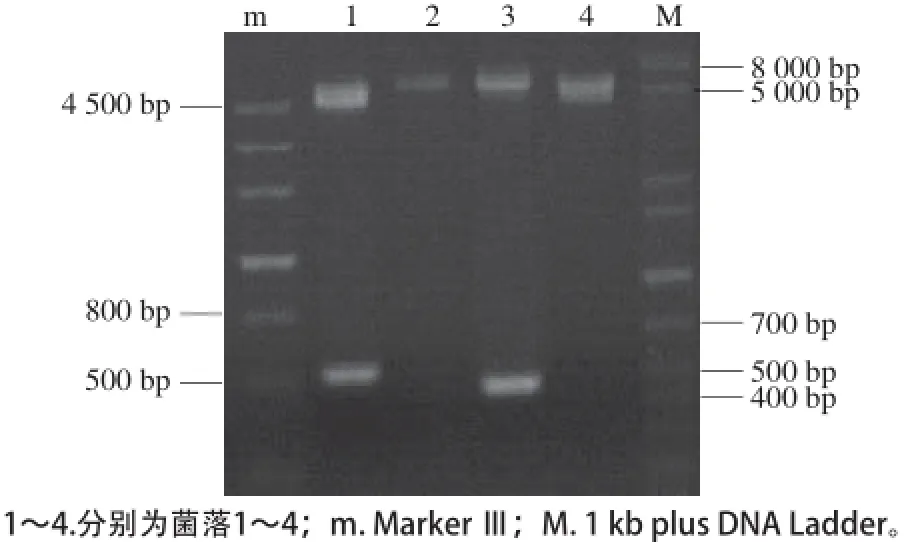
图 3 质粒pGEM-Kmpgt双酶切检验(ApaⅠ、AatⅡ)Fig. 3 Verification by double restriction-enzyme digestion of plasmid pGEM-Kmpgt (Apa Ⅰ, AatⅡ)
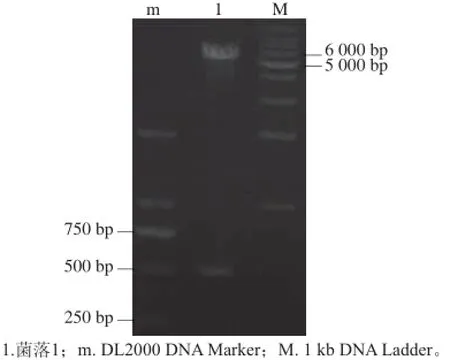
图 4 质粒pGEM-Kmpgmt双酶切检验(SalⅠ、BstXⅠ)Fig. 4 Verification by double restriction-enzyme digestion by plasmid pGEM-Kmpgmt (Sal Ⅰ, BstXⅠ)
2.2 重组菌B. subtilis Kpg的构建
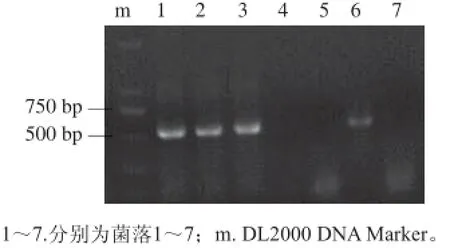
图 5 重组菌的PCR鉴定Fig. 5 Identification of recombinant B. subtilis by PCR method
将构建好的载体pGEM-Kmpgmt通过化学转化的方式转入B. subtilis LN感受态中,涂板后挑菌以P4326F/ P4326R为引物进行菌落PCR。在挑取的7 种菌里,菌落1、2、3、6均可以扩增出基因片段P43(图5)。启动子P43并非来源于B. subtilis LN,重组质粒pGEM-Kmpgmt进入细胞后,由于同源臂的作用,与受体菌自身基因组发生双交换,顺利将其整合到B. subtilis LN基因组内,所以能从中扩增出大小约为500 bp的片段。实验结果证明构建的载体pGEM-Kmpgmt已通过同源重组的方式将葡萄糖苷酶基因CelKg和启动子P43整合到了B. subtilis LN的基因序列中。
2.3 重组菌B. subtilis Kpg纤维素降解能力的检测
将上一步获得的重组菌1、2、3、6进行刚果红染色,菌落周围均产生透明圈,证明其具有分解纤维素的能力[13](图6)。重组菌透明圈的直径均大于野生型B. subtilis LN,其中重组菌3的透明圈直径最大。LB固体培养基上,这4 种菌落都呈微黄色,中间凸起,表面光滑,周围有不规则的褶皱,符合B. subtilis的菌体形态特征。在1 000 倍的显微镜下观察菌体呈杆状,均有芽孢出现,和野生型B. subtilis LN形态相同,革兰氏染色镜检呈阳性(图7)。
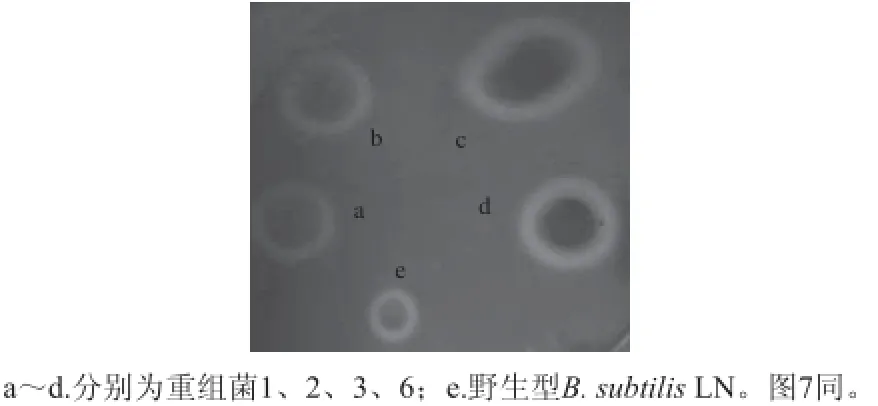
图 6 重组菌与野生菌的刚果红染色Fig. 6 Congo red staining of wild-type and recombinant B. subtilis
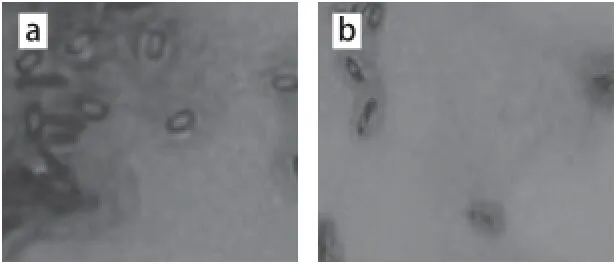

图 7 重组菌与野生菌的革兰氏染色Fig. 7 Gram staining of wild-type and recombinant B. subtilis
2.4 重组菌B. subtilis Kpg纤维素酶活性的分析

图 8 重组菌与野生菌纤维素酶活力Fig. 8 Cellulase activities of wild-type and recombinant B. subtilis
从CMC-刚果红培养基中挑取重组菌3,进行纤维素酶活力分析,以野生型B. subtilis LN为对照。绘制葡萄糖的标准曲线得出k为0.722 7。通过酶活力公式计算出各时间段重组菌3和野生型B. subtilis LN的酶活力。结果发现,在37 ℃、210 r/min条件下,重组菌3在各时间段纤维素酶活力均高于同时间段野生型B. subtilis LN,在18 h时重组菌3的纤维素酶活力最大,达到55.22 U/mL,相对于野生型B. subtilis LN酶活力提高了115%(图8)。将重组菌3记作B. subtilis Kpg。
3 讨 论
葡萄糖苷酶基因CelKg源自于B. subtilis K的基因组,全长为1 686 bp。通过NCBI对其进行序列分析,葡萄糖苷酶基因CelKg与已经报道的B. subtilis纤维素酶基因CP002468.1、CP003329.1、CP003695.1、AP012495.1、AP012496.1的基因序列相似度达到99%;其编码的氨基酸序列与已知B. subtilis的葡萄糖苷酶基因ZP12669813.1、YP004205293.1、YP007428400.1、YP007464110.1、YP007208039.1编码的氨基酸序列相似性达到99%[14]。根据本实验刚果红染色结果显示,重组菌B. subtilis Kpg的表达产物对羧甲基纤维素钠有降解作用,即葡萄糖苷酶基因CelKg能在宿主B. subtilis LN内顺利表达。启动子P43是B. subtilis胞苷脱氨酶基因的启动子,属于组成型启动子,与RNA聚合酶σ43(σA)和σ37(σB)的识别区相互重叠[15]。B. subtilis的DNA转录过程中,σA主要参与营养期基因的起始转录,而当细胞生长至对数期晚期和稳定期早期时由σB负责基因的起始转录[16]。张婷婷等[17]将启动子P43插入载体Peb-bgaB前段后导入B. subtilis,发现启动子P43在细菌生长至对数期时便开始表现转录活性,随着细菌的不断生长,P43活性不断提高,到达平稳期时其活性逐渐趋于平稳。本实验中,重组菌B. subtilis Kpg在18 h纤维素酶活性最高,当细菌生长至36、40、48 h时,重组菌B. subtilis Kpg和野生型B. subtilis LN纤维素酶活性都趋于平稳并逐渐降低,但是重组菌B. subtilis Kpg相对同时期的野生型B. subtilis LN纤维素酶活性却提高了147%、121%、160%,与张婷婷等[17]实验结果一致。
本实验选用的同源片段M1、M2均来自于B. subtilis LN的基因组中。在同源重组过程中,选择合理的整合位点,可以减轻突变引起的破坏,且最小程度地影响目的蛋白的结构和功能[18]。此外,同源片段的长度对重组效率也很关键。聂宇等[19]通过实验发现,当同源片段达到50 bp时锌指核酸酶就可以完成对同源重组的介导,当同源片段增长时,介导能力就越强,整合效率也就越高。但当同源臂过长,整合效率不再提高,反而会增加基因突变,对目的基因的表达产生影响[20]。在B. subtilis进行同源重组时,要求同源片段的长度至少为400~500 bp,这样才能保证重组的成功[21]。同源片段M1、M2长度各为500 bp,尽可能的减少片段过长引起的突变或过短造成的整合效率偏低。这两段基因所在的位置在B. subtilis LN基因组中并无明确的意义,因此在此处进行同源重组,并不会给葡萄糖苷酶基因CelKg的表达和整个基因组的稳定遗传带来不良影响。

图 9 双交换同源重组Fig. 9 Double crossover homologous recombination
芽孢杆菌质粒在复制过程中对结构的重新排列比较敏感,常常产生不稳定的单链DNA,这样会引起目的基因的不表达或丢失[22]。刘晖[23]将3 种来源不同纤维素酶基因以质粒的形式分别导入B. subtilis中,在获得3 株重组菌中,只有两株能够表达目的蛋白,剩下一株没有表达或表达量很低。为避免这种情况,Duncan等[24]首次使用同源重组的方式,从B. subtilis噬菌体中克隆出胸腺嘧啶合成酶基因thy,以大肠杆菌质粒为载体,构建新型重组质粒。依靠φ3Tthy基因两侧序列与芽孢杆菌染色体具有一定的同源性,成功的转化进B. subtilis 突变体。近几年,同源重组技术已经广泛的应用在乳酸菌、酵母菌、B. subtilis、癌细胞等微生物方面[25-28]。本实验在Duncan的实验方法和原理的基础上稍加改进设计同源重组技术路线(图9),将外源基因及相关表达原件成功整合到野生型B. subtilis LN基因组中。证明了同源重组技术在野生型B. subtilis基因组上的可行性,同时也确保了目的基因CelKg在宿主细胞内稳定的遗传。
B. subtilis作为革兰氏阳性菌,具有完整的表达分泌机制,表达蛋白在胞内合成后,直接分泌到发酵液中,方便对表达产物的收集和分离提纯。虽然与传统的大肠杆菌表达系统相比,B. subtilis表达系统的研究还并不完善,但在分泌蛋白表达活性和蛋白纯化方面要明显优于大肠杆菌[29]。杨韵霏等[30]构建含细菌麦芽糖淀粉酶基因的B. subtilis重组菌,发现重组菌酶活最高为296.64 U/mL。利用相同来源的淀粉酶基因在大肠杆菌表达,淀粉酶活力仅为227.82 U/mL,再次验证了B. subtilis表达系统相对大肠杆菌表达系统的高效性[31]。张懿翔等[32]在B. subtilis A5中进行透明颤菌血红蛋白基因vgb的整合表达,通过高密度培养,脱胶酶的表达量提高了29.5%,脱胶效果也明显改善。本实验中,B. subtilis表达系统也实现了葡萄糖苷酶基因CelKg的高效表达,重组菌B. subtilis Kpg粗酶液中纤维素酶活力最高为55.22 U/mL,与野生型B. subtilis LN相比其活力提高了115%。除此之外,B. subtilis还具有抗逆性性强、易储存的优势,且生长迅速,有较好的发酵基础和生产技术。作为益生菌运用到饲料中,一方面方便加工保存,提高活菌效果,另一方面能够发挥B. subtilis对动物肠道健康和免疫能力的改善,提升和改善动物产品品质[33-36]。
本实验构建的重组菌B. subtilis Kpg,验证了野生型B. subtilis整合表达的可行性,将来在构建其他酶系的重组菌时,只需将葡萄糖苷酶基因CelKg敲除换成相应的酶基因就可以获得稳定遗传的重组B. subtilis,丰富和改善B. subtilis的功能和作用。
[1] CAO J, SUN X W, LU C H, et al. Water-soluble cellulose acetate from waste cotton fabrics and the aqueous processing of allcellulose composites[J]. Carbohydrate Polymers, 2016, 149: 60-67. DOI:10.1016/j.carbpol.2016.04.086.
[2] KUMAR R, SINGH S, SINGH O V. Bioconversion of lignocellulosic biomass: biochemical and molecular perspectives[J]. Journal of Industrial Microbiology and Biotechnology, 2008, 35(5): 377-391. DOI:10.1007/s10295-008-0327-8.
[3] DAS A M, ALI A A, HAZARIKA M P. Synthesis and characterization of cellulose acetate from rice husk: eco-friendly condition[J]. Carbohydrate Polymers, 2014, 112: 342-349. DOI:10.1016/ j.carbpol.2014.06.006.
[4] FERREIRA N L, MARGEOT A, BLANQUET S, et al. Biotechnology and biology trichoderma[M]. Amsterdam: Elsevier, 2014: 245-261.
[5] KUHAD R C, GUPTA R, SINGH A. Microbial cellulases and their industrial applications[J]. Enzyme Research, 2011, 2: 280696. DOI:10.4061/2011/280696.
[6] KUHAD R C, DESWAL D, SHARMA S, et al. Revisiting cellulase production and redefining current strategies based on major challenges[J]. Renewable and Sustainable Energy Reviews, 2016, 55: 249-272. DOI:10.1016/j.rser.2015.10.132.
[7] ZAMBARE V P, BHALLA A, MUTHUKUMARAPPAN K, et al. Bioprocessing of agricultural residues to ethanol utilizing a cellulolytic extremophile[J]. Extremophiles, 2011, 15(5): 611-618. DOI:10.1007/ s00792-011-0391-2.
[8] 邹立扣, 王红宁, 潘欣. 枯草芽孢杆菌整合载体研究进展[J]. 生物技术通讯, 2003, 14(6): 525-527. DOI:10.3969/j.issn.1009-0002.2003.06.015.
[9] ASADA M, YAHATA K, HAKIMI H, et al. Transfection of Babesia bovis by double selection with WR99210 and blasticidin-S and its application for functional analysis of thioredoxin peroxidase-1[J]. PLoS ONE, 2015, 10(5): 575-582. DOI:10.1371/journal.pone.0125993.
[10] HELIANTI I, ULFAH M, NURHAYATI N, et al. Production of xylanase by recombinant Bacillus subtilis, DB104 cultivated in agroindustrial waste medium[J]. HAYATI Journal of Biosciences, 2016, 23(3): 125-131. DOI:10.1016/j.hjb.2016.07.002.
[11] 李春艳, 冯凤兆, 冯露, 等. 野生型枯草芽孢杆菌N4的spizizen转化法优化[J]. 东北农业大学学报, 2015, 42(2): 78-82. DOI:10.3969/ j.issn.1005-9369.2015.02.012.
[12] 陈静, 匡成兵. 纤维素降解真菌的分离筛选[J]. 西南大学学报(自然科学版), 2016, 38(8): 22-26. DOI:10.13718/j.cnki.xdzk.2016.08.004.
[13] TEATHER R M, WOOD P J. Use of Congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen[J]. Applied and Environmental Microbiology, 1982, 43(4): 777-780.
[14] 李青青, 王旭歌, 钟甲丽, 等. 纤维素酶系基因的克隆与序列分析[J]. 江苏农业科学, 2016, 44(3): 40-43. DOI:10.15889/ J.ISSN.1002-1302.2016.03.010.
[15] ZHANG X Z, CUI Z L, HONG Q, et al. High-level expression and secretion of methyl parathion hydrolase in Bacillus subtilis WB800[J]. Applied and Environmental Microbiology, 2005, 71(7): 4101-4103. DOI:10.1128/AEM.71.7.4101-4103.2005.
[16] BLOMBACH B, EIKMANNS B J. Current knowledge on isobutanol production with Escherichia coli, Bacillus subtilis and Corynebacterium glutamicum[J]. Bioengineered Bugs, 2011, 2(6): 346-350. DOI:10.4161/bbug.2.6.17845.
[17] 张婷婷, 马磊. 枯草杆菌启动子P43及Pamy的转录活性[J]. 江苏农业科学, 2014, 42(12): 56-58. DOI:10.15889/j.issn.1002-1302.2014.12.016.
[18] TRUDEAU D L, SMITH M A, ARNOLD F H. Innovation by homologous recombination[J]. Current Opinion in Chemical Biology, 2013, 17(6): 902-909. DOI:10.1016/j.cbpa.2013.10.007.
[19] 聂宇, 乔艳乐, 陈瑶生, 等. 供体同源臂长度对ZFN介导的同源重组效率的影响[J]. 中山大学学报(自然科学版), 2016, 55(4): 100-107. DOI:10.13471/j.cnki.acta.snus.2016.04.017.
[20] HASTY P, RIVERA-PÉREZ J, BRADLEY A. The length of homology required for gene targeting in embryonic stem cells[J]. Molecular and Cellular Biology, 1991, 11(11): 5586-5591.
[21] MELNIKOV A, YOUNGMAN P J. Random mutagenesis by recombinational capture of PCR products in Bacillus subtilis and Acinetobacter calcoaceticus[J]. Nucleic Acids Research, 1999, 27(4): 1056-1062.
[22] 胡海红, 石爱琴, 胡艳华, 等. 枯草芽孢杆菌整合载体的构建及基因组的改造[J]. 浙江理工大学学报, 2010, 27(1): 134-139. DOI:10.3969/j.issn.1673-3851.2010.01.028.
[23] 刘晖. 纤维素酶基因枯草芽孢杆菌工程菌的构建及其酶学性质的初步研究[D]. 武汉: 华中农业大学, 2013: 39-46. DOI:10.7666/ d.Y2394883.
[24] DUNCAN C H, WILSON G A, YOUNG F E. Mechanism of integrating foreign DNA during transformation of Bacillus subtilis[J]. PNAS, 1978, 75(8): 3664-3668.
[25] van PIJKEREN J P, BRITTON R A. High ef ciency recombineering in lactic acid bacteria[J]. Nucleic Acids Research, 2 012, 40(10): e76. DOI:10.1093/nar/gks147.
[26] ARENHART S, JUNIOR S J, FLORES E F, et al. Use of homologous recombination in yeast to create chimeric bovine viral diarrhea virus cDNA clones[J]. Brazilian Journal of Microbiology, 2016, 47(4): 993-999. DOI:10.1016/j.bjm.2016.07.022.
[27] WEN S, YANG J, TAN T. Full-length single-stranded PCR product mediated chromosomal integration in intact Bacillus subtilis[J]. Journal of Microbiological Me thods, 2013, 92(3): 273-277. DOI:10.1016/ j.mimet.2012.11.012.
[28] BARTOSOVA Z, KREJCI L. Nucleases in homologous recombination as targets for cancer therapy[J]. FEBS Letters, 2014, 588(15): 2446-2456. DOI:10.1016/j.febslet.2014.06.010.
[29] 余小霞, 田健, 刘晓青, 等. 枯草芽孢杆菌表达系统及其启动子研究进展[J]. 生物技术通报, 2015, 31(2): 35-44. DOI:10.13560/j.cnki. biotech.bull.1985.2015.02.005.
[30] 杨韵霏, 李由然, 张梁, 等. 细菌麦芽糖淀粉酶在枯草芽孢杆菌中的诱导型异源表达[J]. 微生物学通报, 2016, 44(2): 263-273. DOI:10.13344/j.microbiol.china.160102.
[31] 訾楠, 沈微, 石贵阳, 等. 地衣芽孢杆菌生麦芽糖α-淀粉酶的基因克隆与鉴定[J]. 应用与环境生物学报, 2009, 15(1): 130-133. DOI:10.3724/SP.J.1145.2009.00130.
[32] 张懿翔, 丁若垚, 陈婷, 等. 同源重组整合vgb基因提升枯草芽孢杆菌亚麻脱胶能力[J]. 中国麻业科学, 2015, 37(2): 87-94. DOI:10.3969/ j.issn.1671-3532.2015.02.006.
[33] 王敏辉. 饲用纤维素酶的研究进展[J]. 饲料博览, 2009(11): 27-30. DOI:10.3969/j.issn.1001-0084.2009.11.009.
[34] MIELENZ J R. Ethanol production from biomass: technology and commercialization status[J]. Current Opinion in Microbiology, 2001, 4(3): 324-329. DOI:10.1016/S1369-5274(00)00211-3.
[35] JIA R, MA Q G, FAN Y, et al. The toxic effects of combined a atoxins and zearalenone in naturally contaminated diets on laying performance, egg quality and mycotoxins residues in eggs of layers and the protective effect of Bacillus subtilis biodegradation product[J]. Food and Chemical Toxicology, 2016, 90: 142-150. DOI:10.1016/ j.fct.2016.02.010.
[36] SOBCZAK A, KOZŁOWSKI K. The effect of a probiotic preparation containing Bacillus subtilis ATCC PTA-6737 on egg production and physiological parameters of laying hens[J]. Annals of Animal Science, 2015, 15(3): 711-723. DOI:10.1515/aoas-2015-0040.
Construction of Cellulose Gene Integration Vector of Bacillus subtilis
NIE Libo, WANG Zhanbin, SHI Dunsheng, SONG Yangyang, LI Wang*
(College of Animal Science and Technology, Henan University of Science and Technology, Luoyang 471003, China)
Aim: To obtain an engineered bacterial strain able to express cellulose-degrading enzymes through constructing an integration vector using Bacillus subtilis as the host. Methods: The homologous fragments M1 and M2 were cloned by polymerase chain reaction (PCR) from the genome of B. subtilis LN. The glucosidase gene CelKg, homologous fragments M1 and M2 and the strong promoter P43 were ligated to the pGEM-T vector by T4 DNA Ligase to construct the integrated vector pGEM-Kmpgmt. The vector was then transformed to B. subtilis LN by double crossover homologous recombination method. Results: The integration vector was successfully constructed and integrated into the genome of B. subtilis LN, as veri ed by PCR. Congo red staining indicated that the recombinant B. subtilis could obviously degrade sodium carboxymethyl cellulose in the medium. The cellulase activity from the culture supernatant harvested after 18 h culture of the recombinant strain in a modi ed medium at 37 ℃ with shaking was increased by 115% as compared with the wild-type B. subtilis LN.
homologous recombination; cellulase; Bacillus subtilis
10.7506/spkx1002-6630-201710006
Q784
A
1002-6630(2017)10-0031-06
聂利波, 王占彬, 史敦胜, 等. 枯草芽孢杆菌纤维素酶基因整合载体的构建[J]. 食品科学, 2017, 38(10): 31-36.
DOI:10.7506/spkx1002-6630-201710006. http://www.spkx.net.cn NIE Libo, WANG Zhanbin, SHI Dunsheng, et al. Construction of cellulose gene integration vector of Bacillus subtilis[J]. Food Science, 2017, 38(10): 31-36. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201710006. http://www.spkx.net.cn
2016-08-25
国家自然科学基金青年科学基金项目(31101744);河南省重大科技专项(131100110300)
聂利波(1991—),男,硕士研究生,主要从事动物分子营养研究。E-mail:nielibo1991@163.com
*通信作者:李旺(1976—),男,副教授,博士,主要从事分子营养和饲料生物技术研究。E-mail:liwang@haust.edu.cn

