低频磁场对紫色红曲菌液态发酵产麦角固醇的影响
万云雷,韩红霞,李 利,伍潇洁,高梦祥,2,*
(1.长江大学生命科学学院,湖北 荆州 434025;2.长江大学荆楚特色食品研发中心,湖北 荆州 434025)
低频磁场对紫色红曲菌液态发酵产麦角固醇的影响
万云雷1,韩红霞1,李 利1,伍潇洁1,高梦祥1,2,*
(1.长江大学生命科学学院,湖北 荆州 434025;2.长江大学荆楚特色食品研发中心,湖北 荆州 434025)
探讨低频磁场处理对紫色红曲菌(Monascus purpurcus)发酵产麦角固醇的影响,确定最佳处理条件。分别研究低频磁场强度、处理时间和处理时期对紫色红曲霉液态发酵产麦角固醇的影响规律,探讨在最佳处理条件下,磁场对紫色红曲霉麦角固醇代谢过程的影响和紫色红曲霉的生物量在整个发酵周期的变化,及对紫红曲霉其他主要代谢物的影响。结果表明:低频磁场处理紫色红曲菌的最适条件为磁场强度1.2 mT、处理时间2 d、处理时期在发酵0~2 d,在发酵第12天,麦角固醇产量达到了7.08 mg/g,生物量达到3.2 g/L ,比对照组分别增加了62.5%和31.68%。低频磁场是提高紫色红曲菌生产麦角固醇产量的有效手段,研究为低频磁场辅助微生物发酵,提高有益产物的合成提供了数据支持。
低频磁场;紫色红曲菌;生物量;麦角固醇;液态发酵
麦角固醇(C28H43OH)是合成VD2、可的松、黄体酮的前体原料[1-2],VD2对人体吸收钙、磷有良好的促进效应,尤其是婴幼儿、孕妇和老人[3]。近年来,微生物发酵法已经成为生产麦角固醇的主要方法,其主要菌种有:酵母菌[4-5]、红曲菌[6-7]、青霉[8]和黑曲霉[9]等。谢宗良等[10]采用诱变的酵母菌生产麦角固醇,产量达到0.34 g/L,比诱变前的菌株提高了11.5%。宁玮霁等[11]发现了红曲菌株在优化后的培养基里,其麦角固醇产量可达1 167.1 μg/g。谭艾娟等[12]研究发现,在红曲菌最佳液态发酵工艺条件下,其产麦角固醇产量可达747.6 μg/g。最近几年,科学家们发现低频磁场(频率低于300 Hz)可促进乳酸菌发酵产乳酸链球菌肽的产量提高5 倍[13],啤酒酵母产乙醇的量提高17%[14],黏红酵母生物量提高14%~28%,转化酶的量提高48%~67%[15],黑曲霉发酵产柠檬酸的量和纤维素酶活性分别提高60%和30%[16]。本研究团队也发现了低频磁场对紫色红曲菌固态发酵时生物量、培养基消耗[17]、色素[18]和γ-氨基丁酸合成[19]的影响规律。本实验在此基础上,进一步研究低频磁场对紫色红曲菌产麦角固醇的影响,为低频磁场促进紫色红曲菌产物的合成提供技术支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
紫色红曲菌(Monascus purpurcus)由长江大学生命科学学院微生物实验室提供。
1.1.2 培养基
斜面培养基:蔗糖30 g、酵母膏5.0 g、琼脂15 g、KCl 0.5 g、NaNO33.0 g、K2HPO41.0 g、FeSO4·7H2O 0.01 g、MgSO4·7H2O 0.5 g,蒸馏水定容1 000 mL,pH值自然。种子培养基:可溶性淀粉 6 g、黄豆粉 0.5 g、KNO30.25 g、ZnSO40.05 g、MgSO40.05 g,蒸馏水定容1 000 mL,pH值自然。液体发酵培养基:土豆200 g、葡萄糖20 g,pH值自然,蒸馏水定容1 000 mL,每支试管装10 mL。以上培养基灭菌条件为121 ℃、25 min[20]。
乙腈(色谱纯) 美国赛默飞世尔科技公司;麦角固醇标准品 上海源叶生物科技有限公司;其他有机试剂均为国产分析纯。
1.2 仪器与设备
1200高效液相色谱仪 美国Agilent公司;低频磁场处理设备 自行设计研制。
1.3 方法
1.3.1 菌种培养
将保藏紫色红曲菌菌种活化后,接种于斜面培养基上,于30 ℃恒温培养7 d后,再挑取斜面菌种,接种于种子培养基100 mL中,在150 r/min、30 ℃恒温培养48 h。等到种子液中孢子浓度大约为104个/mL时,将孢子液接种于液态培养基中,30 ℃培养11 d[21]。
1.3.2 磁场处理设备
低频磁场处理设备为本研究团队自行设计研制,具体结构和功能见文献[18]。
1.3.3 磁场处理
将接种的发酵液,分别在不同磁场强度、处理时间、发酵时间段进行处理后,继续发酵培养至第11天,分离得到菌丝体,测定麦角固醇含量。
1.3.4 麦角固醇、γ-氨基丁酸、洛伐他汀和橘霉素产量测定[11,19-21]
采取分光光度法测定麦角固醇产量,称取适量的麦角固醇标准品溶于乙醚,配制成0~20.00 μg/mL不同质量浓度的标准溶液,测定各标准溶液在282 nm波长处的吸光度,得出各标准溶液的吸光度与其质量浓度的标准曲线[12]。样品中麦角固醇含量的测定:将发酵液于4 000 r/min离心,至发酵液澄清,将沉淀物于40 ℃处理3~5 h,称取一定烘干物(0.02 g左右)于50 mL离心管中,加入15 mL的300 g/L KOH溶液和5 mL的40%乙醇溶液,90 ℃水浴皂化3 h后冷却至室温,加入10 mL乙醚充分振荡,静置10 min,取乙醚层用95%酒精稀释,在282 nm波长处测定溶液吸光度。由标准曲线得出浸提液质量浓度,计算红曲菌干菌丝的麦角固醇产量(mg/g)。
采取分光光度法测定γ-氨基丁酸产量,取1 mL发酵液,加入0.5 mL硼酸盐缓冲液(0.2 mol/L、pH 10),摇匀,加入2 mL 5%苯酚溶液,摇匀,再加质量分数6%次氯酸钠溶液1 mL,摇匀,放置于沸水浴中10 min,待溶液变成蓝绿色后,冷却至室温,加入2.0 mL 60%酒精,在640 nm波长处测定溶液的吸光度。
采取分光光度法测定洛伐他汀产量,将发酵液全部转入离心管中,匀浆机搅碎后,加入10 mL乙酸乙酯,完全混合后静置分层,取上清液重复几次至上清液无色为止,合并上清液,真空干燥仪45 ℃浓缩至干,用少许苯溶解干燥物,待苯溶液挥发后,再用95%乙醇溶液溶解至一定体积,在238 nm波长处测定溶液吸光度。
采用液相色谱测定橘霉素产量,取发酵样品,滤纸过滤,取一定体积的发酵液,加入等体积的萃取液(甲苯-乙酸乙酯-甲酸体积比7∶3∶1),充分萃取,10 000 r/min离心10 min,取上清液,0.45 μm滤膜过滤,高效液相色谱测定其浓度,检测条件:二极管阵列检测器,检测波长330 nm,流动相为 V(乙腈)∶V(水)=50∶50,水用磷酸调pH 2.5;流速1 mL/min。
1.3.5 紫色红曲菌代谢麦角固醇的变化
在前期得出的最适处理条件下,在紫色红曲菌整个发酵周期里,每隔2 d测定一次麦角固醇的含量,分别得到紫色红曲菌在低频磁场处理和未处理时的麦角固醇在不同发酵时间的产量。
1.3.6 紫色红曲菌生物量的变化
在前期得出的最适处理条件下,在整个发酵周期里,每隔2 d用菌丝干重法测定发酵液中的生物量,分别得到紫红曲菌在低频磁场处理和未处理时的生长曲线。
1.3.7 最佳磁场处理条件对紫红曲菌其他主要代谢产物的影响
根据上述合适的磁场处理强度、处理时间及处理周期对红曲菌进行培养至发酵终点,测定其他主要代谢产物量的变化,并和对照组进行比较。
1.4 数据处理
利用SAS软件对实验数据分别进行成组数据等方差显著性t检验(磁场强度实验,P<0.05)和成对数据等方差显著性t检验(处理时间和处理时期实验,P<0.05)。
2 结果与分析
2.1 麦角固醇标准曲线的绘制
麦角固醇标准溶液在波长282 nm处的吸光度与其质量浓度有良好的线性关系,二者的回归方程为:y=0.031 9x+0.062 9,R2=0.999 3。
2.2 磁场强度对紫色红曲菌发酵产麦角固醇的影响
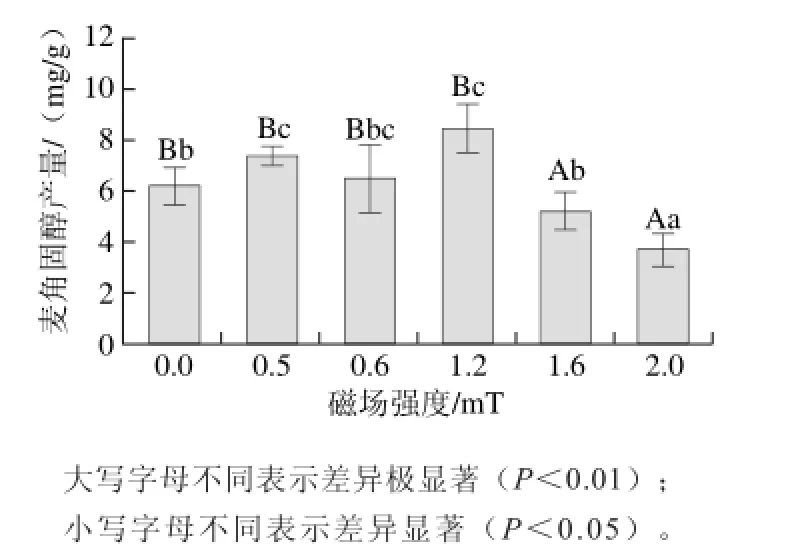
图 1 磁场强度对麦角固醇产量的影响Fig. 1 Effect of magnetic field intensity on ergosterol production
麦角固醇产量随磁场强度(红曲菌发酵液处理11 d)的变化结果见图1,可以看出,磁场强度为0.5 mT和1.2 mT时,都有促进效应,而磁场强度1.2 mT时,麦角固醇产量最高,并与对照和其他场强处理有显著差异,磁场强度为0.6 mT时,对麦角固醇产量与对照相比没有显著性差异。磁场强度为1.6 mT和2.0 mT时均有显著的抑制效应。因此,选取1.2 mT为后期实验的磁场处理强度。
2.3 磁场处理时间对紫色红曲菌麦角固醇产量的影响
将红曲菌发酵液置于1.2 mT磁场强度,分别处理2、4、6 d和8 d,图2呈现出各磁场处理均表现出促进效应,且各处理组与其对照组的麦角固醇产量都有显著差异。但处理2 d的促进效应最强,处理组麦角固醇产量是对照组的1.65 倍。因此,确定处理2 d为最适磁场处理时间。
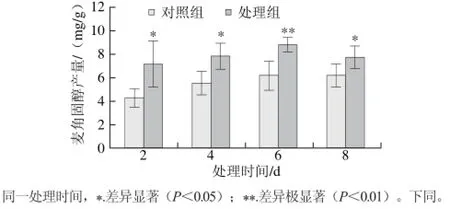
图 2 磁场处理时间对麦角固醇产量的影响Fig. 2 Effect of magnetic field exposure duration on ergosterol production
2.4 磁场处理时期对紫色红曲菌麦角固醇产量的影响

图 3 磁场处理时期对麦角固醇产量的影响Fig. 3 Effect of fermentation stage when magnetic field exposure was performed on ergosterol production
将红曲菌发酵液在1.2 mT的磁场强度,分别于发酵的不同时间段处理2 d,图3显示出处理组与对照组的麦角固醇产量在各处理时期都有所增加,而在0~2 d,增加效果最明显,处理组麦角固醇产量是对照组的1.6 倍。0~2 d是紫色红曲菌对数生长的前期,在这一时期,菌种开始大量繁殖,而麦角固醇位于菌丝体细胞膜中,因此,有利于菌繁殖也有利于麦角固醇的合成。也表明菌种在大量繁殖初期对外加磁场的反应更敏感。麦角固醇是主要的酵母质膜中的甾醇组件[22]。麦角固醇含量在维持细胞完整性和稳定性起着重要的作用[23]。所以,麦角固醇产量与细胞生长有关。
2.5 最适磁场条件对紫色红曲菌麦角固醇代谢过程的影响
在发酵的0~2 d用1.2 mT的低频磁场处理的条件下,紫色红曲菌在处理和未处理时的发酵代谢麦角固醇的动力学如图4所示。处理组与对照组麦角固醇产量的动力学呈现的趋势是一致的,但处理组在磁场处理后的曲线斜率明显增大,磁场处理使得麦角固醇的增长率由0.43 mg/(g·d)增加到0.74 mg/(g·d),麦角固醇的增长率提高了73.1%,产量在发酵第12天达到了7.08 mg/g,比对照组增加了62.5%。结果表明,紫色红曲菌经磁场在发酵的0~2 d处理后,麦角固醇产量的增长率明显高于对照组,而磁场没有必要在整个发酵期间全程处理。类似的结果在乳酸菌发酵产乳酸链球菌肽[13]、啤酒酵母产乙醇的量[14]和黏红酵母产转化酶[15]也有报道。

图 4 紫色红曲菌产麦角固醇的发酵动力学Fig. 4 Fermentation kinetics for ergosterol production by Monascus purpurcus
上述研究结果表明,低频磁场可以作为提高紫色红曲菌提高麦角固醇产量的一种有效方法。这种方法可以达到或高于其他方法的效果,如突变菌种法[10]、优化培养基法[11]和优化发酵条件法[12]等。这些研究结果表明,人们可通过调整低频磁场的处理条件,来实现促进微生物合成有益产物而抑制有害产物,这也正是低频磁场辅助发酵技术的优势所在。
2.6 最适磁场处理条件下紫色红曲菌生物量在整个发酵周期的变化
在整个发酵周期中,每隔2 d对紫色红曲菌的发酵液进行取样,用菌丝干重法测定发酵液中的生物量,处理组为在紫色红曲菌发酵培养的0~2 d用1.2 mT的低频磁场处理然后培养至发酵终点,由图5可知,处理组与对照组在发酵周期的生物量变化趋势相同,都表现为先缓慢增长,接着快速增长,最后趋于缓慢降低。但处理组在磁场处理后的曲线斜率明显增大,磁场处理使得生物量增长率由0.246 g/(g·d)增加到0.333 g/(g·d),生物量的增长率提高了35.53%,生物量在发酵第12天达到了3.2 g/L,比对照组增加了31.68%。结果表明,在此磁场处理条件下,磁场促进了麦角固醇的代谢,并促进了红曲菌的生长。

图 5 磁场处理前后生物量随发酵时间的变化Fig. 5 Biomass of Monascus purpureus during and after magnetic field exposure
麦角固醇作为真菌生物量指示剂,是细胞膜上的一种固醇类化合物,专一性很强,可以通过测定麦角固醇的含量来推测真菌生物量,因此不难看出,生物量和麦角固醇存在一定正比关系[24-25]。以上研究结果再次论证了此观点。
2.7 最佳磁场处理条件对紫色红曲菌其他主要代谢产物的影响
以不经磁场处理为对照组,将紫色红曲菌发酵培养的0~2 d用1.2 mT的低频磁场处理,然后培养至发酵11 d,测得发酵液中的γ-氨基丁酸、洛伐他汀和橘霉素的产量,由图6可知,最佳磁场条件下洛伐他汀和橘霉素产量与对照组相比没有 明显差异,而γ-氨基丁酸产量提高了37.7%,该结果表明,最适磁场条件下没有促进红曲菌有害代谢产物橘霉素的产生,反而促进了有益产物γ-氨基丁酸的产生。在磁场条件下,促进麦角固醇及γ-氨基丁酸等有益产物的产生且对有害代谢物橘霉素没有造成影响,可能是磁场干扰了代谢途径中的一些关键酶的活性才会出现这样的现象。

图 6 最适磁场处理条件下γ-氨基丁酸、洛伐他汀和橘霉素产量Fig. 6 Yields of GABA, lovastation and citrinin under optimal magnetic field treatment conditions
3 结 论
紫色红曲菌在发酵培养的0~2 d经1.2 mT的低频磁场处理后,麦角固醇和生物量的增长率分别提高了73.1%和35.53%。发酵第12天时,麦角固醇产量达到了7.08 mg/g,生物量达到3.2 g/L,比对照组分别增加了62.5%和31.68%。在最适磁场条件下,没有促进红曲菌有害代谢产物橘霉素的产生,反而促进了有益产物γ-氨基丁酸的产生。
微生物次生代谢产物的产生与多种因素有关,微观上受基因调控[26],宏观上受到环境因素如培养基条件、温度、光照等影响[17]。由对照组和实验组结果可看出,紫红曲菌受到磁场影响是磁场强度、作用时间和作用时期三者综合作用的结果,一方面体现了磁场生物效应的多态性、多因素和联合作用,另一方面也与红曲菌本身生物学特性有关。关于磁场对红曲菌产麦角固醇的作用机制还有待进一步研究。
参考文献:
[1] 张照明, 袁利明, 孙延红. 国内维生素D2研究与产业化现状[J].精细与专用化学品, 2007, 15(1): 1-3; 10. DOI:10.3969/ j.issn.1008-1100.2007.01.001.
[2] 苗景赟, 邓利, 谭天伟. 麦角固醇连续光转化生产维生素D2新工艺[J]. 北京化工大学学报, 2003, 30(3): 39-41. DOI:10.3969/ j.issn.1671-4628.2003.03.010.
[3] 韩庆雪. 麦角固醇提取工艺的中试放大研究[D]. 天津: 天津大学, 2007.
[4] BANAT I M, NIGAM P, SINGH D, et al. Review: ethanol production at elevated temperatures and alcohol concentrations. Ⅰ. Yeasts in general[J]. World Journal of Microbiology and Biotechnology, 1998, 14(6): 809-821. DOI:10.1023/A:1008852424846.
[5] 惠丰立, 魏明卉, 褚学英. 产麦角固醇酵母菌株的筛选及发酵条件优化[J]. 中国医药工业杂志, 2004, 35(3): 138-140. DOI:10.3969/ j.issn.1001-8255.2004.03.006.
[6] 张丽丽, 谭艾娟, 刘爱英, 等. 红曲霉中麦角固醇皂化条件的优化[J]. 山地农业生物学报, 2010, 29(2): 143-146. DOI:10.3969/ j.issn.1008-0457.2010.02.011.
[7] 孙佰申, 周立平, 陈旭峰, 等. HPLC法测定红曲霉发酵样品中麦角固醇的含量[J]. 中国食品添加剂, 2004(2): 89-92. DOI:10.3969/ j.issn.1006-2513.2004.02.023.
[8] 张鹏荣. 产黄青霉固体发酵产麦角固醇的研究[D]. 西安: 西安建筑科技大学, 2009. DOI:10.7666/d.d193796.
[9] 柯亚萍. 黑曲霉固体发酵产麦角固醇的研究[D]. 西安: 西安建筑科技大学, 2008. DOI:10.7666/d.d194634.
[10] 谢宗良. 产麦角固醇酵母菌的筛选、诱变与发酵条件优化[D].保定: 河北大学, 2011. DOI:10.7666/d.y1634619.
[11] 宁玮霁, 谭艾娟, 刘爱英, 等. 红曲霉产麦角固醇液体培养基筛选[J]. 山地农业生物学报, 2008, 27(3): 241-246. DOI:10.3969/ j.issn.1008-0457.2008.03.011.
[12] 谭艾娟, 宁玮霁, 刘爱英, 等. 红曲霉产麦角固醇液体发酵条件优化[J]. 食品科学, 2008, 29(9): 434-436. DOI:10.3321/ j.issn:1002-6630.2008.09.099.
[13] ALVAREZ D A, PEREZ V H, JUSTO O R, et al. Effect of the extremely low frequency magnetic field on nisin production by Lactococcus lactis subsp. lactisusing cheese whey permeate[J]. Process Biochemistry, 2006, 41: 1967-1973. DOI:10.1016/ j.procbio.2006.04.009.
[14] PEREZ V H, REYES A F, JUSTO O R, et al. Bioreactor coupled with electromagnetic field generator: effects of extremely low frequency electromagnetic fields on ethanol production by Saccharomyces cerevisiae[J]. Biotechnology Progress, 2007, 23: 1091-1094. DOI:10.1021/bp070078k.
[15] CANLI O, ERDAL S, TASKIN M, et al. Effects of extremely low magnetic field on the production of invertase by Rhodotorula glutinis[J]. Toxicology and Industrial Health, 2011, 27: 35-39. DOI:10.1177/0748233710380219.
[16] GAO M X, ZHANG J L, FENG H. Low-frequency magnetic field effects on metabolite of Aspergillus niger[J]. Bioelectromagnetics, 2011, 32: 73-78. DOI:10.1002/bem.20619.
[17] 邓光武, 夏帆, 王洁雅, 等. 低频交变磁场对红曲霉固态发酵生物量的影响[J]. 农业机械学报, 2012, 43(6): 128-132. DOI:10.6041/ j.issn.1000-1298.2012.06.024.
[18] ZHANG J L, ZENG D J, XU C, et al. Effect of low-frequency magneticeld on formation of pigments of Monascus purpureus[J]. European Food Research and Technology, 2015, 240: 577-582. DOI:10.1007/s00217-014-2358-x.
[19] 万云雷, 韩红霞, 李利, 等. 低频磁场对紫色红曲菌固态发酵产γ-氨基丁酸的影响[J]. 中国农业科技导报, 2015, 17(5): 94-98. DOI:10.13304/j.nykjdb.2015.478.
[20] 李利. 红色红曲菌G蛋白信号途径相关基因的克隆及功能研究[D].武汉: 华中农业大学, 2011.
[21] 曾冬杰. 紫红曲霉在低频磁场条件下主要固态发酵产物的代谢规律[D]. 荆州: 长江大学, 2013.
[22] NILSSON K, BJURMAN J. Estimation of mycelial biomass by determination of the ergosterol content of wood decayed by coniophora puteana and fomes fomentarius[J]. Material Und Organismen, 1990, 25: 275-283.
[23] DAWSON-ANDOH B E. Ergosterol content as a measure of biomass of potential biological control fungi in liquid cultures[J]. Holz als Rohund Werkstoff, 2002, 60: 115-117. DOI:10.1007/s00107-001-0274-9.
[24] 宁玮霁. 红曲霉液态发酵法高产麦角固醇的研究[D]. 贵阳: 贵州大学, 2008.
[25] 习兴梅, 曾光明, 郁红艳, 等. 真菌生物量指示剂麦角固醇的分离及测定方法[J]. 微生物学通报, 2006, 33(3): 128-132. DOI:10.13344/ j.microbiol.china.2006.03.026.
[26] LI L, SHAO Y, LI Q, et al. Identification of Mga1, a G-protein α-subunit gene involved in regulating citrinin and pigment production in Monascus ruber M7[J]. Fems Microbiology Letters, 2010, 308(2): 108-114. DOI:10.1111/j.1574-6968.2010.01992.x.
Effect of Low-Frequency Magnetic Field on Ergosterol Production by Monascus purpureus in Liquid-State Fermentation
WAN Yunlei1, HAN Hongxia1, LI Li1, WU Xiaojie1, GAO Mengxiang1,2,*
(1. College of Life Science, Yangtze University, Jingzhou 434025, China; 2. Jingchu Food Research and Development Center, Yangtze University, Jingzhou 434025, China)
We explored the effects of low-frequency magneticeld (LF-MF) on the production of ergosterol by fermentation with Monascus purpurcus and further determined the optimal LF-MF treatment conditions such as LF-MF intensity, time treatment time and the fermentation stage when M. purpurcus was treated with LF-MF on ergosterol production by liquid-state fermentation of M. purpurcus. We also investigated the effects of LF-MF on the metabolism of ergosterol by M. purpurcus, and examined the change in M. purpurcus biomass throughout the fermentation period and the effects on other main metabolites of M. purpurcus under optimal treatment conditions. Results showed that ergosterol yield was 7.08 mg/g and the biomass of M. purpurcus was 3.2 g/L on the 12thday of fermentation, which were respectively increased by 62.5% and 31.68% as compared to that of the control when M. purpurcus was treated by LF-MF at an intensity of 1.2 mT during therst two days of fermentation. Consequently, LF-MF was an effective method to enhance ergosterol yield. This result may provide evidence supporting the use of LF-MF to improve the production of bene cial microbial metabolites by fermentation.
low-frequency magneticeld (LF-MF); Monascus purpurcus; biomass; ergosterol; liquid-state fermentation
10.7506/spkx1002-6630-201710007
Q937;TS201
A
1002-6630(2017)10-0037-05
万云雷, 韩红霞, 李利, 等. 低频磁场对紫色红曲菌液态发酵产麦角固醇的影响[J]. 食品科学, 2017, 38(10): 37-41.
DOI:10.7506/spkx1002-6630-201710007. http://www.spkx.net.cn
WAN Yunlei, HAN Hongxia, LI Li, et al. Effect of low-frequency magnetic field on ergosterol production by Monascus purpureus in liquid-state fermentation[J]. Food Science, 2017, 38(10): 37-41. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201710007. http://www.spkx.net.cn
2016-07-02
国家自然科学基金面上项目(31371829)
万云雷(1992—),男,硕士研究生,研究方向为农副产品的微生物利用。E-mail:ylwan1992@sina.com
*通信作者:高梦祥(1971—),男,教授,博士,研究方向为微生物发酵和农副产品深加工。E-mail:mxgao0398@163.com

