C型钠尿肽对肾缺血再灌注大鼠肾功能和肾组织细胞凋亡的影响及机制
朴敏虎,金秀男,李香丹,崔逢德,许东元
(1延边大学附属医院,吉林延吉133000;2延边大学医学院)
C型钠尿肽对肾缺血再灌注大鼠肾功能和肾组织细胞凋亡的影响及机制
朴敏虎1,金秀男1,李香丹2,崔逢德2,许东元2
(1延边大学附属医院,吉林延吉133000;2延边大学医学院)
目的 观察C型钠尿肽(CNP)对肾缺血再灌注损伤大鼠肾功能、肾组织细胞凋亡的影响,并探讨其机制。方法 将24只雄性Wistrar大鼠随机分为Sham组、IR组和CNP组,每组8只。各组大鼠均摘除左侧肾脏,IR组和CNP组用无创性小血管夹夹闭右肾动静脉,45 min后取下血管夹恢复肾脏血供,并分别于夹闭右肾动静脉的同时即刻持续缓慢输注生理盐水约2 mL、CNP 0.2 μmol/(kg·min) 至再灌注2 h;Sham组不夹闭右肾动静脉。再灌注24 h后取血测定血清肌酐(Cr)、尿素氮(BUN),取右肾以ELISA法测定肾组织环磷酸鸟苷(cGMP),TUNEL染色检测肾脏织的凋亡细胞,Western blot法检测肾脏组织蛋白激酶B(Akt) 和β糖原合成酶激酶3β(GSK-3β)蛋白及其磷酸化蛋白。结果 与Sham组比较,IR组大鼠血清Cr和BUN水平均升高(P均<0.01),肾组织cGMP浓度降低、细胞凋亡率升高(P均<0.05),肾组织中Akt、GSK-3 蛋白磷酸化水平均降低(P均<0.01);与IR组比较,CNP组大鼠血清Cr和BUN水平均降低(P均<0.05),肾组织cGMP浓度升高、细胞凋亡率降低(P均<0.05),肾组织中Akt、GSK-3 蛋白磷酸化水平均升高(P均<0.01)。结论 CNP减轻肾脏缺血再灌注大鼠肾功能损伤及肾脏组织细胞凋亡,其机制可能与提高肾组织cGMP水平,进而提高Akt和GSK-3β蛋白磷酸化有关。
急性肾功能衰竭;缺血再灌注;C型钠尿肽;肾功能;细胞凋亡;蛋白激酶B;糖原合成酶激酶3β;大鼠
肾缺血再灌注损伤是急性肾功能衰竭的主要原因之一,也是肾移手术、失血和休克时发生的并发症。已有研究[1]表明,随着肾脏血流恢复导致氧化应激继发的细胞凋亡是肾缺血再灌注损伤的重要因素。PI3K/Akt信号通路是重要的细胞内信号转导通路,该通路失活可增加缺血再灌注引起的肾组织损伤[2,3]。糖原合成酶激酶3β(GSK-3β)在组织保护中起重要的作用,Akt活化后通过调节其下游的GSK-3β蛋白磷酸化抑制细胞凋亡。C型钠尿肽(CNP)是重要的钠尿肽家族成员,通过环磷酸鸟苷(cGMP)/蛋白激酶G(PKG)信号通路发挥生物学效能。我们前期研究发现CNP可有效减轻缺血再灌注损伤的肾组织氧化应激反应[4],但是其对肾组织细胞凋亡的影响及机制尚不清楚。2014年9月~2016年6月,我们观察了CNP对肾缺血再灌注损伤大鼠肾功能、肾组织细胞凋亡及Akt和GSK-3β蛋白磷酸化的影响。现报告如下。
1 材料与方法
1.1 材料 健康Wistar雄性大鼠,200~250 g,清洁级,购于延边大学实验动物中心;CNP为Sigma公司产品,全自动生化分析仪(日立7150),cGMP测试盒为R&D公司产品,TUNEL试剂盒购于Promega公司,蛋白抗体Akt、p-Akt、GSK-3β、p-GSK-3β、β-actin购于Santa Cruz公司。
1.2 实验方法
1.2.1 实验分组及造模处理 将24只大鼠随机分为Sham组、IR组和CNP组,每组8只。用戊巴比妥钠(50 mg/kg)腹腔注射麻醉,分离右侧股静脉并插管以备静脉输液。于背侧正中切开约2 cm,剥离、摘除左肾避免健侧代偿,分离右肾动脉、静脉。IR组和CNP组用无创性小血管夹夹闭右肾动静脉,45 min后取下血管夹恢复肾脏血供,并于夹闭右肾动静脉的同时分别持续缓慢输注生理盐水2 mL、CNP 0.2 μmol/(kg·min) 至再灌注2 h;Sham组不夹闭右肾动静脉。肾组织由动脉夹闭后颜色变暗而再灌注后变红视为缺血再灌注模型制备成功。
1.2.2 血清BUN、Cr检测 再灌注24 h后,各组大鼠腹主动脉采血;以3 500 r/min离心15 min,取上清,用全自动生化分析仪检测血清BUN、Cr。
1.2.3 肾组织cGMP检测 采血后取右肾,参考文献[5]提取肾组织中cGMP,ELISA法测定cGMP。
1.2.4 肾组织细胞凋亡观察 4%多聚甲醛固定包埋,制备石蜡切片;按TUNEL试剂盒说明书染色,荧光显微镜下观察阳性细胞,计算细胞凋亡率。
1.2.5 肾组织Akt和GSK-3β蛋白磷酸化检测 取冻存的肾组织约100 mg,添加细胞裂解缓冲液和苯甲磺酰氟后充分匀浆,4 ℃下静置30 min;经100 ℃煮沸5 min变性,迅速转移到4 ℃环境下静置1~2 min;以13 000 r/min离心10 min后取上清液,用BCA试剂通过比色法进行蛋白定量。提取的蛋白质经SDS-PAEG胶分离后,转移到聚偏二氟乙烯膜上;加入相关一抗Akt、p-Akt、GSK-3β、p-GSK-3β、β-actin,4 ℃孵育过夜;经辣根过氧化物酶孵育2 h后,用ECM试剂盒在暗室爆光。采用IPP软件测量条带灰度值,以目的条带与β-actin条带的灰度值比值表示目的蛋白的相对表达量,以p-Akt/Akt、p-GSK-3 /GSK-3 表示Akt和GSK-3β蛋白磷酸化水平。
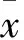
2 结果
2.1 各组大鼠血清Cr和BUN水平比较 见表1。
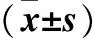
表1 各组大鼠血清Cr和BUN水平比较
注:与Sham组比较,*P<0.01;与IR组比较,#P<0.05。
2.2 各组大鼠肾组织cGMP浓度和细胞凋亡率比较 见表2。
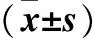
表2 各组大鼠肾组织cGMP浓度和细胞 凋亡率比较
注:与Sham组比较,*P<0.05;与IR组比较,#P<0.05。
2.3 各组大鼠肾组织中Akt、GSK-3 蛋白磷酸化水平比较 见表3。
3 讨论
肾脏为高灌注器官,对缺血非常敏感,极易受到损伤。肾缺血再灌注损伤引起的病理改变主要表现 为皮髓质交界部的肾小管细胞发生凋亡,因此认为肾小管上皮细胞凋亡是缺血再灌注后引起肾小管坏死的一个重要原因。CNP作为钠尿肽家族,通过自分泌或旁分泌作用于血管及相关组织。CNP广泛分布在肾组织中,Terada等[6]用RT-PCR检测到CNP mRNA在肾脏中有表达,Suzuki等[7]用实验证实了正常生理状态下的鼠肾实质以及血管内皮细胞、巨噬细胞等均可产生CNP。CNP在功能性肾脏衰竭患者尿液中增加,且尿液CNP浓度与血肌酐水平呈正相关[8],提示CNP与肾功能衰竭关系密切。本研究发现,应用CNP能够降低大鼠血清BUN和Cr水平,抑制肾组织细胞凋亡,提示CNP可抑制肾缺血再灌注引起的肾组织细胞凋亡。cGMP是细胞内第二信使,通过细胞膜上的cGMP门控离子通道、cGMP依赖性的磷酸二酯酶及蛋白激酶G(PKG),参与血管扩张和缓解血压等。CNP主要与其受体NPRB结合后,活化鸟苷酸环化酶,增加体内cGMP的生成,cGMP进一步作用于下游的PKG参与减轻组织损伤。研究表明,cGMP/PKG信号通路保护缺血再灌注损伤的机制之一是抑制细胞凋亡。姚建等[9]应用不同浓度的ANP、BNP、CNP刺激系膜细胞,观察系膜细胞产生cGMP的量,发现生成cGMP的能力依次为CNP>ANP≥BNP。本实验结果显示,CNP能有效提高肾组织中cGMP水平,与IR组相比,CNP组的肾组织细胞凋亡率明显降低,提示CNP可激活cGMP/PKG信号通路抑制细胞凋亡。
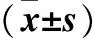
表3各组大鼠肾组织中Akt、GSK-3 蛋白磷酸化 水平比较
注:与Sham组比较,*P<0.05;与IR组比较,#P<0.05。
PI3K/Akt信号通路的激活通过调控胞内钙浓度、线粒体膜稳定性以及细胞凋亡发挥组织细胞保护作用,多种生物活性因子通过此信号途径的激活发挥保护作用[10,11]。研究表明,PI3K/Akt 信号途径的激活在保护缺血后再灌注引起的心、肝和肾等多种组织的损伤中发挥重要作用[12~14]。Akt是一种丝氨酸或苏氨酸蛋白激酶,磷酸化后被激活的Akt发挥广泛的生物学效应,在组织缺血后的适应中对细胞存活和凋亡中起重要作用。GSK-3β是丝氨酸/苏氨酸类蛋白激酶,在控制细胞凋亡信号通路上有重要作用。研究[15]表明,cGMP/PKG信号通路的激活与PI3K/Akt 通路的激活有关,而GSK-3β是PI3K/Akt 的下游底物。因此,GSK-3β也可能是cGMP /PKG 信号通路的作用底物。本研究观察到CNP组与IR组相比,Akt和GSK-3β蛋白磷酸化明显增高,提示CNP通过cGMP/PKG信号通路促进Akt和GSK-3β磷酸化,而Akt/GSK-3β是CNP抑制肾缺血再灌注损伤的重要信号途径之一。
综上所述,CNP 具有抑制肾缺血再灌注大鼠肾组织细胞凋亡、改善肾功能的作用。其机制可能与提高肾组织cGMP水平,进而有效提高Akt和GSK-3β蛋白磷酸化有关。
[1] Zhong D, Wang H, Liu M, et al. Ganoderma lucidum polysaccharide peptide prevents renal ischemia reperfusion injury via counteracting oxidative stress[J]. Sci Rep, 2015,5:16910.
[2] Liu HB, Meng QH, Huang C, et al. Nephroprotective effects of polydatin against ischemia/reperfu- sion injury: a role for the PI3K/Akt signal pathway[J]. Oxid Med Cell Longev, 2015,2015:362158.
[3] Salaru DL, Arsenescu-Georgescu C, Chatzikyrkou C, et al. Midkine, a heparin-binding growth factor, and its roles in atherogenesis and inflammatory kidney diseases[J]. Nephrol Dial Transplant, 2016,31 (11):1781-1787.
[4] 金秀男,丁大植,陈英,等.CNP预处理对大鼠肾缺血再灌注损伤的影响及机制探讨[J].山东医药,2011,51(22):30-31.
[5] Jin X, Zhang Y, Li X, et al. C-type natriuretic peptide ameliorates ischemia/reperfusion-induced acute kidney injury by inhibiting apoptosis and oxidative stress in rats[J]. Life Sci, 2014,117(1):40-45.
[6] Terada Y, Tomita K, Nonoguchi H, et al. PCR localization of C-type natriuretic peptide and B-type receptor mRNAs in rat nephron segments[J]. Am J Physiol, 1994,267(2 Pt 2):215-222.
[7] Suzuki E, Hirata Y, Hayakawa H, et al. Evidence for C-type natriuretic peptide production in the rat kidney[J]. Biochem Biophys Res Commun, 1993,192(2):532-538.
[8] Gülberg V, MUller S, Henriksen JH, et al. Increased renal production of C-type natriuretic peptide (CNP) in patients with cirrhosis and functional renal failure[J]. Gut, 2000,47(6):852-857.
[9] 姚建,曹红娣,王伟.人肾小球系膜细胞利钠肽受体表达的研究[J].上海第二医科大学学报,1998,18(17):479-480.
[10] Zhu Yi, Pereira Renata O, O′Neill Brian T, et al. Cardiac PI3K-Akt impairs insulin-stimulated glucose uptake independent of mTORC1 and GLUT4 translocation[J]. Mol Endocrinol, 2012,27(1):172-184.
[11] 朱美霞,刘晓霞,康娅,等.罗布麻总黄酮通过PI3K/Akt/GSK3β抑制H2O2诱导的EA.hy926 凋亡机制研究[J].生命科学研究,2016,20(2):145-152.
[12] Yao H, Han X, Han X. The cardioprotection of the insulin-mediated PI3K/Akt/mTOR signaling pathway[J]. Am J Cardiovasc Drugs, 2014,14(6):433-442.
[13] 杨牟,王涛,张居文,等.缺血后适应信号通路的研究进展[J].青岛大学医学院学报,2014,50(1):89-91.
[14] 朱敏杰,郝海英,陈洁,等.葛根素对肾缺血再灌注大鼠肾脏组织细胞凋亡的影响及其机制探讨[J].中国实验方剂学杂志,2016,22(23):127-132.
[15] Xu Z, Lee S, Han J. Dual role of cyclic GMP in cardiac cell survival[J]. Int J Biochem Cell Biol, 2013,45(8):1577-1584.
Effects of CNP on renal function and renal apoptosis in rats withrenal ischemia-reperfusion injury
PIAOMinhu1,JINXiunan,LIXiangdan,CUIFengde,XUDongyuan
(1AffiliatedHospitalofYanbianUniversity,Yanji133000,China)
Objective To observe the effects of C-type natriuretic peptide (CNP) on renal function and renal tissue apoptosis in rats with renal ischemia-reperfusion (IR) injury and its mechanisms involved. Methods Twenty-four male Wistrar rats were randomly divided into the Sham group, IR group and CNP group (n=8). All the rats were left unilaterally nephrectomized. In the IR group and CNP group, we nipped the right renal artery and vein with noninvasive small vascular clip for 45 min. CNP [0.2 μg/(kg·min)] and 2 mL physiological saline was infused immediately and slowly at the start of a 45-min renal ischemia for 2 h in the two groups, respectively. The right renal artery and vein in the Sham group was not treated by the clip. Rats were killed to obtain the blood at 24 h after I/R. The serum creatinine (Cr) and urea nitrogen (BUN) was measured, cyclic guanosine monophosphate (cGMP) in right renal tissues was measured by ELISA, and the apoptotic cells in kidney tissues was detected by TUNEL staining. The renal tissue protein kinase B (Akt), β glycogen synthase kinase 3β (GSK-3β) protein and their phosphorylated protein was measured by Western blotting. Results Compared with the Sham group, the levels of serum Cr and BUN were significantly increased (bothP<0.01), the concentration of cGMP in renal tissues was decreased, and the apoptosis rate was increased (bothP<0.05), the protein phosphorylation levels of Akt and GSK-3β in the renal tissues were decreased in the IR group (bothP<0.05). Compared with the IR group, the levels of serum Cr and BUN were decreased (bothP<0.05), the concentration of cGMP was increased in the renal tissues and the apoptosis rate was decreased (bothP<0.05), the protein phosphorylation levels of Akt and GSK-3β in renal tissues were increased in the CNP group (bothP<0.01). Conclusions CNP can alleviate IR-induced kidney injury and renal tissue apoptosis. The mechanism may be related to the increased renal tissue cGMP levels which effectively increase Akt and GSK-3β protein phosphorylation.
acute kidney injury; ischemia-reperfusion; C-type natriuretic peptide; renal function; apoptosis; protein kinase B; glycogen synthase kinase-3β; rats
国家自然科学基金资助项目(81460056)。
朴敏虎(1977-),男,博士研究生,主要研究方向为继发性肾脏疾病的诊治。 E-mail:piaominhu99@163.com
许东元(1974-),男,副教授,主要研究方向为信号通路与疾病。E-mail: dyxu@ybu.edu.cn
10.3969/j.issn.1002-266X.2017.18.007
R692
A
1002-266X(2017)18-0023-03
2016-11-12)

