胃癌细胞来源的exosomes对Jurkat T细胞凋亡的影响及机制探讨
张玉峰,叶坤英,钟丹
(1河南中医药大学第二临床医学院,郑州450002;2井冈山大学医学院 )
胃癌细胞来源的exosomes对Jurkat T细胞凋亡的影响及机制探讨
张玉峰1,叶坤英1,钟丹2
(1河南中医药大学第二临床医学院,郑州450002;2井冈山大学医学院 )
目的 观察胃癌细胞来源的外来体exosomes对Jurkat T细胞凋亡的影响,并探讨其可能的机制。方法 将人低分化胃腺癌细胞株进行培养、传代等处理,分离获得外来体exosomes。将消化后的Jurkat T细胞随机分为观察组与对照组,观察组分别加入50、100、200、400 μg/mL的exosomes,对照组不加exosomes,采用流式细胞仪测算培养12、24 h 时Jurkat T细胞凋亡率,免疫细胞化学法检测培养24 h时Jurkat T细胞中的半胱氨酸天冬氨酸蛋白水解酶3(Caspases-3)、Caspase-8。结果 与对照组比较,观察组随着exosomes浓度增加及作用时间的延长,Jurkat T细胞凋亡率均增加(P均<0.05);与对照组比较,观察组Jurkat T细胞中的Caspases-3、Caspase-8蛋白表达上调,差异有统计学意义(P均<0.05)。结论 胃癌细胞来源的外来体exosomes可诱导Jurkat T细胞凋亡,该作用与其上调Caspases-3、Caspase-8蛋白表达有关。
胃癌;外来体exosomes;Jurkat T细胞;细胞凋亡;半胱氨酸天冬氨酸蛋白水解酶
恶性肿瘤是严重威胁人类健康的一类疾病,细胞凋亡异常是引发恶性肿瘤的主要原因之一[1,2]。细胞凋亡是一个生理性自我毁灭过程,在维持生物体内环境稳定、细胞防御等方面均起到非常重要的作用。在细胞凋亡过程中,半胱氨酸天冬氨酸蛋白水解酶(Caspases)家族是介导者及执行者[3~5];其可诱导免疫细胞凋亡,导致机体免疫监视能力下降,从而发生肿瘤免疫耐受[6~8],但具体机制尚不十分清楚。exosomes来源于多囊体的膜被囊泡,可由多种活细胞分泌,具有独特的蛋白质和脂质成分,是近年来研究的热点之一。Jurkat T细胞是人急性淋巴细胞白血病细胞株,属于CD4+T 淋巴细胞;研究Jurkat T细胞能反映细胞免疫变化,如肿瘤中出现Jurkat T细胞凋亡则提示免疫耐受发生。2016年6~10月,我们观察了胃癌细胞来源的exosomes对Jurkat T细胞凋亡的影响,并探讨其可能的机制。现报告如下。
1 材料与方法
1.1 材料 人低分化胃腺癌细胞株872-3及Jurkat T细胞购自上海艾研生物科技有限公司,RPMI1640培养基购自Gibco公司,胎牛血清购自天津血液病研究所;CyFlow®Cube8流式细胞仪购自Partec公司。兔抗人Caspase-3和Caspase-8抗体均购自Lab Vision公司,辣根过氧化物标记的兔抗羊、羊抗鼠二抗购自北京中杉金桥生物技术有限公司;SIGMA 6K15冷冻离心机购自Sigma公司,722S分光光度仪购自上海精密科学仪器有限公司,HH-SH-1水浴箱购自北京长安科学仪器厂。
1.2 实验方法
1.2.1 胃癌细胞来源exosomes的获取 将低分化胃腺癌细胞株872-3接种在加有胎牛血清及12 kU/L庆大霉素的RPMI1640培养基中,置于37 ℃、饱和湿度、5% CO2培养箱内培养;以0.25%胰酶消化传代,每2~3天传代1次。收集培养细胞的上清液,去除细胞及碎片,经离心、加MWCOAmicon等处理后,所得浓缩液即为exosomes。取部分exosomes进行超速离心沉淀,加2%多聚甲醛和0.25%戊二醛固定;PBS液洗涤3次(15 min/次),梯度乙醇脱水,环氧树脂浸透过夜;经包埋、切片、铅铀染色等处理后,电镜下观察细胞形态。电镜下细胞形态为圆球体,有盘状脂质膜包绕,形态大小不一,直径在30~100 nm,成功制备exosomes。
1.2.2 Jurkat T细胞培养与分组处理 将Jurkat T细胞接种在加有胎牛血清及12 kU/L庆大霉素的RPMI1640培养基中,置于37 ℃、饱和湿度、5% CO2培养箱内培养;以0.25%胰酶消化液消化传代,每2~3天传代1次。将消化后的Jurkat T细胞调整细胞密度为1×106/mL,接种在96孔板,每孔100 μL细胞悬液。将细胞随机分为观察组与对照组,对照组不加exosomes,观察组分别加入50、100、200、400 μg/mL浓度的exosomes,放入37 ℃温箱内培养。
1.2.3 Jurkat T细胞凋亡率测算 采用流式细胞术。分别于培养12、24 h取两组细胞,分离取得沉淀细胞,收集在流式细胞管中。用PBS洗涤2次,加冷70%的乙醇过夜;再用PBS洗涤2次,加20 mg/L的RNase A在37 ℃下孵育30 min;再加入20 mg/L的PI,避光孵育30 min。上流式细胞仪检测凋亡细胞,DNA无法被染色或可染性降低为凋亡细胞,计算细胞凋亡率。
1.2.4 Jurkat T细胞中Caspase-3、Caspase-8蛋白检测 采用Western blot法。取对照组及观察组400 μg/mL exosomes培养24 h的细胞,用0.1%胰蛋白酶消化成单细胞悬液,以PBS冲洗2次(5 min/次)。加入蛋白裂解液,冰上放置15~20 min;在4 ℃下以1 200 r/min离心5 min,提取蛋白;进行SDS聚丙烯酰胺凝胶电泳后,将分离胶底部转印硝酸纤维素膜上;硝酸纤维素膜上滴加Caspase-3与Caspase8抗体,4 ℃下过夜; PBS洗涤后,加二抗孵育过夜;PBS洗涤,DAB显色、封片,以电泳条带灰度值表示Caspase-3、Caspase-8的表达量。
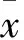
2 结果
2.1 两组Jurkat T细胞凋亡率比较 与对照组比较,观察组随着exosomes浓度增加、作用时间的延长Jurkat T细胞凋亡率逐渐增加(P均<0.05)。见表1。
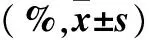
表1 两组Jurkat T细胞凋亡率比较
注:与对照组同时点比较,*P<0.05;与观察组上一浓度比较,#P<0.05;与观察组同浓度12 h时比较,△P<0.05。
2.2 两组Jurkat T细胞中Caspase-3、Caspase-8蛋白表达比较 与对照组比较,观察组Jurkat T细胞中Caspase-3、Caspase-8蛋白表达均增加(P均<0.05)。见表2。
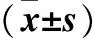
表2两组Jurkat T细胞中Caspase-3、Caspase-8蛋白表达比较
注:与对照组比较,*P<0.05。
3 讨论
肿瘤的免疫治疗已成为临床研究的热点,但仍有很多问题尚未研究清楚。免疫缺陷及免疫耐受等是影响免疫治疗疗效的主要原因,而研究发现肿瘤细胞分泌的exosomes能诱导肿瘤产生免疫耐受[6,7],导致机体的免疫监视功能下降,但具体机制尚不十分清楚。
细胞凋亡是一个生理性的细胞自我毁灭过程,在胚胎发育、生物体内环境稳定、细胞防御内外伤害等方面起到非常重要的作用。exosomes最先是由Trams等在1981年被研究发现,是由活细胞分泌产生的,具有影响细胞凋亡的作用,与细胞坏死碎片和凋亡小体有明显区别[11]。exosomes是细胞膜内陷形成的早期内体,内体内有多量的小泡多泡体,这种多泡体可与细胞膜融合,将小泡释放在泡外空间,这种小泡即为exosomes。很多类型的细胞均能释放exosomes,但主要由免疫细胞和肿瘤细胞释放。肿瘤细胞和免疫细胞释放的exosomes可表达热休克蛋白、共刺激分子、肿瘤抗原等,因此可诱导机体的抗肿瘤效应,具有抗肿瘤作用。近年来临床大量研究显示[12~15],exosomes在体内能直接表现为免疫抑制。曲晶磊等[14]研究显示,胃细胞来源的exosomes有促进肿瘤细胞增殖作用,其作用机制是通过激活PI3K和MAPK/ERK信号通路来实现的。有研究结果显示,exosomes可通过抑制T细胞活化的信号分子JAK3来诱导T细胞凋亡[8],可下调NK细胞表面的NKG2D表达[9,10],认为可能是通过以上途径来起到免疫抑制作用。杨林等[15]研究了肾癌细胞来源的exosomes介导肿瘤免疫逃逸的机制,结果显示Jurat T细胞凋亡增加,在细胞凋亡过程中存在Caspase-3、8、9表达上调。
在细胞凋亡过程中,Caspases家族中一类为起始者、一类为执行者。起始者Caspase可在外来蛋白信号的作用下被激活,然后激活执行者Caspase并水解Caspase靶蛋白,启动细胞的凋亡程序。Caspase-2、8、9、10属于起始者,Caspase-3、6、7属于执行者,起始者可活化执行者,两者之间是上下游的关系。其中,Caspases-3、Caspase-8是在执行与起始中处于核心地位的两种蛋白酶,在凋亡的多途径信号通路关键步骤中均有参与。研究[16~20]发现,Caspase-8活化时特异性识别Caspase-3抑制酶(DEVD),能剪切多聚ADP-核糖聚合酶,经“诱导接近模式”活化后可引发Caspase的级联反应,进一步水解激活下游的同源酶(如Caspase-6、3、7);这种反应是在细胞质中进行,可在细胞质中裂解Bcl-2家庭成员Bid,裂解产物的羧基片段tBid可转移在线粒体上,诱导线粒体释放细胞色素C,促使死亡受体通路与线粒体通路联系起来,最后发生凋亡激活生物效应。Caspase-3属于效应性Caspase,是细胞凋亡过程中的关键元件,其异常表达可引起细胞凋亡。Caspase-3在凋亡的级联反应下游,是凋亡的执行者。其引起凋亡的机制主要是对某些蛋白质进行切割,通过阻滞细胞周期、促使细胞从周围组织结构中脱落、破坏细胞的自我修复机制、引起维持细胞结构的物质解体等途径来诱发细胞凋亡[19~21];另外,其可通过对Fas介导的死亡信号途径来抑制抗凋亡蛋白Bcl-2表达,催化参与DNA修复的聚合酶发生裂解;同时,其还可引起Caspase活化DNA酶(CAD)、DNA片段化因子(DFF)等核酸内切酶活化,使DNA在核小体连接处被切割,产生DNA片段,进而裂解细胞骨架蛋白、核蛋白、细胞外基质蛋白等关键结构蛋白和看家蛋白,引起细胞形态发生异常,导致细胞与环境间的联系被割断,最终引起细胞凋亡。本研究对胃癌细胞来源的exosomes诱导Jurkat T细胞凋亡时Caspases-3、Caspase-8表达变化进行研究,结果显示胃癌细胞来源的exosomes能明显诱导Jurkat T细胞凋亡,且随时间推移及浓度增加Jurkat T细胞凋亡率随之增加,同时可引起Caspases-3、Caspase-8表达上调。
综上所述,胃癌细胞来源的外来体exosomes可诱导Jurkat T细胞凋亡,其机制可能是通过上调Caspases-3、Caspase-8表达实现的,但是具体机制尚需要进一步深入研究。进一步深入研究胃癌细胞来源的exosomes诱导Jurkat T细胞凋亡机制,可为胃癌的免疫靶向治疗提供了一个新的思路。
[1] Weiss JM, Gregory Alvord W, Quiones OA, et al. CD40 expression in renal cell carcinoma is associated with tumor apoptosis, CD8(+) T cell frequency and patient survival[J]. Hum Immunol, 2014,75(7):614-620.
[2] Song T, Dou CW, Jia YL, et al. TIMP-1 activated carcinoma-associated fibroblasts inhibit tumor apoptosis by activating SDF1/CXCR4 signaling in hepatocellular carcinoma[J]. Oncotarget, 2015,6(14):12061-12079.
[3] Mcilwain DR, Berger T, Mak TW. Caspase functions in cell death and disease[J]. Cold Spring Harb Perspect Biol, 2013,5(4):a008656.
[4] Segawa K, Kurata S, Yanagihashi YA, et al. Caspase-mediated cleavage of phospholipid flippase for apoptotic phosphatidylserine exposure[J]. Science, 2014,344(6188):1164-1168.
[5] Mccallister CM, Rayavarapu R, Pagani N, et al. Ras-mediated regulation of cytochrome c-induced caspase activation is dependent on the status of extracellular matrix attachment[J]. Cancer Res, 2016,76(14 Supplement):3563-3563.
[6] Raposo G, Stoorvogel W. Extracellular vesicles: exosomes, microvesicles, and friends[J]. J Cell Biol, 2013,200(4):373-383.
[7] Thakur BK, Zhang H, Becker A, et al. Double-stranded DNA in exosomes: a novel biomarker in cancer detection[J]. Cell Res, 2014,24(6):766-769.
[8] Candelario KM, Steindler DA. The role of extracellular vesicles in the progression of neurodegenerative disease and cancer[J]. Trends Mol Med, 2014,20(7):368-374.
[9] Labani-Motlagh A, Israelsson P, Ottander U, et al. Differential expression of ligands for NKG2D and DNAM-1 receptors by epithelial ovarian cancer-derived exosomes and its influence on NK cell cytotoxicity[J]. Tumor Biology, 2016,37(4):5455-5466.
[10] Chitadze G, Bhat J, Lettau M, et al. Generation of soluble NKG2D ligands: proteolytic cleavage, exosome secretion and functional implications[J]. Scand J Immunol, 2013,78(2):120-129.
[11] 杨云山,钟海均,林能明.肿瘤细胞来源的Exosomes的研究进展[J].中国肿瘤生物治疗杂志,2014,21(4):477-481.
[12] 于慧杰,李峰生,何蕊,等.树突状细胞来源Exosomes治疗肿瘤的研究进展[J].中国免疫学杂志,2013,29(9):1007-1008.
[13] 郭杏丹,贺修胜,吴冬梅,等.Exosomes在肿瘤发展与转移中的研究进展[J].临床与实验病理学杂志,2013,29(12):1348-1350.
[14] 曲晶磊,张文,刘云鹏,等.PI3K/Akt 和 MAPK/ERK 信号通路在胃癌细胞来源的 Exosome 促进同源肿瘤细胞增殖中的作用[J].世界华人消化杂志,2011,19(11):1109-1114.
[15] 杨林,吴小候,罗春丽,等.肾癌细胞来源的exosomes诱导Jurkat T细胞凋亡[J].第三军医大学学报,2013,35(5):426-430.
[16] Kang TB, Yang SH, Toth B, et al. Caspase-8 blocks kinase RIPK3-Mediated activation of the NLRP3 inflammasome[J]. Immunity, 2013,38(1):27-40.
[17] Gurung P, Anand PK, Malireddi R, et al. FADD and caspase-8 mediate priming and activation of the canonical and noncanonical Nlrp3 inflammasomes[J]. J Immunol, 2014,192(4):1835-1846.
[18] Weinlich R, Oberst A, Dillon CP, et al. Protective roles for caspase-8 and cFLIP in adult homeostasis[J]. Cell Rep, 2013,5(2):340-348.
[19] Nguyen QD, Lavdas I, Gubbins J, et al. Temporal and spatial evolution of therapy-induced tumor apoptosis detected by caspase-3-selective molecular imaging[J]. Clin Cancer Res, 2013,19(14):3914-3924.
[20] Jiang H, Zhang L, Liu J, et al. Knockdown of Zinc finger protein X-linked inhibits prostate cancer cell proliferation and induces apoptosis by activating caspase-3 and caspase-9[J]. Cancer Gene Ther, 2012,19(10):684-689.
[21] Chakraborty D, Bishayee K, Ghosh S, et al. 6-Gingerol induces caspase 3 dependent apoptosis and autophagy in cancer cells: Drug-DNA interaction and expression of certain signal genes in HeLa cells[J]. Eur J Pharmacol, 2012,694(1/3):20-29.
·作者·编者·读者·
《山东医药》参考文献著录要求
每篇论文须标引参考文献10~20条。正文中引用的文献采用顺序编码制,以引用文献的先后顺序连续编码,并将序号置于方括号中。文后参考文献按GB/T7714-2005《文后参考文献著录规则》采用顺序编码制标注,序号置于方括号中,排列于文后。内部刊物、未发表资料、个人通信等请勿作为文献引用,确需引用时,可将其在正文相应处注明。引用文献(包括文字和表达的原意)务请作者与原文核对无误。日文汉字请按日文规定书写,勿与我国汉字及简化字混淆。参考文献中的作者前1~3名全部列出,3名以上只列前3名,后依文种加表示“,等”的文字。作者姓名一律姓氏在前,名字在后,外国人的名字采用首字母缩写姓氏,缩写名后不加缩写点;不同作者之间用“,”隔开。外文期刊名称用缩写,以Index Medicus中的格式为准;中文期刊用全名。论文题目后加文献类型及标识,如专著[M]、期刊文章[J]等。每条参考文献均须著录卷、期及起止页。作者必须自行核对参考文献原文,无误后将其按引用顺序(用阿拉伯数字)排列于文末。举例:
[1] 杜贾军,孟龙,陈景寒,等.手辅助电视胸腔镜食管切除胃食管胸内吻合术[J].山东医药,2004,44(27):1-3.
[2] Takano M, Mizuno K, Okamatsu K, et al. Mechanical and structural characteristics of vulnerable plaques: analysis by coronary angioscopy and intravascular ultrasound[J]. J Am Coll Cardiol, 2002,38(1):99-104.
[3] 叶任高,陆再英.内科学[M].5版.北京:人民卫生出版社,2000:277-280.
Effect of exosomes derived from gastric cancer cells on apoptosis of Jurkat T cells
ZHANGYufeng1,YEKunying,ZHONGDan
(1TheSecondClinicalMedicalCollegeofHenanUniversityofTraditionalChineseMedicine,Zhengzhou450002,China)
Objective To observe the effect of exosomes derived from gastric cancer cells on apoptosis of Jurkat T cells and to discuss the possible mechanism. Methods Exosomes was separated by culturing low differentiated gastric cancer cell strains. The digested Jurkat T cells were divided into the observation group and control group (without esosomesexosomes), cells in the the observation group were respectively added with 50, 100, 200, and 400 μg/mL esosomesexosomes. Flow cytometry was used to detect the apoptosis of Jurkat T cells at 12 and 24 h, and the expression of Aspartic proteinase Caspase-3 and Caspase-8 in Jurkat T cells was tested by immunocytochemistry.Results The apoptosis of Jurkat T cells in the observation group increased with the increasing concentrations of exosomes and the prolonged time as compared with that of the control group (allP<0.05). The expression of Caspases-3 and Caspase-8 in the Jurkat T cells increased in observation group as compared with that of the control group and the difference was statistically significant (allP<0.05).Conclusion Exosomes derived from gastric cancer cell strains induces the apoptosis of Jurkat T cells, and it may related to the up-regulated expression of Caspases-3 and Caspase-8.
gastric carcinoma; exosomes; Jurkat T cells; cell apoptosis; Caspase
河南省中医药科学研究专项课题资助项目(2014ZY02027)。
张玉峰(1969-),男,副教授,副主任医师,主要研究方向为中医药防治消化病。E-mail: zhouyihb@163.com
10.3969/j.issn.1002-266X.2017.18.002
R735.2
A
1002-266X(2017)18-0005-04
2017-01-03)

