SGK-1在缺氧诱导小鼠垂体瘤细胞AtT-20增殖、凋亡中的表达及作用探讨
韦睿, 吴杰, 曾伟, 张玮
(昆明医科大学第一附属医院,昆明650032)
SGK-1在缺氧诱导小鼠垂体瘤细胞AtT-20增殖、凋亡中的表达及作用探讨
韦睿, 吴杰, 曾伟, 张玮
(昆明医科大学第一附属医院,昆明650032)
目的 观察血清和糖皮质激素调节蛋白激酶1(SGK-1)在缺氧诱导小鼠垂体瘤细胞AtT-20增殖、凋亡中的表达,并探讨其在这一过程中的作用。方法 将AtT-20细胞随机分为观察组和对照组,观察组分别加入50、100、200 μmol/L CoCl2(模拟缺氧),对照组不处理,采用MTT法检测24、48、72、96 h时细胞增殖的A570值;将200 μmol/L CoCl2加入AtT-20细胞,培养0、24、48、72、96 h时采用流式细胞术测算细胞凋亡率,分别采用半定量PCR法和Western blot法检测SGK-1 mRNA及蛋白。将AtT-20细胞随机分为4组,A、B组转染干扰质粒SGK-1 siRNA,C、D组转染对照质粒siCon,转染24 h后A、C 组加入200 μmol/L CoCl2,B、D组不处理,分别采用MTT法和流式细胞术检测24、48、72、96 h时细胞增殖的A570值及细胞凋亡率。结果 缺氧处理72 h后,观察组随着CoCl2浓度增加及作用时间延长,AtT-20细胞增殖的A570值逐渐降低,与对照组比较差异有统计学意义(P均<0.05)。与0 h时比较,处理24、48 h时细胞凋亡率无明显变化,处理72、96 h时细胞凋亡率增加(P均<0.05);与0 h时比较,处理24、48时AtT-20细胞SGK-1 mRNA及蛋白表达量均增加(P均<0.05),72 h后其表达量无显著变化(P均>0.05)。A组缺氧后各时点细胞增殖的A570值均低于其余各组,C组缺氧后72、96 h细胞增殖的A570值高于A组而低于B、C组(P均<0.05)。A组缺氧后各时点细胞凋亡率均高于其余各组,C组缺氧后72 h细胞凋亡率低于A组而高于B、C组(P均<0.05)。结论 缺氧可抑制AtT-20细胞增殖、促进其凋亡,该过程中SGK-1表达增加可保护细胞免受缺氧导致的损伤。
脑缺氧;垂体瘤细胞;血清和糖皮质激素调节蛋白激酶;氯化钴;基因干扰;细胞凋亡;细胞增殖
在大鼠乳腺癌细胞中,有学者通过糖皮质激素诱导转录表达的差异筛选发现了一种新的丝氨酸/苏氨酸蛋白激酶,当细胞受到糖皮质激素或血清刺激时该蛋白表达迅速升高,所以将其命名为血清和糖皮质激素诱导蛋白激酶(SGK)[1]。有研究[2]表明,SGK在细胞受到外界刺激后对维持其存活起到重要作用。目前,SGK在肾脏[3]、心血管[4]、子宫等外周器官的作用研究比较多,但在中枢神经系统的作用相关研究较少。早期有研究[5]发现,在脑损伤部位SGK-1 mRNA 表达升高,提示SGK可能参与轴突再生。动物实验发现,前脑局灶缺血可导致大脑皮质中SGK-1表达明显增加,提示SGK作为一种即早基因,在全脑缺血应激条件下迅速被诱导、转录及表达[6~10]。2014年9月~2016年3月,我们观察了SGK-1在缺氧诱导小鼠垂体瘤细胞AtT-20增殖、凋亡中的表达变化,以初步阐释SGK-1在脑缺血过程中的重要作用。
1 材料与方法
1.1 细胞培养与缺氧诱导 小鼠垂体瘤细胞AtT-20购自中国科学院昆明细胞库,培养于含10%胎牛血清的RPMI1640培养基中;每1~2天换液1次,3~4 d离心传代1次。用CoCl2刺激细胞模拟缺氧环境[11]:用50~200 μmol/L的CoCl2刺激细胞96 h,将细胞置于5% CO2培养箱中37 ℃培养。
1.2 缺氧对细胞增殖、凋亡影响的观察
1.2.1 细胞增殖情况观察 采用MTT法。取对数生长期的AtT-20细胞,以1×104/mL的密度接种于96孔板中,接种体积为200 μL/孔。培养8 h稳定后随机分为观察组和对照组,观察组分别加入50、100、200 μmol/L CoCl2,对照组不处理,每个孔设置5个复孔。孵育24、48、72、96 h后,每孔中加入5 mg/mL的MTT(Sigma公司)溶液20 μL,继续培养4 h后轻轻吸去上清;加入150 μL DMSO(上海生工生物工程股份有限公司),震荡15 min,用酶标仪测定570 nm的吸光度,以A570值表示细胞的增殖情况。
1.2.2 细胞凋亡情况观察 采用流式细胞术。取对数生长期的AtT-20细胞,以1×104/mL的密度接种于96孔板中,接种体积为200 μL/孔。培养8 h稳定后,加入200 μmol/L CoCl2;分别于孵育0、24、48、72、96 h时,用PBS洗涤2次,进行Annexin V/PI双染色(南京凯基生物科技发展有限公司),上流式细胞检测凋亡细胞,计算细胞凋亡率。
1.3 缺氧对细胞SGK-1表达影响的观察
1.3.1 SGK-1 mRNA 检测 采用PRC半定量法。细胞接种及处理同1.2.2,使用RNA Simple总RNA提取试剂盒(北京天根生化科技有限公司)提取各组细胞总RNA,定量后用PrimeScriptTM1st Strand cDNA Synthesis Kit(大连宝生物工程有限公司)合成cDNA第一链;以cDNA第一链为模板进行PCR反应,用1.5%琼脂糖凝胶电泳检测PCR产物并对其进行半定量,以2-ΔΔct计算其相对表达量。SGK-1上游引物5′-CTCCGCCAAGTCCCTCTCAACAAAT-3′,下游引物5′-CTCATACAGGACAGCCCCAAGACAC-3′,产物长度644 bp;GAPDH上游引物为5′-AATGCATCCTGCACCACCAA-3′,下游引物为5′-GTAGCCATATTCATTGTCATA-3′,产物长度513 bp;扩增反应:95 ℃预变性10 s;60 ℃ 60 s,95 ℃ 15 s,40个循环;99 ℃退火60 s。
1.3.2 SGK-1蛋白检测 采用Western blot法[12]。细胞接种及处理同1.2.2,用RIPA裂解液裂解细胞,12 000 r/min离心取上清;用Bradford法定量后行SDS-聚丙烯酰胺凝胶电泳,每孔上样量为30 g总蛋白。电转移至PVDF膜,并用3% BSA封闭2 h;用SGK-1抗体(美国Invitrogen公司)孵育4 h,PBS缓冲液冲洗3次;二抗孵育2 h, 用PBST缓冲液冲洗膜3次,每次冲洗10 min,最后再用PBS缓冲液冲洗1次,结合HRP底物ECL发光液用BIO-RAD Chemical XRS+显影系统显影得到条带图像。图像的蛋白条带灰度用Image J 3.0软件定量,以目标蛋白与对应内参灰度比值为目标蛋白的相对表达量。
1.4 降SGK-1表达对缺氧环境下细胞增殖、凋亡影响的观察
1.4.1 细胞分组与转染处理 取对数生长期的AtT-20细胞,以1×104/mL的密度接种于96孔板中,接种体积为200 μL/孔。培养8 h稳定后随机分为4组,A、B组转染干扰质粒SGK-1 siRNA(Santa Cruz公司),C、D组转染对照质粒siCon(Santa Cruz公司),使用HiPerFect(Qiagen公司)转染细胞24 h。然后A、C 组均加入200 μmol/L CoCl2,B、D组不予处理。
1.4.2 细胞增殖、凋亡观察 取培养24、48、72、96 h 的细胞,分别按照1.2.1、1.2.2的方法观察各组细胞增殖、凋亡情况。
2 结果
2.1 缺氧对AtT-20细胞增殖的影响 缺氧处理72 h后,观察组随着CoCl2浓度增加及作用时间延长,AtT-20细胞增殖的A570值逐渐降低,与对照组比较差异有统计学意义(P均<0.05)。见表1。
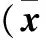
表1 两组细胞增殖情况比较±s)
注:与对照组同时点比较,*P<0.05;与观察组50 μmol/L同时点比较,#P<0.05;与观察组100 μmol/L同时点比较,△P<0.05 。
2.2 缺氧对AtT-20细胞凋亡的影响 200 μmol/L的CoCl2处理细胞0、24、48、72、96 h时,细胞凋亡率分别为10.32%±3.15%、11.26%±3.02%、11.32%±3.25%、19.87%±4.31%、24.41%±5.09%;与0 h时比较,处理24、48 h时细胞凋亡率无明显变化,处理72、96 h时细胞凋亡率增加(P均<0.05)。
2.3 缺氧对AtT-20细胞SGK-1表达的影响 200 μmol/L 的CoCl2处理24、48时AtT-20细胞SGK-1表达均增加(P均<0.05),72 h时其表达量与未处理(0 h)的细胞基本持平(P>0.05)。见表2。
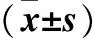
表2200 μmol/L 的CoCl2处理不同时间AtT-20细胞SGK-1表达比较
注:与0 h时比较,*P<0.05。
2.4 SGK-1表达对缺氧环境下细胞增殖和凋亡的影响
2.4.1 各组细胞增殖情况比较 A组缺氧后各时点细胞增殖的A570值均低于其余各组,C组缺氧后72、96 h细胞增殖的A570值高于A组而低于B、C组(P均<0.05)。见表3。
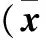
表3 各组细胞增殖情况比较±s)
注:与B、D组比较,*P<0.05;与C组比较,#P<0.05。
2.4.2 各组细胞凋亡情况比较 A组缺氧后各时点细胞凋亡率均高于其余各组,C组缺氧后72 h细胞凋亡率低于A组而高于B、C组(P均<0.05)。见表4。
表4 各组细胞凋亡率比较
注:与B、D组比较,*P<0.05;与C组比较,#P<0.05。
3 讨论
足够的血液和氧气供应对维持脑的正常功能非常重要,脑缺血可导致脑组织死亡。因此,探索脑缺血后细胞凋亡以及保护自身细胞的机制,对于理解和治疗脑缺血相关疾病有相当重要的意义。SGK1是一种丝氨酸/苏氨酸蛋白激酶,具有广泛的生理功能,其表达及活性增加参与多种疾病病理过程的发生和发展[13~15]。研究发现,SGK1在全脑缺血再灌注损伤的大鼠海马细胞中表达明显增加,而在损伤的神经元细胞中也有上调趋势;推测SGK-1表达可能参与维持脑细胞存活的过程,从而减少脑缺血引起的脑损伤。有研究在细胞水平上发现,肾上腺素受体介导的抗凋亡信号与SGK-1有关[16~18]。因此,有充分的理由推测SGK-1表达可能参与脑缺血过程中对脑细胞的保护,我们的研究正是基于这些前期基础和推测开展的。
我们用CoCl2刺激细胞模拟细胞缺氧,并检测缺氧对垂体瘤细胞AtT-20增殖的影响;发现短期(24~48 h)的低氧刺激对细胞增殖并没有太明显的影响,甚至可以对细胞增殖有一定的促进作用,而长期的低氧刺激则明显抑制了细胞的增殖。长期低氧刺激抑制细胞增殖是在预料之中的,而短期刺激导致的促细胞增殖则可能是因为低氧刺激诱导的其他因子导致了细胞增殖的加快,也可以理解为细胞对低氧刺激做出的一种应激反应。对细胞凋亡的研究也发现,CoCl2刺激在短时间并不会明显诱导细胞凋亡,而在刺激72 h后则可明显诱导细胞凋亡。对SGK-1在受到CoCl2刺激缺氧后表达的研究发现,CoCl2刺激在24、48 h均可以诱导SGK-1表达,而随着时间的延长SGK-1回复到正常水平。这些结果都说明,SGK-1可能在低氧诱导早期为维持细胞生存起到一定作用。为了验证上述推测,我们采用了RNA干扰的方法降低SGK-1在细胞内的表达。如果我们的推测正确,干扰SGK-1表达则必将加剧低氧诱导的增殖抑制,并增加细胞凋亡率。而我们的结果与推测非常吻合,这说明SGK-1在AtT-20受到低氧刺激后,能够迅速表达上调,从而激活相关信号通路,维持细胞生存并抑制细胞凋亡。
综上所述,本研究利用体外细胞缺氧模型,证明了SGK-1在脑缺血早期表达,起到保护脑细胞的作用。进一步研究SGK-1在脑缺血中的作用以及相关信号通路,有利于更好地阐述脑缺血保护的相关机制,并指导临床诊疗。
[1] Niizuma K, Yoshioka H, Chen H, et al. Mitochondrial and apoptotic neuronal death signaling pathways in cerebral ischemia[J]. Biochim Biophys Acta, 2010,1802(1):92-99.
[2] Racay P, Tatarkova Z, Chomova M, et al. Mitochondrial calcium transport and mitochondrial dysfunction after global brain ischemia in rathippocampus[J]. Neurochem Res, 2009,34(8):1469-1478.
[3] Tadross MR, Dick IE, Yue DT. Mechanism of local and global Ca2+sensing by calmodulin in complex with a Ca2+channel[J]. Cell, 2008,133(7):1228-1240.
[4] Saucerman JJ, Bers DM. Calmodulin binding proteins provide domains of local Ca2+signaling in cardiac myocytes[J]. J Mol Cell Cardiol, 2012,52(2):312-316.
[5] 王柏欣,陈梅,王淑秋,等.辛伐他汀对大鼠脑缺血再灌注损伤后线粒体游离钙、细胞色素C表达水平的影响[J].中国老年学杂志,2011,31(19): 3764-3765.
[6] Circu ML, Aw TY. Reactive oxygen species, cellular redox systems, and apoptosis[J]. Free Radic Biol Med, 2010,48(6):749-762.
[7] Wang JK, Yu LN, Zhang FJ, et al. Postconditioning with sevoflurane protects against focal cerebral ischemia and reperfusion injury via PI3K/Akt pathway[J]. Brain Res, 2010,1357:142-151.
[8] Kovalska M, Kovalska L, Pavlikova M, et al. Intracellular signaling MAPK pathway after cerebral ischemia-reperfusion injury[J]. Neurochem Res, 2012,37(7):1568-1577.
[9] Lan R, Xiang J, Zhang Y, et al. PI3K/Akt pathway contributes to Neurovascular unit protection of xiao-xu-ming decoction against focal cerebral ischemia and reperfusion injury in rats[J]. Evid Based Complement Alternat Med, 2013,2013:459467.
[10] Zhang W, Qian CY, Li SQ. Protective effect of sgk1 in rat hippocampal neurons subjected to ischemia reperfusion[J]. Cell Physiol Biochem, 2014,34(2):299-312.
[11] Fields JD, Khatri P, Nesbit GM, et al. Meta-analysis of randomized intra-arterial thrombolytic trials for the treatment of acute stroke due to middle cerebral artery occlusion[J]. J Neurointerv Surg, 2011,3(2):151-155.
[12] Brickley DR, Agyeman AS, Kopp RF, et al. Serum- and glucocorticoid-induced protein kinase 1 (SGK1) is regulated by store-operated Ca2+entry and mediates cytoprotection against necrotic cell death[J]. J Biol Chem, 2013,288(45):32708-32719.
[13] Li L, Yang N, Nin L, et al. Chinese herbal medicine formula Tao Hong Si Wu decoction protects against cerebral ischemia-reperfusion injury via PI3K/Akt and the Nrf2 signaling pathway[J]. J Nat Med, 2014,69(1):76-85.
[14] Li B, Sun J, Lv G, et al. Sevoflurane postconditioning attenuates cerebral ischemia-reperfusion injury via protein kinase B/nuclear factor-erythroid 2-related factor 2 pathway activation[J]. Int J Dev Neurosci, 2014,38:79-86.
[15] Han J, Wan HT, Yang JH, et al. Effect of ligustrazine on levels of amino acid neurotransmitters in rat striatum after cerebral ischemia-reperfusion injury[J]. J Asian Nat Prod Res, 2014,16(11):1060-1067.
[16] Xu X, Zhang S, Zhang L, et al. The Neuroprotection of puerarin against cerebral ischemia is associated with the prevention of apoptosis in rats[J]. Planta Med, 2005,71(7):585-591.
[17] Lang F, Böhmer C, Palmada M, et al. (Patho) physiological significance of the serum-and glucocorticoid-inducible kinase isoforms[J]. Physiol Rev, 2006,86(4):1151-1178.
[18] Lang F, Gorlach A, Vallon V. Targeting SGK1 in diabetes[J]. Expert Opin Ther Targets, 2009,13(11):1303-1311.
Expression and role of SGK-1 in hypoxia-induced proliferation andapoptosis of mouse pituitary tumor cells AtT-20
WEIRui,WUJie,ZENGWei,ZHANGWei
(TheFirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming650032,China)
Objective To observe the expression of serum and glucocorticoid-regulated kinase-1 (SGK-1) in mouse pituitary tumor cells AtT-20′s proliferation and apoptosis induced by hypoxia and to explore the role of SGK-1 in the process.Methods We classified AtT-20 cells into the observation group and control group randomly, then put 50, 100, 200 μmol/L CoCl2(for modulating the hypoxia) in the observation group while nothing was put in the control group, next, we tested the A570 value of cell proliferation at 0, 24, 48, 72, 96 h by MTT. We added 200 μmol/L CoCl2to AtT-20 cells, when the cells were cultured for 0, 24, 48, 72, 96 h, we calculated the apoptosis rate by flow cytometry, separately.Meanwhile, we detected the mRNA and protein of SGK-1 by semi quantitative PCR and Western blot. After that, we divided AtT-20 cells into 4 groups, cells in the groups A and B were transfected with interfering plasmid SGK-1 siRNA, and cells in the groups C and D were transfected with control interfering plasmid siCon. At 24 h after transfection, cells in the groups A and C were added with 200 μmol/L CoCl2, while cells in the groups B and D were not treated.Finally, we tested the A570 value and the apoptosis rate at 0, 24, 48, 72, 96 h by MTT and flow cytometry, respectively.Results At 72 h after hypoxia, A570 value of AtT-20 cells in the observation group decreased gradually with the increasing concentration and prolonged time, and difference was statistical significant as compared with that of the control group (allP<0.05). The apoptosis rate had no obvious change at 24, 48 h, and the apoptosis rate increased at 72, 96 h as compared with that at 0 h (allP<0.05). The mRNA and protein expression of SGK-1 increased at 24, 48 h (allP<0.05), but had no change at 72 h as compared with that at 0 h (allP>0.05). The A570 value in the group A at every time point after hypoxia was lower than that of the other groups, while the A570 value in the group C at 72, 96 h was higher than that of the group A and lower than that of groups B, C, meanwhile, significant difference was found between them (allP<0.05). The apoptosis rate in the group A at every time point after hypoxia was higher than that of the other groups, while the apoptosis rate in the group C at 72 h was lower than that of the group A and higher than that of groups B, C, meanwhile, significant difference was found between them (allP<0.05).Conclusion Hypoxia inhibits proliferation of AtT-20 cells and promotes its apoptosis, and the increasing expression of SGK-1 in the process protects cells from damage induced by hypoxia.
cerebral hypoxia; pituitary tumor cell; serum and glucocorticoid-regulated kinase (SGK); CoCl2; gene interference; cell apoptosis; cell proliferation
国家自然科学基金资助项目(81560319);云南省应用基础研究面上项目(2016FB130) ;云南省卫生科技计划项目 (2016NS066)。
韦睿(1976-), 女, 主治医师, 主要研究方向为急诊科疾病的诊治。 E-mail: 769320515@qq.com
张玮(1975-),男, 副主任医师,博士硕士生导师,主要研究方向为脑缺血与脑保护。E-mail: zhangwei7222@126.com
10.3969/j.issn.1002-266X.2017.18.005
R739.41
A
1002-266X(2017)18-0016-04
2017-02-23)

