慢病毒介导RNA干扰HES1鼻咽癌稳定细胞株的建立与鉴定
程玉霜,王慧艳,肖东
(南方医科大学肿瘤研究所,广州510515)
慢病毒介导RNA干扰HES1鼻咽癌稳定细胞株的建立与鉴定
程玉霜,王慧艳,肖东
(南方医科大学肿瘤研究所,广州510515)
目的 建立稳定干扰Split多毛增强子1(HES1)的鼻咽癌(NPC)细胞株,为进一步探讨HES1对NPC的影响奠定基础。方法 将293T细胞接种6孔板后随机分为A、B、C、D、E组,分别瞬时转染慢病毒质粒shHES1-a、shHES1-b、shHES1-c、shHES1-d及空载质粒shSCR,分别用qRT-PCR和Western blot法检测HES1 mRNA及蛋白,筛选出最有效干扰质粒;将最有效干扰质粒或空载质粒与慢病毒包装质粒共转染293T细胞,获得含最有效干扰质粒或空载质粒的病毒上清(LV-shHES1/LV-shSCR)。将NPC细胞CNE2和S18随机分为观察组和对照组,分别将LV-shHES1、LV-shSCR以浓度梯度方式感染细胞,分别采用qRT-PCR和Western blot法检测HES1 mRNA及蛋白。结果 C组293T细胞中HES1 mRNA及蛋白相对表达量均低于其余各组(P均<0.05)。与对照组比较,观察组CNE2和S18细胞中HES1 mRNA及蛋白相对表达量均降低(P均<0.05)。结论 成功建立稳定干扰HES1的NPC细胞株。
鼻咽癌;Split多毛增强子1;RNA干扰;慢病毒载体; NPC细胞株
Split多毛增强子1(HES1)基因编码转录因子HES1蛋白,属于果蝇属发状基因在哺乳类动物的同系物[1]。研究表明,HES1是成体干细胞(如造血干细胞[2]、小肠干细胞[3,4]、黑色素干细胞[5]和胰腺干细胞[6]等)自我更新与增殖、干性维持、存活和(或)抑制干细胞分化等所必需的,常被用作干细胞标志物。鼻咽癌(NPC)是我国南方和东南亚常见的恶性肿瘤之一,发病部位隐匿,是一种低分化、高转移性恶性肿瘤。已有研究[7]报道,HES1与Oct4和Sox2在NPC细胞上共表达。本研究采用RNA干扰(RNAi)技术,建立了稳定干扰HES1的NPC细胞株,为进一步探讨HES1对NPC的影响奠定基础。
1 材料与方法
1.1 材料 HES1-shRNA慢病毒质粒piLenti-shHES1-GFP-a(shHES1-a)、piLenti-shHES1-GFP-b(shHES1-b)、piLenti-shHES1-GFP-c(shHES1-c)和piLenti-shHES1-GFP-d(shHES1-d)及空载质粒piLenti-shSCR-GFP(shSCR)均购自加拿大ABM公司,慢病毒包装质粒psPAX2和pMD2.G由瑞士日内瓦大学Didier Trono博士惠赠。高保真Taq DNA聚合酶、dNTP、限制性内切酶、In-Fusion克隆试剂盒均购自TaKaRa公司;质粒提取试剂盒购自QIAGEN公司;脂质体转染剂LipofectamineTM2000、高糖DMEM、Opti-MEM I Medium等购自Invitrogen公司;培养瓶及培养板等购自Corning公司;其余试剂为国产或进口化学纯或分析纯。人源胚胎肾细胞293T来源和培养方法见文献[8];NPC细胞株(CNE2和S18)为南方医科大学肿瘤研究所保存。
1.2 方法
1.2.1 最有效干扰序列的筛选 将293T细胞接种6孔板后随机分为A、B、C、D、E组,分别采用LipofectamineTM2000瞬时转染慢病毒质粒shHES1-a、shHES1-b、shHES1-c、shHES1-d及空载质粒shSCR,以上转染均设2个复孔。24 h后倒置荧光显微镜下观察绿色荧光,初步判断转染效果。48 h后提取以上细胞总RNA和蛋白,qRT-PCR和Western blot法检测HES1表达,筛选出最佳干扰序列。①qRT-PCR法检测HES1 mRNA:按照TaKaRa试剂说明书提取细胞中RNA,并逆转录成cDNA。采用Primer 5.0软件设计HES1及内参GAPDH基因PCR引物,HES1引物:上游5′-ACGTGCGAGGGCGTTAATAC -3′,下游5′-GGGGTAGGTCATGGCATTGA-3 ′;GAPDH引物:上游5′-ACCCAGAAGACTGTGGATGG-3 ′,下游5′-TCTAGACGGCAGGTCAGGTC-3′。反应体系(20 μL):cDNA 2.0 μL、上下游引物 各2.0 μL、Rox Reference Dye Ⅱ(50×)SYBR0.4 μL、Green PCR Master Mix 10 μL、ddH2O 5.6 μL。反应条件:95 ℃预变性30 s;95 ℃ 5 s、60 ℃ 30 s、72 ℃ 30 s,40个循环。以2-ΔΔCt法计算HES1 mRNA相对表达量。②Western blot法检测HES1蛋白:消化、收集上述细胞,提取细胞总蛋白。将蛋白电泳分离,然后电转移至PVDF膜;加兔抗人单克隆HES1抗体4 ℃过夜,加二抗室温孵育1 h;以GAPDH为内参,观察蛋白表达强度的变化。以上实验均重复3次。
1.2.2 慢病毒包装 将293T细胞接种到25 cm2培养瓶中,待293T细胞融合度达80%~90%时进行病毒包装,pMD2G∶psPAX2∶目的质粒(最有效干扰质粒或空载质粒)=8∶15∶20。倒置荧光显微镜观察绿色荧光,判断293T细胞转染效果。72 h后收集上清,以3 000 r/min离心15 min,直径0.45 μm滤器过滤,获得含最有效干扰质粒或空载质粒的病毒上清(LV-shHES1/LV-shSCR)。
1.2.3 干扰HES1细胞株的建立及HES1表达水平检测 将CNE2和S18细胞随机分为观察组和对照组,分别将LV-shHES1、LV-shSCR以浓度梯度方式感染细胞,同时加入工作浓度为2 μg/mL的促感染试剂聚凝胺(Polybrene),8 h后换至完全培养基。48~72 h后倒置荧光显微镜下观察绿色荧光,并用2 μg/mL嘌呤霉素(GIBCO) 筛选细胞,获得稳定干扰HES1的NPC细胞株。提取其总RNA和蛋白,分别用qRT-PCR和Western blot法检测HES1 mRNA及蛋白表达,方法同1.2.1。
2 结果
2.1 各组293T细胞中HES1 mRNA及蛋白表达比较 见表1。
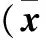
表1各组293T细胞中HES1 mRNA及蛋白相对表达量±s)
注:与C组比较,*P<0.05。
2.2 两组CNE2和S18细胞中HES1 mRNA及蛋白表达比较 见表2。
3 讨论
目前,NPC的主要治疗手段是放疗和化疗。随着适形调强放疗技术的推广,NPC患者局部控制率得到显著改善,但仍有20%~30%的中晚期NPC患者在5年内发生复发与远处转移[16~18]。因此,寻找新型NPC治疗靶点,减少复发和远处转移,对提高NPC的治疗效果有着十分重要的意义。
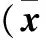
表2两组CNE2和S18细胞中HES1 mRNA及蛋白表达比较±s)
注:与对照组同类型细胞比较,*P<0.05。
HES属于转录因子的碱性螺旋-环-螺旋(b-HLH)家族,它是一个转录抑制子,通过bHLH起作用[9]。与其他 b-HLH 转录因子不同,HES基因是在碱性DNA结合功能域拥有一个脯氨酸。这个脯氨酸使HES蛋白有了结合单一DNA分子的能力[10]。研究发现,在PC12细胞中,HES1抑制细胞生长,阻碍神经生长因子诱导的细胞分化[11]。作为Notch的效应蛋白,HES1是一个神经元分化的抑制子,在肌细胞生成、眼睛形态的变化以及T细胞系中起重要作用[12]。目前研究发现,HES1/HES5基因可通过下调Hash1表达抑制细胞分化,促进宫颈癌细胞增殖[13]。HES1在乳腺癌细胞中表达,可抑制雌激素所刺激的细胞增殖,以及雌激素所诱导的细胞周期调控因子E2F-1表达[18]。Dumont等[18]回顾性研究了15例胃肠道间质肿瘤,认为HES1可作为预后判断的一个分子标志物。
目前研究发现,HES1在NPC组织中高表达,可以使NPC上皮细胞发生间充质样转化,并可以通过激活PTEN/AKT通路促进NPC的侵袭和转移[19]。本课题组前期研究发现,HES1在NPC细胞株CNE2和S18中较永生化鼻咽上皮细胞NP69高表达;并且,与非癌鼻咽组织相比,HES1在NPC组织中高表达;通过RNA干扰下调NPC细胞中HES1表达,会导致NPC细胞中干性相关基因表达下调。本研究在此研究基础上,利用RNAi技术建立了稳定干扰HES1的NPC细胞株。今后,可通过沉默HES1的表达观察其对NPC细胞株生物学特性的影响并探讨其相关机制,为深入了解NPC发病的分子机制和筛选新的分子治疗靶点奠定良好的基础。
[1] Feder JN, Li L, Jan LY, et al. Genomic cloning and chromosomal localization of HRY, the human homolog to the Drosophila segmentation gene, hairy[J]. Genomics, 1994,20(1):56-61.
[2] Kunisato A, Chiba S, Nakagami-Yamaguchi E, et al. HES-1 preserves purified hematopoietic stem cells ex vivo and accumulates side population cells in vivo[J]. Blood, 2003,101(5):1777-1783.
[3] Kayahara T, Sawada M, Takaishi S, et al. Candidate markers for stem and early progenitor cells, Musashi-1 and HES1, are expressed in crypt base columnar cells of mouse small intestine[J]. FEBS Lett, 2003,535(1-3): 131-135.
[4] Riccio O, van Gijn ME, Bezdek AC, et al. Loss of intestinal crypt progenitor cells owing to inactivation of both Notch1 and Notch2 is accompanied by derepression of CDK inhibitors p27Kip1 and p57Kip2[J]. EMBO Rep, 2008,9(4):377-383.
[5] Moriyama M, Osawa M, Mak SS, et al. Notch signaling via HES1 transcription factor maintains survival of melanoblasts and melanocyte stem cells[J]. J Cell Biol, 2006,173(3):333-339.
[6] Stanger BZ, Stiles B, Lauwers GY, et al. Pten constrains centroacinar cell expansion and malignant transformation in the pancreas[J]. Cancer Cell, 2005,8(3):185-195.
[7] Zhang Y, Peng J, Zhang H, et al. Notch1 signaling is activated in cells expressing embryonic stem cell proteins in human primary nasopharyngeal carcinoma[J]. J Otolaryngol Head Neck Surg, 2010,39(2):157-166.
[8] Caulin C, Nguyen T, Lang GA, et al. An inducible mouse model for skin cancer reveals distinct roles for gain- and loss-of-function p53 mutations[J]. J Clin Invest, 2007,117(7):1893-1901.
[9] 赵璐晴,陈雪,曹亚. miRNA与鼻咽癌发病机制[J].科学通报,2011,56(1):9-15.
[10] 刘求真,姚开泰.肿瘤干细胞与肿瘤转移[J]. 肿瘤学杂志,2008,14(1):10-15.
[11] 齐菲菲,贺福初,姜颖.肿瘤转移研究的现状与趋势[J].生物化学与生物物理进展,2009,36(10): 1244-1251.
[12] Feder JN, Li L, Jan LY, et al. Genomic cloning and chromosomal localization of HRY, the human homolog to the Drosophila segmentation gene, hairy[J]. Genomics, 1994,20(1):56-61.
[13] Kageyama R, Ohtsuka T, Kobayashi T. The Hes gene family: repressors and oscillators that orchestrate embryogenesis[J]. Development, 2007,134(7):1243-1251.
[14] Muller P, Kietz S, Gustafsson JA, et al. The anti-estrogenic effect of all-trans-retinoic acid on the breast cancer cell line MCF-7 is dependent on HES-1 expression[J]. J Biol Chem, 2002,277(32):28376-28379.
[15] Kunnimalaiyaan M, Yan S, Wong F, et al. Hairy enhancer of Split-1 (HES-1), a Notch1 effector, inhibits the growth of carcinoid tumor cells[J]. Surgery, 2005,138(6):1137-1142.
[16] Liu J, Lu WG, Ye F, et al. HES1/Hes5 gene inhibits differentiation via down-regulating Hash1 and promotes proliferation in cervical carcinoma cells[J]. Int J Gynecol Cancer, 2010,20(7):1109-1116.
[17] Strom A, Arai N, Leers J, et al. The Hairy and Enhancer of Split homologue-1 (HES-1) mediates the proliferative effect of 17beta-estradiol on breast cancer cell lines[J]. Oncogene, 2000,19(51):5951-5953.
[18] Dumont AG, Yang Y, Reynoso D, et al. Anti-tumor effects of the Notch pathway in gastrointestinal stromal tumors[J]. Carcinogenesis, 2012,33(9):1674-1683.
[19] Messner AH, Lalakea ML.The effect of ankyloglossia on speech in children[J]. Otolaryngol Head Neck Surg, 2002,127(6):539-545.
Establishment and identification of NPC cell line for silencing HES1 gene by RNA interference
CHENGYushuang,WANGHuiyan,XIAODong
(CancerResearchInstitute,SouthernMedicalUniversity,Guangzhou510515,China)
Objective To establish a nasopharyngeal carcinoma (NPC) cell line for silencing hairy and enhancer of split homolog-1 (HES1), and it will lay a foundation for further study on the effect of HES1 on NPC.Methods cell 293T inoculated on a 6-well plate were divided into groups A, B, C, D and E, which were instantaneously transfected with the recombinant lentiviruses (shHES1-a, shHES1-b, shHES1-c, shHES1-d and empty vector shSCR). The expression of HES1 was analyzed by qRT-PCR and Western blotting to identify the LV-shHES1 vector that had the highest gene knockdown efficiency. cell 293T were co-transfected with the most effective interference plasmid or no-load plasmid and lentiviral packaging plasmid to obtain the virus supernatant (LV-shHes1/LV-shSCR) containing the most effective interference plasmid or no-load plasmid.NPC cells CNE2 and S18 were randomly divided into the observation group and control group. LV-shHes1 and LV-shSCR were used to infect the cells in a concentration gradient manner, and the mRNA and protein of HES1 was detected by qRT-PCR and Western blot.Results The relative expression of HES1 mRNA and protein in 293T cells in the group C was lower than that in the other groups, and the difference was statistically significant (allP<0.05). Therefore, the shHES1-c interference efficiency was the best. Compared with the control group, the relative expression of HES1 mRNA and protein in both CNE2 and S18 cells of the observation group was decreased (allP<0.05). Conclusion NPC cell line for silencing HES1 gene by RNA interference was successfully established.
nasopharyngeal carcinoma; hairy and enhancer of split homolog-1; RNA interference; lentivirus expression vector; NPC cells
国家自然科学基金资助项目(81172587, 81372896,81672689);广东省自然科学基金资助项目(2014A030313294)。
程玉霜(1991-),女,硕士研究生,主要研究方向为肿瘤干细胞与肿瘤诱导分化治疗。E-mail: 1121089678@qq.com
肖东(1968-),男,博士,研究员,博士生导师,主要研究方向为肿瘤干细胞与肿瘤诱导分化治疗。E-mail: Xiao_d@hotmail.com
10.3969/j.issn.1002-266X.2017.18.003
R739.62
A
1002-266X(2017)18-0009-03
2016-11-14)

