CD31、CD34和CD133蛋白在婴幼儿血管瘤组织中的表达及意义
冯雷,罗亚楠,贺月华,王林杰,朱璐,雷水生
(1广州医科大学附属第五医院,广州510700;2广州医科大学)
CD31、CD34和CD133蛋白在婴幼儿血管瘤组织中的表达及意义
冯雷1,罗亚楠1,贺月华1,王林杰2,朱璐1,雷水生1
(1广州医科大学附属第五医院,广州510700;2广州医科大学)
目的 观察CD31、CD34和CD133蛋白在婴幼儿血管瘤(IH)组织中的表达,并探讨其临床意义。方法 收集IH患儿存档蜡块50例(增生期25例,消退期25例)、瘤旁正常皮肤组织5例,采用免疫组化SP法检测组织中内皮祖细胞(EPCs)标志物CD31、CD34和CD133蛋白,采用HPIAS-1000图文报告管理系统对CD31、CD34和CD133蛋白的表达进行定量分析。结果 增生期血管瘤组织CD31、CD34和CD133蛋白的阳性面积率分别是23%±3%、19%±4%、37%±2%,积分光密度(IOD)分别是0.26±0.06、0.23±0.03、0.52±0.02,均高于消退期血管瘤组织和瘤旁正常皮肤组织(P均<0.05),而消退期血管瘤组织和瘤旁正常皮肤组织中CD31、CD34和CD133蛋白的IOD和阳性面积率比较差异无统计学意义(P均>0.05)。结论 EPCs标志物CD31、CD34和CD133蛋白在增生期血管瘤组织中高表达,其在血管瘤的发生发展中起着重要作用。
血管瘤;内皮祖细胞;CD31蛋白;CD34蛋白;CD133蛋白;婴幼儿
婴幼儿血管瘤(IH)是一种良性血管性肿瘤,以血管内皮细胞异常増殖为病理持征,好发于婴幼儿出生时或出生后3~6个月,发病率为1%~2%,在白种人群中可以髙达12%[1],但其发病机制尚不明确。内皮祖细胞(EPCs)是一类能够参与循环增殖并能分化为血管内皮细胞的干细胞,目前认为CD34、CD133共同标记的即为EPCs[2]。同样的,也有研究表明,EPCs同样表达CD31。EPCs在血管瘤中含量极微,却独具自我更新、无限增殖、多向分化的能力。2015年12月~2016年4月,我们观察了IH组织中CD31、CD34和CD133蛋白的表达情况。现报告如下。
1 材料与方法
1.1 标本来源 收集广州医科大学附属第五医院病理科2010~2015年IH存档蜡块50例,患儿中男22例,女28例;年龄1月~2岁,平均1.3岁;依据Mulliken分类增生期血管瘤25例、消退期血管瘤25例;术前均未行任何辅助性治疗。另取瘤旁正常皮肤组织5例作为对照。
1.2 CD31、CD34和CD133蛋白检测方法 兔抗人CD31、CD34单克隆抗体(美国GeneTex公司),兔抗人CD133多克隆抗体(美国Proteintech公司),山羊抗兔二抗(美国Bioword公司),DAB显色试剂盒(北京中杉生物技术有限公司),超敏即用型SP通用型免疫组化试剂盒(福州迈新公司)。蜡块常规脱水,透明及HE染色。采用免疫组化SP法检测CD31、CD34与CD133蛋白,用PBS代替一抗作为阴性对照,以购买的阳性片作为阳性对照。CD31、CD34和CD133以细胞核或胞质出现棕黄色颗粒为阳性细胞,采用HPIAS-1000高清晰度彩色病理图文报告管理系统进行蛋白定量分析。光镜下每张切片随机选取5个完整且不重叠的高倍镜视野(×200),测定每个视野下阳性反应的积分光密度(IOD)、阳性反应面积和所有细胞总面积,计算阳性面积率。阳性面积率(%)=单位面积中阳性反应的总面积/单位面积中细胞的总面积×100%。
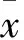
2 结果
增生期血管瘤组织CD31、CD34和CD133蛋白的IOD和阳性面积率均高于消退期血管瘤组织和瘤旁正常皮肤组织(P均<0.05),而消退期血管瘤组织和瘤旁正常皮肤组织比较无统计学意义。详见表1。
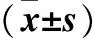
表1 IH及瘤旁正常皮肤组织CD31、CD34和CD133蛋白表达比较
注:与瘤旁正常皮肤组织比较,*P﹤0.05;与消退期IH组织比较,#P﹤0.05。
3 讨论
目前认为,内皮细胞过度增殖、血管快速生长是IH病理组织学的最大特点。IH的自然病程大致分3个阶段:①增殖期。大多出现在出生后的第1年,此阶段以大量毛细血管内皮细胞快速增殖且不规则分布为主要特征,少见典型血管样结构。②消退期。大多在1岁左右开始,持续3~5年;其间血管瘤增殖减慢或停止,血管瘤内皮细胞凋亡,血管样结构增多,细胞外基质纤维和脂肪组织增生。③消退完成期。大多在5~8岁,血管瘤增生组织被纤维脂肪残余及毛细血管替代,病灶处常伴有皮肤松弛、色素沉着以及瘢痕残余。然而,其他脉管性肿瘤和血管畸形自然病程中增殖可在儿童和成人的任何阶段发生,不会出现自行消退现象。
自1997年Asahara等用免疫磁珠法第一次从外周血分选出CD34+细胞,并发现这种细胞可以参与损伤后血管的新生,比新生微血管内皮在形态学和蛋白质的表达模式上表现出更多胚胎性,称其为EPCs[3]。EPCs能够循环增殖并分化为血管内皮细胞参与生理性血管形成,而且在病理状态下能被动员而增强代偿性血管重建能力并参与肿瘤血管生成。CD133是新近发现的干细胞标记,不表达于成熟内皮细胞,被认为是目前区分EPCs与内皮细胞最主要的标记[4]。研究表明,纯化的CD133+细胞在体外能分化为内皮细胞。在分化过程中,EPCs明显失去CD133,并开始表达成熟内皮细胞特有的表面标志,如血管性血友病因子(vWF)。EPCs作为内皮细胞的前体细胞,功能上接近于干细胞[5],不仅参与胚胎时期的血管生成,而且参与出生后的生理性和病理性血管新生。Yu等[6]发现,CD133主要存在于增殖期血管瘤,并在其标本中发现同时表达CD133和血管内皮生长因子受体(KDR)的EPCs,因此推测EPCs可能与血管瘤早期的快速增殖有关。Zou等[7]发现,EPCs表达CD105、CD31、CD34、KDR、VWF、CD146等,但是并没有CD14、CD45、α平滑肌肌动蛋白(α-SMA)的表达,并且很多细胞能表达CD133,这与先前的研究相符的[8,9]。同样,Kleinman等[10]研究发现,内皮细胞集落形成细胞(ECFCs)能表达CD31,而ECFCs是EPCs的一种亚型。从这些研究中不难发现CD31、CD34、CD133都是EPCs的标记物。本研究结果显示,CD31、 CD34和CD133蛋白质在增生期血管瘤组织中高表达,从而证实增生期血管瘤中存在EPCs。有研究[10]显示,IH患儿血循环中EPCs数量超出正常者15倍。EPCs在血管瘤中含量极微,却独具自我更新、无限增殖、多向分化的能力。因此,我们推测其可能是IH发生的根源,始动IH的发生发展,血管瘤内皮细胞可能由滞留在胚胎血管发育早期的EPCs演化而来,但具体的分子机制还有待于进一步阐明。
[1] Leaute-Labreze C, Prey S, Ezzedine K, et al. Infantile haemangioma: part Ⅰ. Pathophysiology, epidemiology, clinical features, life cycle and associated structural abnormalities[J]. J Eur Acad Dermatol Venereol, 2011,25(11):1245-1253.
[2] Lin CP, Lin FY, Huang PH, et al. Endothelial progenitor cell dysfunction in cardiovascular diseases: role of reactive oxygen species and inflammation[J]. Biomed Res Int, 2013,2013:845037.
[3] Asahara T, Murohara T, Sullivan A, et al. Isolation of putative progenitor endothelial cells for angiogenesis[J]. Science, 1997,275(5302):964-967.
[4] Yin AH, Miraglia S, Zanjani ED, et al. AC133, a novel marker for human hematopoietic stem and progenitor cells[J]. Blood, 1997,90(12): 5002-5012.
[5] Ingram DA, Caplice NM, Yoder MC. Unresolved questions, changing definitions, and novel paradigms for defining endothelial progenitor cells[J]. Blood, 2005,106(5):1525-1531.
[6] Yu Y, Flint AF, Mulliken JB, et al. Endothelial progenitor cells in infantile hemangioma[J]. Blood, 2004,103(4):1373-1375.
[7] Zou HX, Jia J, Zhang WF, et al. Propranolol inhibits endothelial progenitor cell homing: a possible treatment mechanism of infantile hemangioma[J]. Cardiovasc Pathol, 2013,22(3):203-210.
[8] Yoder MC, Mead LE, Prater D, et al. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals[J]. Blood, 2007,109(5):1801-1809.
[9] Ingram DA, Mead LE, Tanaka H, et al. Identification of a novel hierarchy of endothelial progenitor cells using human peripheral and umbilical cord blood[J]. Blood, 2004,104(9):2752-2760.
[10] Kleinman ME, Tepper OM, Capla JM, et al. Increased circulating AC133+CD34+endothelial progenitor cells in children with hemangioma[J]. Lymphat Res Biol, 2003, 1(4):301-307.
广东省企业技术研发与升级改造专项基金项目计划(2013B021800191)。
雷水生(E-mail: leishuisheng@126.com)
10.3969/j.issn.1002-266X.2017.18.034
R739.5
B
1002-266X(2017)18-0092-03
2016-10-26)

