浅析临床试验保险中的问题及对策*
彭 朋,元唯安,胡薏慧,汤 洁,朱蕾蕾,贺 敏,蒋 健
(上海中医药大学附属曙光医院国家药物临床试验机构,上海 201203,harryp_2007@hotmail.com)
浅析临床试验保险中的问题及对策*
彭 朋,元唯安,胡薏慧,汤 洁,朱蕾蕾,贺 敏,蒋 健**
(上海中医药大学附属曙光医院国家药物临床试验机构,上海 201203,harryp_2007@hotmail.com)
通过对我国临床试验保险现状、保障范围争议的分析,认为国内临床试验的参保率总体偏低,申办者、临床试验机构、研究者、保险公司的重视程度不一。因此,我国应提高对药物/医疗器械临床试验风险认识,要全面推行临床试验保险,必须经过政府部门、伦理委员会、申办者、临床试验机构、研究者、保险公司等各方共同努力。
临床试验;保险;风险控制
临床试验是指所有在人体(病人或健康志愿者)进行药物或医疗器械的系统性研究,其目的是收集试验药物或医疗器械的有效性和安全性的数据。[1]其中,未上市的药物或医疗器械占据着临床试验的主体,其人体安全性尚无可靠数据,对受试者的风险是一个值得关注的问题。临床试验保险是保护受试者权益的手段之一,已经逐步受到申办者和研究者的重视。
1 临床试验保险的意义
随着新药研发进程的逐步加快,越来越多的新药进入了临床试验环节。同时带来的也就是该过程中更多的不良反应(ADR)/不良事件(AE)。根据《国家药品不良反应监测年度报告(2015年)》所提供的1999—2015年全国药品ADR/AE报告数量,这段时间内我国的药品不良反应监测网络收到ADR/AE报告几乎呈逐年递增趋势(见图1),2015年全国药品不良反应监测网络收到ADR/AE报告139.8万份,较2014年增长5.3%。其中,新的和严重的ADR/AE报告393,734份,占同期报告总数的比例高达28.2%。[2]这意味着,即使是已经通过临床前的动物实验和临床试验验证的上市后品种,仍然可能存在较大的安全隐患,而尚未用于人体的新药自然更甚。
当严重不良事件(SAE)发生时,除了及时抢救患者、记录和报告外,最重要的便是给予受试者补偿,这可能会给申办者带来一定的经济和社会效益的损失,而临床试验保险将最大限度地降低这种损失。
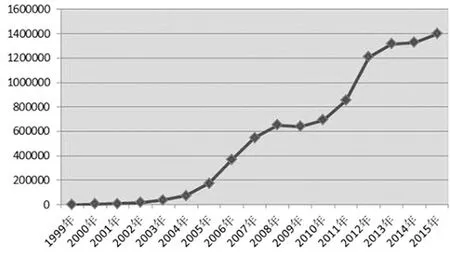
图1 1999—2015年我国药品不良反应/事件报告数量
2 临床试验保险的实质
首先,保险其实是一种风险转嫁的方法。申办者将赔偿责任部分或全部转嫁给保险公司,研究者通过保险实现自我保护,伦理委员会确保责任方具备赔偿能力。其次,购买临床试验保险的目的是保护受试者,而保护受试者是相关法律法规对申办者和研究者的要求,即受试者本身就有依法获得赔偿的权利,其依据包括《民法通则》《侵权责任法》《药物临床试验质量管理规范》(GCP)等,并非由保险所决定。如GCP第四十三条明确规定:“申办者应对参加临床试验的受试者提供保险,对于发生与试验相关的损害或死亡的受试者承担治疗的费用及相应的经济补偿”。[3]换而言之,无论申办者有没有购买保险,一旦发生SAE,申办者都有义务给予受试者相应的赔偿。第三,保险公司的赔付对象应该是申办者而非受试者,即发生SAE时申办者先给受试者赔偿,随后找保险公司理赔。当然,也可以经过双方协商,由保险公司直接拨款给受试者,但理论受益人一定是申办者。
3 我国临床试验保险现状
3.1 法律法规
GCP中虽然规定了“申办者应对参加临床试验的受试者提供保险”,但是并没有实施细则,也没有法律保障其强制执行,更没有规定如果不执行将有何惩罚措施。因此,国内的申办者,尤其是Ⅱ、Ⅲ期临床试验,几乎很少主动提供保险。
3.2 保险公司
由于临床试验保险涉及医药专业领域,国内的保险公司缺乏相关的专业人员,一般不太愿意参与到临床试验保险中,因此,国内从事临床试验方面保险的保险公司较少,如平安保险、民安保险、华泰保险和永诚财产保险公司等[4];此外,也有一些从事该险种的经纪公司,如美信保险经纪(上海)有限公司、北京中卫保险等在从事与临床试验中受试者权益保护的保险的相关工作。
3.3 申办者和研究者
临床试验保险的概念近几年在国内刚刚兴起,很多申办者对其重要性、流程、理赔成功率等都不太了解,故购买率较低。随着受试者自我权益保护意识的加强,有越来越多的临床试验机构和研究者认识到保险对于顺利完成试验、减少医疗纠纷的意义,但还是很少有机构会明确要求申办方必须购买保险,目前保险在国内大型临床试验机构的总体覆盖率不到40%[5]。即使机构在合同中规定必须购买临床试验保险,也可能因为保险、法律等方面知识的缺乏而很难审核所购买的保险是否可顺利获得足够金额的理赔。
4 临床试验保险主要保障范围争议
4.1 试验用药物/医疗器械
国内保险公司针对药物/医疗器械临床试验相关的保险责任一般描述为:因为试验用药物/器械导致AE发生,造成受试者遭受人身伤亡(包括残疾),对依法由被保险人承担赔偿责任的,保险公司根据保险合同的规定负责赔偿。然而,“试验用药物/器械”的定义并不明确,从字面上理解,“试验用药物/器械”应该仅指试验药物/器械,但实际上导致损害的也可能是安慰剂、阳性对照药物/器械、其他合并用药或合并治疗、试验相关检查(尤其是损伤性检查,如肝穿等)。如果上述情况引起的AE不计入理赔范围,显然不符合GCP和伦理的基本原则。
4.2 预期副作用
多数保单的免责条款中会提及“预期副作用”,但没有给出定义和描述。对于试验方案和知情同意书中明确的副作用,是否给予赔付,便是个值得商榷的问题。如果应该给予赔付,那么何种严重程度的预期副作用应赔付还是所有都赔付,也很难界定。
4.3 不参加试验也可能发生的损害
对于疾病的自然转归(主要指恶化),例如肿瘤晚期后死亡,是否由药物引起,本身就不明确,这类损害的理赔也存在着较大的争议。
4.4 精神疾病或精神损害
有些药物使用后可能产生精神症状,甚至增加自杀倾向,一旦发生会带来很大的赔偿争议。国家法律规定了精神损害的赔偿,而在格式保单中通常会被列入免责条款。
4.5 保单期限
很多保单对于期限的规定都是截止到某一时间点,而实际情况可能是到了时间节点试验并未结束。一般建议保单期限写成至试验的临床部分结束,如果保险公司规定必须以某一时间点作为时限,那么一旦到该时间点试验尚未结束,申办者应该及时通知保险公司,延长保单期限。
4.6 试验中心变化或方案调整
Ⅱ~Ⅳ期临床试验一般在多中心开展,试验过程很可能因为实际情况增加、减少或更换试验中心,或发生更改方案,这些信息宜及时告知保险公司更新保单,否则发生损害时可能被拒绝赔偿。
4.7 特别声明和拓展条款的解释
临床试验保险合同多使用保险公司的模板,如果申办方或研究机构有特殊要求,一般写在特别声明和拓展条款中。这样的特别声明和拓展条款应在合同中有明确的解释,如果解释不明确,可能发生SAE后无法获得理赔。
4.8 申办者和研究机构之间的矛盾
一般而言,申办者对于损害的赔偿倾向于采用包含类语句描述,即“满足下列条件时才给予赔偿”;研究机构倾向于采用排他类语句描述,即“除以下情况外都要给予赔偿(例如医疗事故)”。实际采用何种描述,建议由申办者和研究机构根据具体情况协商决定。
5 对购买临床试验保险的建议
5.1 完善临床试验保险相关法规
和欧美发达国家相比,我国临床试验尚处于起步阶段,以法律手段强制所有申办者购买保险并不现实,可以考虑首先制定相关指导原则,在GCP的基础上明确购买临床试验保险的流程和注意事项,使申办者购买临床试验有可行性。在此基础上,以Ⅰ期临床试验为起点,在某些风险较大的药物临床试验领域通过立法形式强制购买保险,逐步推广到Ⅰ期之后和其他领域的临床试验。
5.2 政府提供相应的优惠政策
由于愿意主动购买临床试验保险的申办者为数不多,导致保险公司提供专门的临床试验保险积极性也不高。如果政府能够对提供临床试验险的保险公司给予适当的税收优惠或资金补贴,保险公司将更愿意提供此类保险。同时,可以对购买临床试验保险的申办者,在其项目审批时给予一定的加速流程,甚至在一定范围内使加速程度和投保率、投保金额等因素相关。
5.3 伦理委员会加强对保险合同的审查和备案
伦理委员会在伦理审查时应该更关注试验保险,不仅要审核有无保险,还要审核保险合同是否符合我国目前的医疗状况,是否能够充分保护受试者的权益,也可以聘请具有保险行业背景的人员作为独立顾问参与讨论。同时,伦理委员会还应备案保险合同,必要时作为司法审判的依据。[6]对于外企在国内开展的临床试验,一般保险合同都是英文版,要注意备案中文版保险合同,因为如果保险合同在发生纠纷时才翻译成汉语,难免会发生翻译的倾向性。
5.4 培养临床试验机构、研究者和申办者的受试者权益保护意识
临床试验机构和研究者承接临床试验时,应该认真评估可能的不良反应,同时和申办者明确发生SAE时对受试者的保护和赔偿事宜,向申办者加强宣传临床试验保险的意义,使其意识到提供药物临床试验保险,不仅是对社会、试验机构、研究人员、受试者和其家属的承诺,也是帮助自己分担赔付风险,保险公司的专业评估将对试验提供更进一步的安全保障。而申办者购买保险时,应与保险公司充分讨论,对和临床试验药物/医疗器械有关或无关的SAE均须设定赔偿的细则,完善保险公司对临床试验的认识。
5.5 保险公司优化临床试验保险相关流程
大多数保险公司确实会因为缺乏医药专业的人员而很难在制定理赔方案时充分理解临床试验全过程及可能的风险,故建议聘请医药领域的专家作为理赔顾问,或加强培养同时具备保险行业和医药专业知识的人员,共同参与风险评估、保额估算等事宜,从而尽可能缩短理赔时间,为受试者争取更多的补偿[5]。
[1] 马艳彬,李竹,杨牧,等.浅谈我国医疗器械临床试验中的问题与对策[J].中国药事,2015,29(3):229-232.
[2] 国家食品药品监督管理总局.国家药品不良反应监测年度报告(2015 年)[R/OL].(2016-07-13)[2016-08-10].http://www.sda.gov.cn/WS01/CL0844/158940.html.
[3] 国家食品药品监督管理总局.药物临床试验质量管理规范(局令第3号)[A/OL].(2003-08-06)[2016-07-14].http://www.sda.gov.cn/WS01/CL0053/24473.html.
[4] 单爱莲,梁雁,崔一民.在新药与医疗器械临床试验中为受试者提供保险的调查与分析[J].中国临床药理学杂志,2013,29(7):483-487.
[5] 汶柯,王瑾,王睿.新药临床试验保险应成“必选项”[J].中国新药与临床杂志,2014,33(1):19-21.
[6] 董晓峰,范贞.药物临床试验责任保险保障案例的分析[J].中国临床药理学杂志,2015,31(24):2474-2476.
〔修回日期 2016-11-04〕
〔编 辑 曹欢欢〕
Discussion on the Issues and Countermeasures in Clinical Trial Insurance
PENGPeng,YUANWeian,HUYihui,TANGJie,ZHULeilei,HEMin,JIANGJian
(NationalDrugClinicalTrialInstitution,ShuguangHospitalAffiliatedtoShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China,E-mail:harryp_2007@hotmail.com)
Through analyzing the current situation and coverage controversy of Chinese clinical trial insurance, this paper stated that the attending insurance rate in domestic clinical trials was entirely low. The sponsors, clinical trial institutions, investigators and insurance companies paid attention of different levels to clinical trial insurance. Therefore, the risk awareness of drug/medical device clinical trials should be enhanced. It is necessary to give impetus to clinical trial insurance system, during which all parties need to make a joint effort including government departments, ethics committees, sponsors, clinical trial institutions, investigators and insurance companies.
Clinical Trial; Insurance; Risk Control
国家“重大新药创制”科技重大专项创新药物研究开发技术平台建设(课题编号:2012ZX09303009-001);上海市中医药事业发展三年行动计划项目(ZY3-CCCX-2-1003)
**通信作者,E-mail:jiangjiansg@126.com
R-052
A
1001-8565(2017)03-0328-03
10.12026/j.issn.1001-8565.2017.03.17
2016-09-03〕

