基于对比增强流场的2型糖尿病患者颈动脉窦区壁剪应力分布分析
梁 婷,董 云,崔 峥,高 一,魏 颖,刘 怡,张 波,郝楠馨,陈 明
(同济大学附属东方医院医学超声科,上海 200120)
心脏、血管影像学
基于对比增强流场的2型糖尿病患者颈动脉窦区壁剪应力分布分析
梁 婷,董 云,崔 峥,高 一,魏 颖,刘 怡,张 波,郝楠馨,陈 明*
(同济大学附属东方医院医学超声科,上海 200120)
目的 采用对比增强流场(CEFF)技术观察2型糖尿病(T2DM)患者颈动脉窦区壁面剪应力(WSS)的分布规律。方法 选取47例T2DM患者和25名健康志愿者(对照组),并根据颈总动脉内中膜厚度(IMT)将T2DM患者分为IMT正常组(n=21)和IMT增厚组(n=26),采用CEFF分析软件,计算颈动脉窦区WSS,绘制相应WSS空间分布图,记录颈内动脉起始段后壁WSS值并进行统计学分析。结果 3组颈动脉窦区均存在两个低WSS区和一个高WSS区:颈总动脉远端至颈内动脉起始段后壁存在大范围低WSS区,颈总动脉远端前壁存在小范围低WSS区,颈内动脉起始段前壁为高WSS区。IMT正常组[(3.39±0.60)dyne/cm2]和IMT增厚组[(2.58±0.46)dyne/cm2]患者颈内动脉后壁WSS值均较对照组[(3.74±0.53)dyne/cm2]显著减低(P均<0.05);IMT增厚组较IMT正常组减低(P<0.05)。结论 CEFF图像技术可初步定量检测动脉WSS,有望早期、可视化评估颈动脉硬化。
颈动脉;壁面剪应力;糖尿病,2型;对比增强流场;超声检查;造影剂
动脉血管壁的壁面剪应力(wall shear stress, WSS)是指单位面积上由血管内壁表面流动的液体产生的接近管壁的切向摩擦力,WSS可直接作用于血管内皮细胞[1],调节内皮基因表达[2],改变血管活性介质的产生,从而引起血管结构与功能的变化。现已证实WSS与动脉粥样硬化(atherosclerosis, AS)的形成密切相关[3]。2型糖尿病(type 2 diabetes mellitus, T2DM)患者易并发AS,也是AS的独立危险因素之一[4]。AS常发生于大血管分叉或弯曲处,而颈动脉窦区同时存在分叉和弯曲,为AS的好发区域。目前关于糖尿病患者颈动脉窦区WSS空间分布的报道较少,因此,本研究采用对比增强流场(contrast enhanced flow field, CEFF)技术获得T2DM患者颈动脉窦区的WSS,分析T2DM颈动脉窦WSS的分布规律,探讨CEFF图像分析技术评估颈动脉窦区WSS的价值。
1 资料与方法
1.1 一般资料 选择2014年9月—2015年11月间在我院行颈动脉超声检查的T2DM患者47例,患者均符合2014年美国糖尿病学会诊疗标准[5],根据病史和目前所使用的药物,排除高血脂、高血压、吸烟、服用血管活性药物及颈动脉狭窄等病史,且糖化血红蛋白(HbA1c)≥6.5%或空腹血糖(FPG)浓度≥7.0 mmol/L或口服葡萄糖耐量试验(OGTT)2 h血糖浓度≥11.1 mmol/L。根据颈总动脉内中膜厚度(intima-media thickness, IMT)将患者分为2组:①IMT正常组(IMT<0.9 mm)21例,其中男15例,女6例,年龄33~69岁,平均(48.2±8.0)岁;②IMT增厚组(0.9 mm≤IMT<1.5 mm)26例,其中男18例,女8例,年龄31~79岁,平均年龄(55.2±13.9)岁。选择同期与IMT正常组年龄、性别构成相匹配的正常人25名作为对照组,其中男16名,女9名,年龄26~62岁,平均(45.0±8.7)岁。对照组纳入标准:无心血管危险因素如吸烟、高血脂、糖尿病、高血压及特殊家族史,经体格检查、心电图及常规超声心动图检查未发现心脏疾病,心率在60~90次/分。本研究经本院伦理委员会批准,所有受检者均签署知情同意书。
空腹抽取外周静脉血,测量受试者的FPG、 HbA1c、总胆固醇(total cholesterol, TC)、甘油三脂(triglyceride, TG)、高密度脂蛋白(high density lipoprotein, HDL)、低密度脂蛋白(low density lipoprotein, LDL)等,血液标本由同一实验室测定。测量并记录受试者身高、体质量、血压值。
1.2 仪器与方法 采用Esaote MyLab Twice型彩色多普勒超声诊断仪,LA523探头,频率7.5~10.0 MHz。取颈动脉长轴切面,分别测量左、右侧颈动脉分叉处下方约2 cm处颈总动脉IMT,包括近侧壁及远侧壁共测量4处,取其平均值。
超声造影采用LA522探头,频率5.0~7.5 MHz。 超声造影剂为声诺维,配制浓度为1.5 μg/ml(约6.7×106个/ml)的微泡悬混液。
所有受试者检查前平静休息15 min,取平卧位,充分暴露颈部,头部偏向对侧45°。探头置于颈部由近心端向远心端先横切、后纵切扫查,从外向内扫查血管纵切面,确保超声切面通过血管中轴,使颈动脉分叉上下各2 cm范围均在图像采集范围内。选定最佳造影切面后,经患者肘静脉快速注入2.4 ml造影剂,并跟注5 ml 生理盐水。尽量保持观察切面不变,图像尽量缩小在超声前场。转换至超声造影模式,同时按下计时键和动态存储键,连续观察3 min动态图像。以上图像采集均由同1名资深血管超声医师完成。
1.3
图像分析技术 CEFF图像分析技术由同济大学附属东方医院、中国科学院深圳先进研究院、上海大学通信与信息工程学院共同研制,其以超声粒子图像测速(echo particle image velocimetry, E-PIV)为技术核心,应用降噪处理、图像分割、互相关技术、图像配准、灰度共振及亚像素精度等信号处理技术,实现对颈动脉血管腔内血流全流场流体力学的实时高精度定量计算,并将这种流体力学改变进行可视化处理,实时绘制颈动脉血管流体的向量视图,包括血流速度矢量图、剪应力变化等视图。
1.4 颈动脉WSS分布图及局部WSS值的定量分析 选取左侧颈动脉窦区造影图像,通过CEFF技术统计血管在一个心动周期内二维流场平均血流速度分布及速度梯度分布,计算WSS值,绘制WSS分布图(图1)。笔者在预备试验中发现,颈动脉窦二维超声图像中颈内动脉起始段后壁的超声图像相对较为清晰,CEFF图像分析技术采集相关图像的WSS值可重复性相对较好,此区域亦为颈动脉粥样硬化斑块的好发区域[6],故选择在左侧颈内动脉起始段至其远心端0.5 cm处的后壁图像中截取ROI,用于定量分析WSS值(图1)。另采用CEFF技术计算对照组左侧颈动脉分叉处下方1.5~2.0 cm处颈总动脉WSS平均值,与采用传统Hagen-Poiseuille公式计算相同区域的WSS值进行比较。随机抽取15名受试者,由同1名检查者间隔1天后重复采集颈动脉超声造影图像,测量颈内动脉起始段后壁WSS值。
1.5 统计学分析 采用SPSS 19.0统计分析软件,计量资料以±s表示;CEFF技术与Hagen-Poiseuille公式法WSS值如服从正态分布,采用配对t检验,如不服从正态分布则采用Satterthwaite近似t检验;3组间计量资料比较采用单因素方差分析,如方差不齐则采用单向分类方差分析,如方差齐则采用LSD法行两两比较。P<0.05为差异有统计学意义。采用Bland-Altman法分析同一检查者2次测量WSS值的误差。
2 结果
3组受检者一般资料见表1。3组血压、TG差异无统计学意义(P均>0.05);IMT正常组和IMT增厚组患者的体质量指数、TC、HbA1c均高于对照组(P均<0.05),HDL低于对照组(P均<0.05);IMT增厚组年龄及IMT高于IMT正常组(P均<0.05)和对照组(P均<0.05);IMT增厚组LDL高于对照组(P<0.001);3组间HDL两两比较差异均有统计学意义(P均<0.05),见表2。
对照组采用CEFF技术测得的左侧颈总动脉血流WSS值为(7.13±0.55)dyne/cm2,传统Hagen-Poiseuille公式法结果为(7.48±1.14)dyne/cm2,差异无统计学意义(t=1.462,P=0.157)。
对照组与IMT正常组和IMT增厚组颈动脉窦区WSS分布模式相同,均存在2个低WSS区和1个高WSS区:颈总动脉远端至颈内动脉起始段后壁存在大范围低WSS区,颈总动脉远端前壁存在小范围低WSS区,颈内动脉起始段前壁为高WSS区(图2)。
CEFF图像分析技术所测3组颈内动脉起始段后壁WSS值见表1,3组间两两比较结果见表2,IMT正常组和IMT增厚组的WSS值低于对照组(P均<0.05),且IMT正常组与IMT增厚组的WSS值差异有统计学意义(P<0.001)。
Bland-Altman分析颈内动脉起始段WSS值结果显示,同一检查者两次测量的一致性较好(图3)。
表1 3组临床资料比较(±s)

表1 3组临床资料比较(±s)
组别年龄(岁)SBP(mmHg)DBP(mmHg)体质量指数(kg/m2)TC(mmol/L)TG(mmol/L)IMT正常组(n=21)48.2±8.0120.4±7.976.8±7.925.8±2.04.27±0.791.23±0.44IMT增厚组(n=26)55.2±13.9117.5±7.775.1±7.724.9±1.94.55±0.621.26±0.28对照组(n=25)45.0±8.7115.8±7.672.2±6.923.1±2.13.38±0.691.32±0.39F值6.0172.1182.2655.88719.3230.374P值0.0040.1280.1110.004<0.0010.689组别HDL(mmol/L)LDL(mmol/L)FPG(mmol/L)HbA1c(%)IMT(mm)WSS(dyne/cm2)IMT正常组(n=21)1.08±0.212.77±0.6015.03±0.4912.05±2.670.79±0.043.39±0.60IMT增厚组(n=26)0.97±0.123.01±0.3211.44±3.6512.10±2.641.14±0.172.58±0.46对照组(n=25)1.26±0.202.53±0.465.19±0.495.16±0.560.77±0.053.74±0.53F值16.8496.92529.91482.85793.30931.793P值<0.0010.002<0.001<0.001<0.001<0.001
注:SBP:收缩压;DBP:舒张压

表2 3组间均数两两比较P值(LSD法)
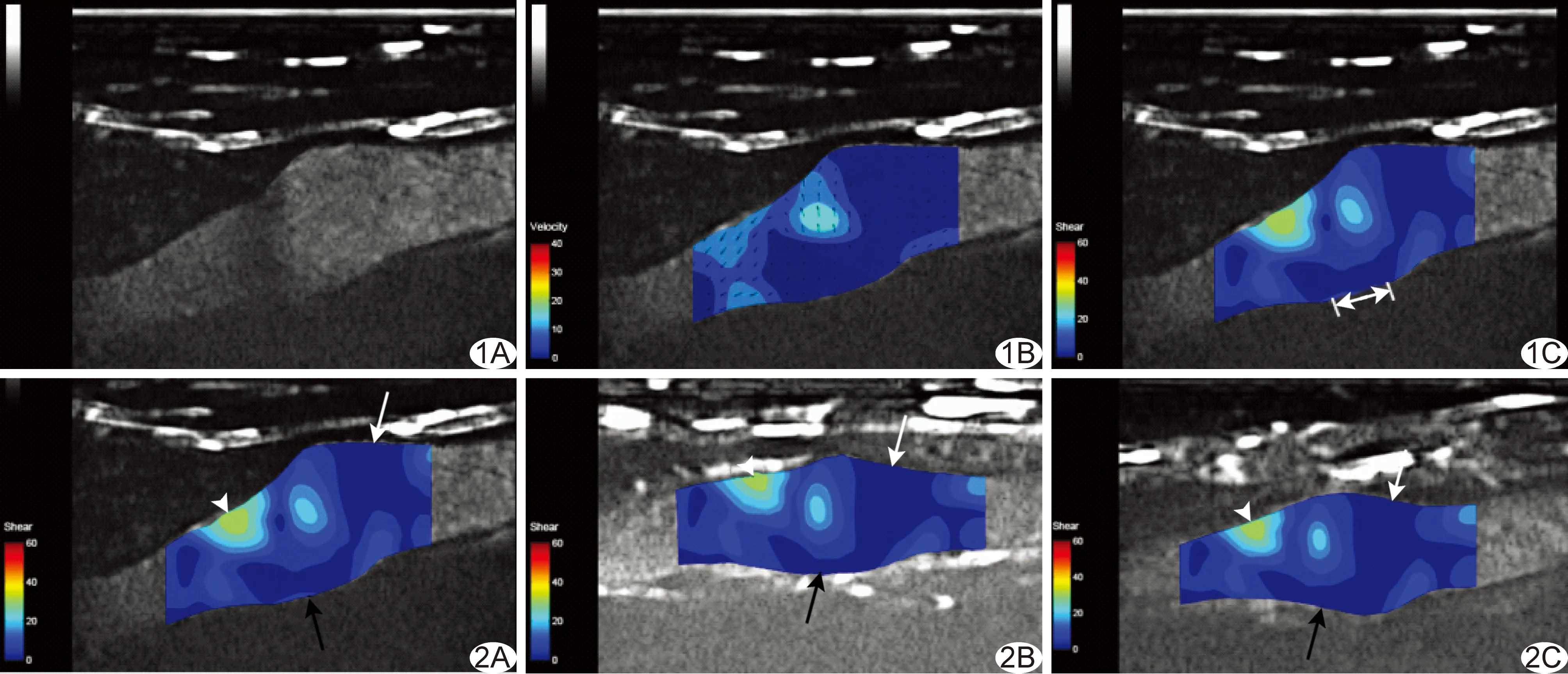
图1 CEFF技术分析健康志愿者颈动脉窦区造影图像

图3 Bland-Altman法分析同一检查者两次测量颈内动脉起始段WSS值的散点图
3 讨论
WSS是流动血液作用于内皮细胞壁的摩擦力[7],低WSS可以作为胞外信号调节转录基因,激发AS表型表达[8];又可直接作用于动脉壁内皮细胞,刺激动脉壁内中膜增厚导致AS[9-10]。T2DM通过糖化终产物引起血管内皮细胞炎症及血栓性反应,使患者血管内皮细胞容易受损,从而更易进展为AS,在该过程中,WSS的病理性改变也起到促进作用[11-12]。既往多采用Hagen-Poiseuille公式法粗略计算整条血管的平均WSS值,对于颈动脉窦等复杂血管区域无法评估WSS的分布状况,目前仅少量研究报道采用超声[13-14]或MR[15-16]方法尝试观察动脉WSS分布。
E-PIV技术是粒子图像测速(particle image velocimetry, PIV)技术与超声波影像技术相结合,以超声造影微泡作为流场示踪粒子,利用速度向量计算获得流场信息[17]。本研究所采用的CEFF技术属E-PIV分析的一种改进方法,CEFF技术采用图像互相关模板匹配算法,通过亚像素边缘检测方法增加计算精度,采用中值滤波进行速度矢量修正,从而使速度测量的精确度较传统E-PIV有大幅提高;在具备高空间分辨率的同时,还能记录整个测量平面内流体流动的信息,且在时间维度上,记录多幅连续测量结果,适用于研究血管分叉处涡流、湍流等复杂流动及其随时间的变化[18]。本研究发现所有受检者颈总动脉远端至颈内动脉起始段后壁存在大范围低WSS区,颈总动脉远端前壁存在小范围低WSS区,颈内动脉起始段前壁为高WSS区,此WSS分布模式与既往研究[19-20]报道相符。
本研究比较CEFF技术与传统Hagen-Poiseuille公式法计算颈总动脉WSS值,差异无统计学意义(t=1.462,P=0.157),Hagen-Poiseuille公式法计算管腔规则、血流平稳的颈总动脉WSS值准确性较高,提示CEFF技术计算的WSS值同样可信。本研究对受试者颈内动脉起始段后壁WSS进行定量测量,发现与对照组比较,T2DM患者WSS降低发生在IMT增厚之前,提示在AS形成与发展进程中,血管壁力学性质的改变可能发生于血管壁解剖学的显著变化之前。而IMT增厚患者的WSS进一步降低,提示低WSS与IMT增厚可能有相互促进作用。
本研究的局限性:本研究纳入的T2DM患者病程为5~18年,FPG值亦不等,未根据病程、FPG值分组,也未讨论病程和FPG对WSS的影响;为便于组间比较,本研究所测颈动脉WSS值以一个心动周期WSS平均值表示,未将心动周期不同时相的动态WSS值列出;样本量较小,可能会出现一定的分析误差;未进行不同检查者间测量误差的分析。今后将进一步扩大样本量,对接受血糖控制治疗的患者进行远期随访,更准确地评价CEFF技术的应用价值。
综上所述,CEFF图像技术可初步定量检测动脉WSS,有望早期、可视化评估颈动脉AS。
[1] Oshinski JN, Curtin JL, Loth F. Mean-average wall shear stress measurements in the common carotid artery. J Cardiovasc Magn Reson, 2006,8(5):717-722.
[2] Chan SY, White K, Loscalzo J. Deciphering the molecular basis of human cardiovascular disease through network biology. Curr Opin Cardiol, 2012,27(3):202-209.
[3] Doriot PA. Some unusual considerations about vessel walls and wall stresses. J Theor Biol, 2003,221(1):133-141.
[4] Sarwar N, Gao P, Seshasai SR, et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: A collaborative meta-analysis of 102 prospective studies. Lancet, 2010,375(9733):2215-2222.
[5] American Diabetes Association. Standards of medical care in diabetes—2014. Diabetes Care, 2014,37(Suppl 1):S14-S80.
[6] Harloff A. Carotid plaque hemodynamics. Interv Neurol, 2012,1(1):44-54.
[7] Davies PF. Hemodynamic shear stress and the endothelium in cardiovascular pathophysiology. Nat Clin Pract Cardiovasc Med, 2009,6(1):16-26.
[8] Malek AM, Alper SL, Izumo S. Hemodynamic shear stress and its role in atherosclerosis. JAMA, 1999,282(21):2035-2042.
[9] Rossi J, Rouleau L, Tardif JC, et al. Effect of simvastatin on Kruppel-like factor 2, endothelial nitric oxide synthase and thrombomodulin expression in endothelial cells under shear stress. Life Sci, 2010,87(3-4):92-99.
[10] Cunningham KS, Gotlieb AI. The role of shear stress in the pathogenesis of atherosclerosis. Lab Invest, 2005,85(1):9-23.
[11] Maria Z, Yin W, Rubenstein DA. Combined effects of physiologically relevant disturbed wall shear stress and glycated albumin on endothelial cell functions associated with inflammation, thrombosis and cytoskeletal dynamics. J Diabetes Investig, 2014,5(4):372-381.
[12] Shah AS, Urbina EM, Khoury PR, et al. Lipids and lipoprotein ratios: Contribution to carotid intima media thickness in adolescents and young adults with type 2 diabetes mellitus. J Clin Lipidol, 2013,7(5):441-445.
[13] Wang C, Chen M, Liu SL, et al. Spatial distribution of wall shear stress in common carotid artery by color Doppler flow imaging. J Digit Imaging, 2013,26(3):466-471.
[14] 张玲,陈晓旭,周欣彤,等.利用血流剪应力定量分析软件评价颈动脉粥样硬化.中国医学影像技术,2014,30(2):214-218.
[15] Papathanasopoulou P, Zhao S, Köhler U, et al. MRI measurement of time-resolved wall shear stress vectors in a carotid bifurcation model, and comparison with CFD predictions. J Magn Reson Imaging, 2003,17(2):153-162.
[16] Papaioannou TG, Stefanadis C. Vascular wall shear stress: Basic principles and methods. Hellenic J Cardiol, 2005,46(1):9-15.
[17] Zheng H, Barker A, Shandas R. Predicting backscatter characteristics from micron-and submicron-scale ultrasound contrast agents using a size-integration technique. IEEE Trans Ultrason Ferroelectr Freq Control, 2006,53(3):639-644.
[18] Kim HB, Hertzberg J, Lanning C, et al. Noninvasive measurement of steady and pulsating velocity profiles and shear rates in arteries using echo PIV: In vitro validation studies. Ann Biomed Eng, 2004,32(8):1067-1076.
[19] Younis HF, Kaazempur-Mofrad MR, Chan RC, et al. Hemodynamics and wall mechanics in human carotid bifurcation and its consequences for atherogenesis: Investigation of inter-individual variation. Biomech Model Mechanobiol, 2004,3(1):17-32.
[20] Zhao SZ, Ariff B, Long Q, et al. Inter-individual variations in wall shear stress and mechanical stress distributions at the carotid artery bifurcation of healthy humans. J Biomech, 2002,35(10):1367-1377.
Wall shear stress distribution in carotid sinus of type 2 diabetes mellitus patients based on contrast enhanced flow field
LIANGTing,DONGYun,CUIZheng,GAOYi,WEIYing,LIUYi,ZHANGBo,HAONanxin,CHENMing*
(DepartmentofUltrasonography,ShanghaiEastHospitalofTongjiUniversity,Shanghai200120,China)
Objective To investigate the application of wall shear stress (WSS) in the carotid sinus of type 2 diabetes mellitus (T2DM) patients, and analyze the spatial distribution of WSS with contrast enhanced flow field (CEFF) quantitative visualization analysis software. Methods Totally 47 T2DM patients and 25 healthy subjects were investigated. According to the intima-media thickness (IMT) of common carotid artery (CCA), the T2DM patients were divided into IMT normal group (n=21) and IMT thickening group (n=26). WSS in the carotid sinus was calculated by CEFF analysis software, the corresponding spatial distribution maps of WSS were designed. WSS of the posterior wall of internal carotid artery (ICA) was recorded and statistical analysis. Results Both in the carotid sinus of healthy subjects and T2DM patients, there were two low WSS regions and one high WSS region. There were a large region of low WSS at the posterior wall of CCA and ICA, a small region of low WSS at the anterior wall of CCA, and a high WSS region at the anterior wall of ICA. The WSS at the posterior wall of ICA both in the IMT normal group [(3.39±0.60)dynes/cm2] and IMT thickening group [(2.58±0.46)dynes/cm2] were significantly lower than that in control group ([3.74±0.53]dynes/cm2, bothP<0.05). WSS in IMT thickening group was lower than that in IMT normal group (P<0.05). Conclusion CEFF quantitative visualization analysis might constitute an approach to assess the presence of early-stage arteriosclerosis by measuring the WSS in the carotid sinus.
Carotid artery; Wall shear stress; Diabetes mellitus, type 2; Contrast enhanced flow field; Ultrasonography; Contrast media
上海市卫生和计划生育委员会科研课题面上项目(201440335)、东方起航计划科研项目青年基金(DFQH-Q16)。
梁婷(1984—),女,河北沧州人,硕士,主治医师。研究方向:超声造影、肿瘤热消融。E-mail: liangtingdfyy@163.com
陈明,同济大学附属东方医院医学超声科,200120。E-mail: mingchen1283@vip.163.com
2016-09-26
2017-02-13
10.13929/j.1003-3289.201609122
R587.1; R445.1
A
1003-3289(2017)04-0529-05

