戒断时间效应对海洛因成瘾大脑小世界网络影响的fMRI研究
陈佳杰,李永斌,魏 璇,刘洁蓉,朱 佳,李 玮,李 强,王 玮
(第四军医大学唐都医院放射诊断科,陕西 西安 710038)
中枢神经影像学
戒断时间效应对海洛因成瘾大脑小世界网络影响的fMRI研究
陈佳杰,李永斌,魏 璇,刘洁蓉,朱 佳,李 玮,李 强*,王 玮
(第四军医大学唐都医院放射诊断科,陕西 西安 710038)
目的 探讨不同戒断时间对海洛因成瘾者大脑静息态下功能网络的影响。方法 16名强制戒断11~13个月的海洛因成瘾者(PA12组)、20名强制戒断5~7个月的海洛因成瘾者(PA6组)纳入静息态fMRI研究。运用图论理论构建小世界脑网络,比较两组海洛因成瘾者小世界特性及核心节点特性,分析核心节点与戒断时间的相关性。结果 两组脑网络均具有小世界特性(γ≈1、λ≫1)且差异无统计学意义(P>0.05);PA12组较PA6组脑网络的左侧中央前回及左侧海马旁回节点介数值降低,左侧楔叶、左侧颞极及右侧枕中回节点介数值升高(P均<0.05)。左侧中央前回(r=—0.52,P=0.001)、左侧海马旁回(r=—0.49,P=0.002)节点介数值均与戒断时间呈负相关,右侧枕中回节点介数值与戒断时间呈正相关(r=0.49,P=0.003)。结论 戒断5~7个月后,海洛因成瘾者大脑网络小世界拓扑结构趋于稳定;长期戒断有助于降低成瘾者对毒品的相关记忆和潜在觅药行为,恢复视觉空间注意能力。
海洛因依赖;强制戒断;磁共振成像
海洛因成瘾是一种以戒断—复吸反复循环为特性的慢性功能性脑病[1]。强制戒断(protracted abstinence, PA)是治疗海洛因成瘾的普遍方案,但该方案缺乏系统的基础与临床研究,治疗机制尚不清楚,且缺乏有效的疗效评价。2008年,我国新禁毒法将强制戒断时间由原来的3~6个月延长到1~3年,更长的强制戒断时间对海洛因成瘾者大脑功能的影响目前尚不清楚。脑作为一个有机的整体完成各项复杂任务,以往成瘾相关研究[2]多局限于特定脑区,而忽略了脑功能的整体性。本研究采用静息态fMRI技术对PA的海洛因成瘾者进行长期纵向研究,并结合小世界理论探讨大脑功能网络拓扑结构及核心节点,探讨不同PA时间对海洛因成瘾者大脑功能的影响。
1 资料与方法
1.1 一般资料 收集2014年10月—2015年10月于西安市蓝田戒毒所招募的PA时间为5~7个月的海洛因成瘾者25名(PA6组))及PA为11~13个月的海洛因成瘾者20名(PA12组)。戒断者均符合DSM-Ⅴ物质成瘾诊断标准,除海洛因和尼古丁外无其他物质成瘾史,无头颅外伤史、神经系统疾病史,无严重心、肝、肾功能不全史等。受试者吗啡尿检均呈阴性。该研究经本院伦理委员会审批通过。受试者均自愿签署知情同意书。
1.2 仪器与方法 采用GE Signa 3.0T MR仪和8通道头线圈。静息态功能序列扫描前告知受试者注视反光镜中黑色背景中的白色“+”,保持安静、放松,不思考特殊事物,并确保头部严格制动。扫描方案与参数同文献[3]。由2名影像主治医师对受试者脑结构图进行审阅,排除脑部异常者。
1.3 数据分析
1.3.1 数据预处理 利用DPARSFA 2.3软件进行影像数据预处理,包括时间校正、头动校正、空间标准化、回归协变量(6个头动参数、全脑信号、白质及脑脊液信号)[4],以6 mm核进行高斯平滑,去线性漂移,低频滤波(0.01~0.08 Hz)。PA6组的5名及PA12组的4名受试者因头动>1.5 mm或1.5°被排除,余36名受试者进入研究。
1.3.2 构建网络 采用自动解剖标记模板将大脑分割为90个ROI,提取每个ROI内所有体素BOLD信号均值[5-7],计算两两ROI的Pearson相关系数,并进行FisherZ变换,对矩阵取绝对值。网络设定稀疏度,构建加权网络。选择稀疏度主要遵循两个原则:①避免全连接;②保证连接稀疏性且孤立点尽量少[3]。最终确定稀疏度范围为0.12~0.50,步长为0.01[3]。
对每个阈值下的加权网络计算小世界参数:标准化的聚类系数(γ)、标准化的最短路径(λ)和节点参数(介数),对节点介数值大于组内平均值+2倍标准差的脑区定于为核心节点[8-9]。为测量节点在不同阈值下总的变化强度特性,计算其在稀疏度曲线下的面积[8]。
1.4 统计学分析 采用SPSS 20.0统计分析软件,组间计量资料比较采用两独立样本t检验,计数资料比较采用χ2检验。对组间小世界参数(γ、λ)比较采用两独立样本t检验(FDR校正)。对组间核心节点的比较采用两独立样本t检验,并对显著性差异的核心节点介数值与戒断时间进行相关性分析。P<0.05为差异有统计意义。
2 结果
PA12组与PA6组的年龄、性别、教育、每日吸烟量、海洛因食用情况、焦虑评分、抑郁评分和头动的差异均无统计学意义(P均>0.05),仅戒断时间差异有统计学意义(P<0.001,表1)。
2.1 小世界特性比较 通过不同稀疏度构建两组的大脑小世界网络,发现PA6组与PA12组均具有小世界拓扑特性(λ≈1、γ≫1),差异无统计学意义(P<0.05;FDR校正,图1)。2组具有差异的核心节点共22个,PA12组较PA6组脑网络的左侧中央前回、左侧海马旁回节点介数值显著性降低,左侧楔叶、左侧颞极及右侧枕中回节点介数值显著性升高(P均<0.05),见表2。
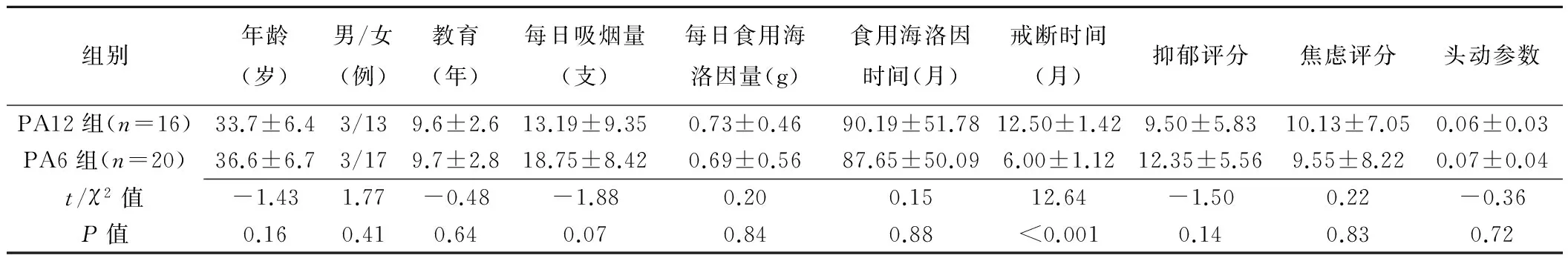
表1 两组一般资料比较
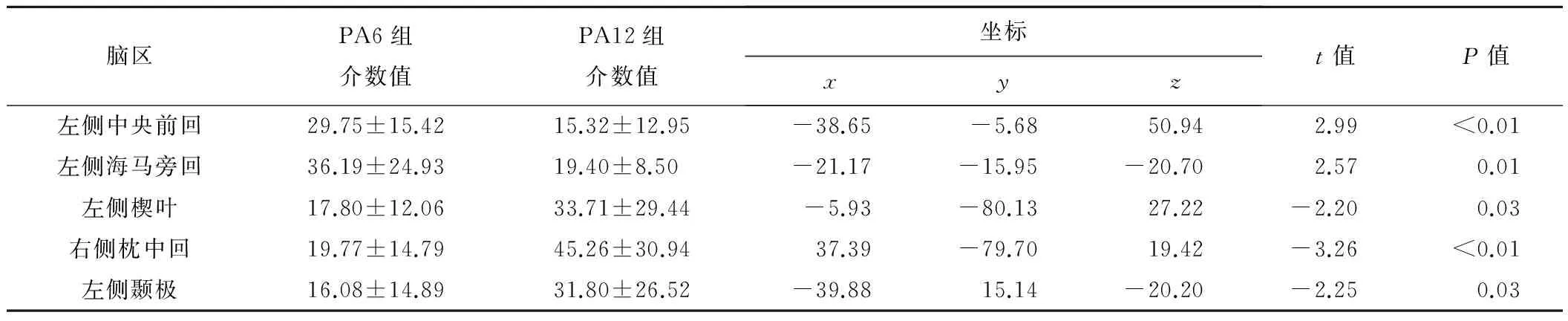
表2 PA6组与PA12组存在显著性差异的核心脑区节点
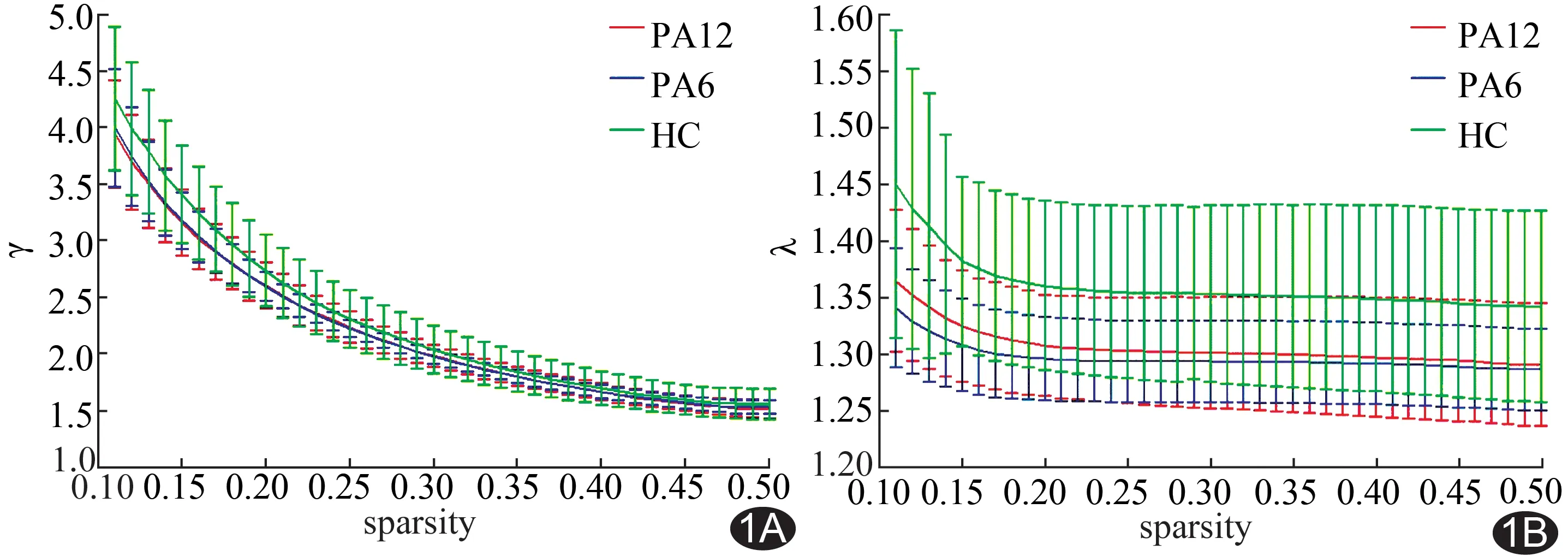
图1 PA6及PA12两组间脑功能网络小世界特性γ(A)、λ(B)均无显著性差异(P>0.05,FDR校正)
PA6组内脑网络节点介数值为24.8±0.9,核心节点的介数值>26.6(均数+2倍标准差);PA12组内脑网络节点介数值为24.8±1.7,核心节点的介数值>28.2(均数+2倍标准差)。两组的核心节点均包括广泛的额叶、基底节区和少量的枕叶、颞叶等20个脑区;PA6组脑网络核心节点还包括左侧中央前回、额上回、后扣带、枕中回,右侧额下回、额叶岛盖部、杏仁核、楔叶、梭状回,双侧辅助运动区、海马旁回及嗅球等15个脑区;PA12组脑网络核心节点还包括左侧中扣带、楔叶、顶上叶、颞极,右侧枕中回、壳核及角回等7个脑区(图2~4)。
2.2 相关性分析 对有显著性差异的5个核心节点脑区介数值与戒断时间进行相关性分析,发现戒断时间与左侧海马旁回(r=-0.49,P=0.002)、左侧中央前回呈负相关(r=-0.52,P=0.001),与右侧枕中回呈正相关(r=0.49,P=0.003),见图5。
3 讨论
本研究运用图论理论,发现海洛因成瘾者PA 5~7个月及11~13个月脑网络均具有小世界拓扑特性,但两组一些核心节点脑区属性存在显著差异(左侧中央前回、海马旁回、楔叶、颞极,右侧枕中回),且戒断时间与左侧海马旁回、左侧中央前回介数值呈负相关,与右侧枕中回介数值呈正相关。提示更长时间的戒断可能有助于降低成瘾者对毒品的相关记忆和潜在觅药行为,恢复视觉空间注意能力。
3.1 脑网络小世界特性 脑网络为探索人脑这一复杂系统提供了新的视角[5]。Slavador等[10]采用fMRI数据构建了正常被试基于脑区水平的大脑网络,并发现该网络具有小世界属性、高效率性及高拓扑稳定性。小世界网络是复杂网络的一种中间状态,是信息交换的最佳形态。λ表征小世界网络中节点到节点的最短路径长度,γ表征小世界网络中节点与周围节点相连的聚类程度,描述了大脑传递及处理信息功能的整合与分化[11]。
既往研究[3]发现,海洛因成瘾者大脑功能网络拓扑特性存在异常,趋向于随机网络。江桂华等[12]对美沙酮维持治疗的海洛因成瘾者进行研究,也得出类似的结果。本研究发现,PA 5~7个月及11~13个月的海洛因成瘾者脑网络具有小世界特性,组间差异无统计学意义,表明脑功能的整合和分化处于平衡状态,PA有利于脑网络拓扑结构的恢复,且拓扑结构趋于稳定。严雪娇等[13]发现长期戒断有利于海洛因导致的白质损伤恢复,可能有利于成瘾者认知功能的改善。脑解剖结构是功能的基础,白质结构有改善,继而功能可能恢复。
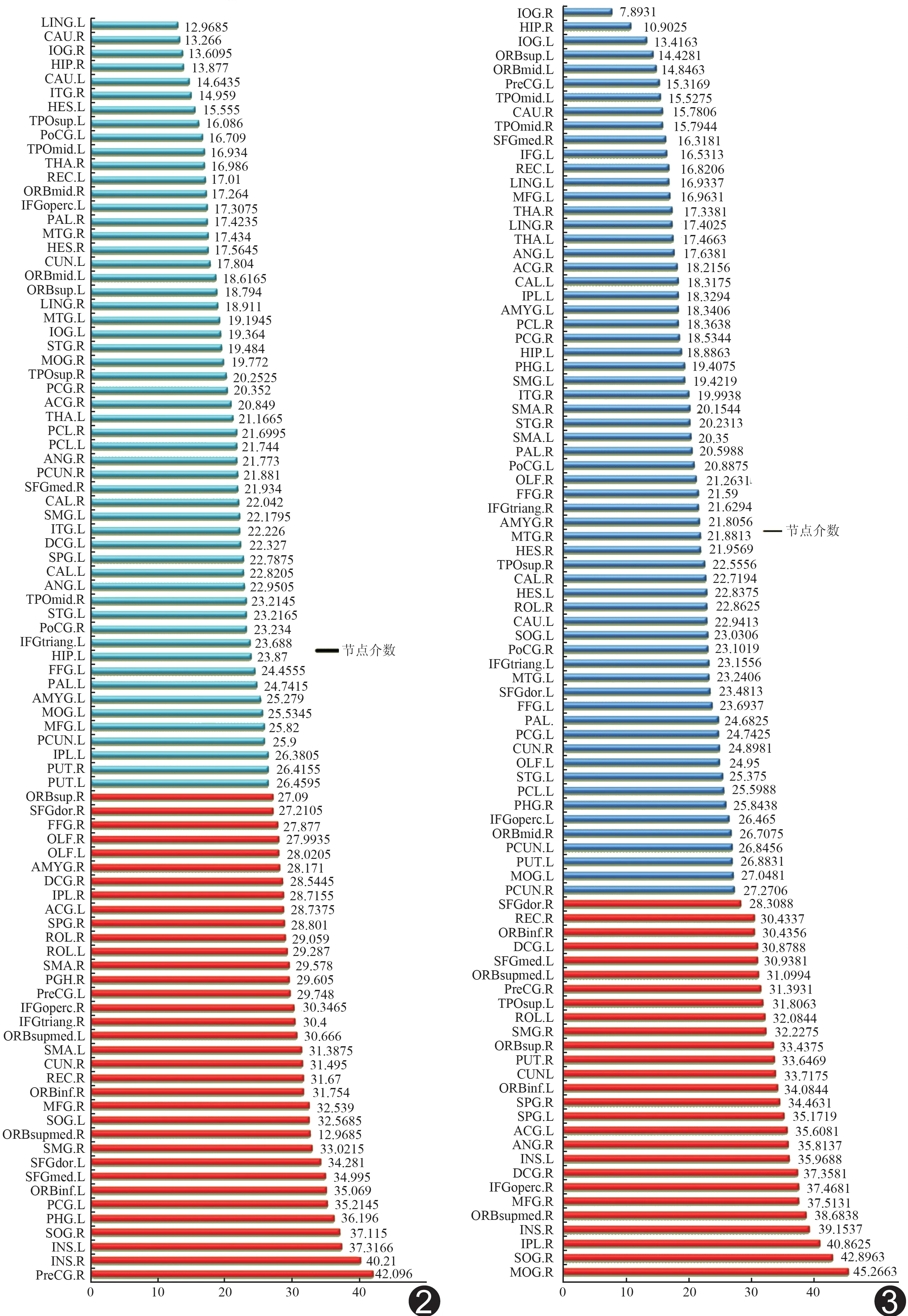
图2 PA6组脑网络节点 90个脑区节点,其中55个节点为非核心脑区(淡绿色),35个节点为核心节点脑区(红色)
3.2 脑网络核心节点特性 脑网络中存在某些关键核心节点脑区,对多个复杂认知过程信息相互整合起着重要作用,影响网络的连通性和完整性,为大脑功能的分化与整合提供结构基础[14]。介数是网络中对特定节点的最短路径与最短路径数量之和的比值,高介数节点在网络信息交换中起桥梁作用。利用介数值定义核心节点具有较高鲁棒性[15]。本研究发现,PA6组左侧中央前回、左侧海马旁回的介数值显著性高于PA12组,左侧楔叶、左侧颞极、右侧枕中回介数值显著性低于PA12组。左侧海马旁回、左侧中央前回的介数值与戒断时间呈负相关,右侧枕中回的介数值与戒断时间呈正相关。
海马旁回主要涉及记忆和情感等功能[16]。根据经典的成瘾学术理论[17],成瘾者对毒品所带来的欣快在不断刺激后,对该记忆异常增强。杜万萍等[18]发现网络成瘾者大脑海马旁回的局部一致性(regional hemogeneity, ReHo)值异常升高。因此认为,随着戒断时间的延长,海马旁回传递信息的能力下降,成瘾者对毒品异常的记忆能力可能下降。
中央前回为运动皮层,是运动激活的主要信息源。李磊等[19]发现,网络成瘾者大脑左侧中央前回的脑血流量明显增高,运动皮层异常活跃,故成瘾者存在不断的觅药行为。然而,随着PA延长,中央前回传递信息的能力下降,异常增高的运动能力可能也在不断恢复。
枕中回为视觉皮层的一部分,视觉信息的加工是人脑处理信息、高级脑功能的重要途径[20]。研究[3,21]表明,海洛因成瘾者枕中回等枕叶区域受损。本研究表明,经过一定时间的戒断治疗后,枕中回传递信息的能力不断增加,海洛因成瘾者空间注意能力逐渐恢复。
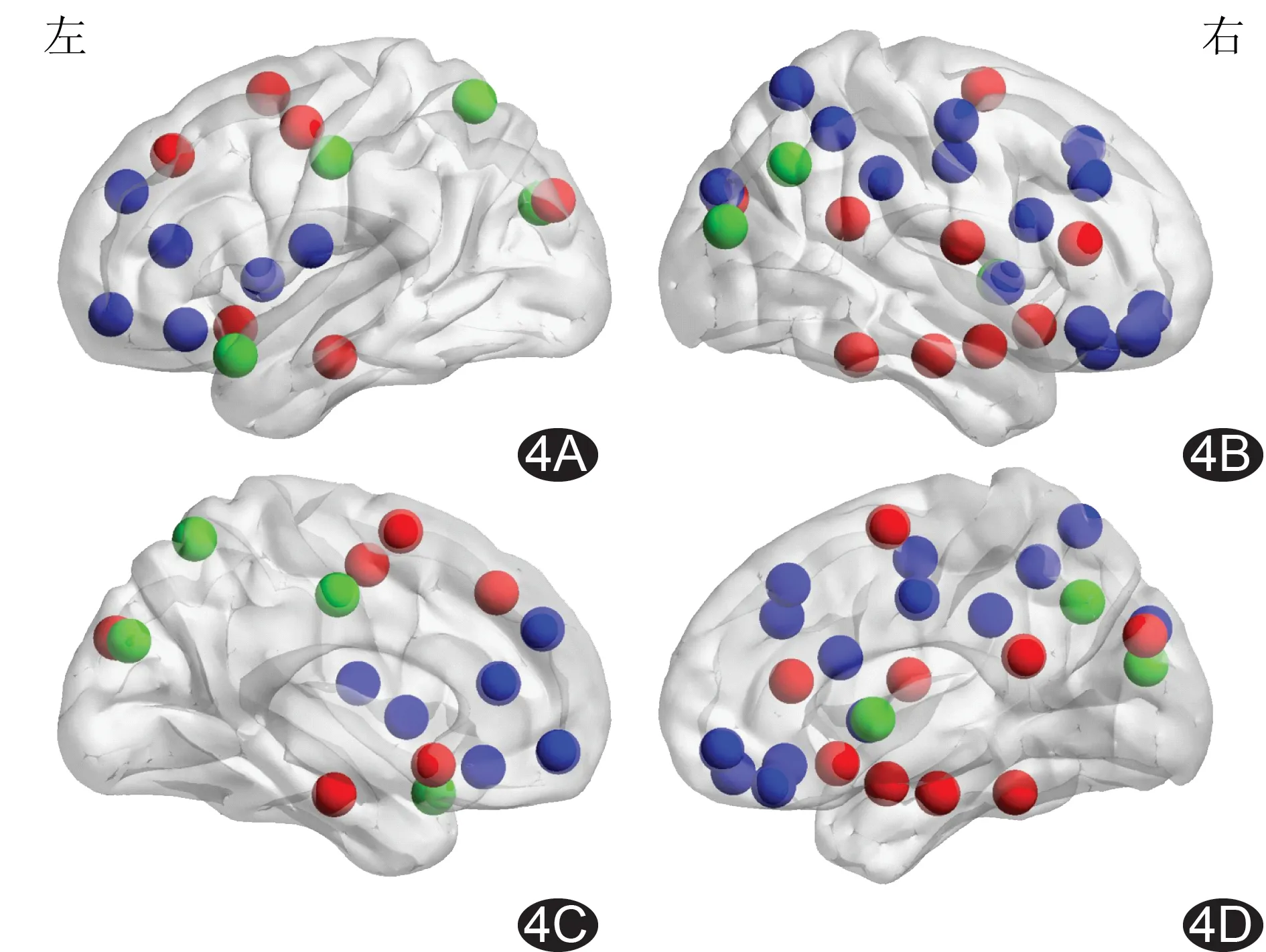
图4 PA6组与PA12组脑网络核心节点
本研究尚存在一定的局限性:①缺少正常被试,有待随后的研究中增加正常组以比较不同戒断时间的海洛因成瘾者与正常者间的差异;②尚不能明确节点间信息流,在今后的研究中尝试采用因果模型分析节点间相互作用。随后的研究中增加正常组以比较不同戒断时间的海洛因成瘾者与正常人间的差异。
综上所述,本研究提示长期戒断有助于海洛因成瘾者大脑网络小世界拓扑结构恢复及稳定,降低对毒品的记忆,恢复视觉空间注意能力,从而减少潜在的复吸风险。

图5 脑区介数值与戒断时间的相关性
[1] Zou F, Wu X, Zhai T, et al. Abnormal resting-state functional connectivity of the nucleus accumbens in multi-year abstinent heroin addicts. J Neurosci Res, 2015,93(11):1693-1702.
[2] Ma N, Liu Y, Li N, et al. Addiction related alteration in resting-state brain connectivity. Neuroimage, 2010,49(1):738-744.
[3] 陈佳杰,李强,王亚蓉,等.海洛因成瘾者大脑功能网络特性的功能MRI研究.中国医学影像学杂志,2015,23(10):730-734.
[4] Shin DJ, Jung WH, He Y, et al. The effects of pharmacological treatment on functional brain connectome in obsessive-compulsive disorder. Biol psychiatry, 2014,75(8):606-614.
[5] Liu Y, Liang M, Zhou Y, et al. Disrupted small-world networks in schizophrenia. Brain, 2008,131(Pt 4):945-961.
[6] 封亮,聂志余,王湘彬,等.静息态fMRI评价阿尔茨海默患者大脑功能网络效率变化.中国医学影像技术,2013,29(10):1570-1574.
[7] 赵小虎,王湘彬,王培军,等.正常老年人大脑功能网络的小世界性.中国医学影像技术,2011,27(10):2118-2121.
[8] He Y, Wang J, Wang L, et al. Uncovering intrinsic modular organization of spontaneous brain activity in humans. PloS One, 2009,4(4):e5226.
[9] Liu B, Chen J, Wang J, et al. Altered small-world efficiency of brain functional networks in acupuncture at ST36: A functional MRI study. PloS One, 2012,7(6):e39342.
[10] Salvador R, Suckling J, Coleman MR, et al. Neurophysiological architecture of functional magnetic resonance images of human brain. Cereb cortex, 2005,15(9):1332-1342.
[11] Tononi G, Edelman GM, Sporns O. Complexity and coherency: Integrating information in the brain. Trends Cogn Sci, 1998,2(12):474-484.
[12] 江桂华,黎超,田军章,等.海洛因成瘾者全脑功能网络拓扑结构异常的静息态功能磁共振成像研究.功能与分子医学影像学(电子版),2015,4(1):562-569.
[13] 严雪娇,李玮,王亚蓉,等.DTI评价戒断时间对海洛因成瘾者大脑白质完整性的影响.中国医学影像技术,2016,32(1):25-30.
[14] Achard S, Salvador R, Whitcher B, et al. A resilient, low-frequency, small-world human brain functional network with highly connected association cortical hubs. J Neurosci, 2006,26(1):63-72.
[15] 梁夏,王金辉,贺永.人脑连接组研究:脑结构网络和脑功能网络.科学通报,2010,55(16):1565-1583.
[16] 吴宁,李强,李玮,等.阿片类药物成瘾者基于杏仁核的Resting-statefMI研究.临床放射学杂志,2012,31(3):315-319.
[17] Volkow ND, Fowler JS, Wang GJ. The addicted human brain: Insights from imaging studies. J Clin Invest, 2003,111(10):1444-1451.
[18] 杜万萍,刘军,周顺科,等.基于ReHo方法的大学生网络成瘾静息功能磁共振成像研究.中国临床心理学杂志,2012,20(4):474-477.
[19] 李磊,陈雪,孙锦华.青少年网络游戏成瘾者脑灌注的改变.中国医学计算机成像杂志,2015,21(1):11-15.
[20] 方环海,王梅.大脑枕叶语言功能的研究进展.中国康复理论与实践,2008,14(8):739-742.
[21] 朱佳,王亚蓉,李强,等.功能磁共振评价海洛因依赖者脑局部一致性改变.中国医学影像技术,2014,30(12):1801-1804.
Effect of abstinence duration on brain small-world network characteristics in heroin addicts: Resting-state fMRI study
CHENJiajie,LIYongbin,WEIXuan,LIUJierong,ZHUJia,LIWei,LIQiang*,WANGWei
(DepartmentofRadiology,TangduHospital,FourthMilitaryMedicalUniversity,Xi'an710038,China)
Objective To investigate the effects of different abstinent duration on brain functional network of heroin addicts at resting state. Methods Sixteen heroin addicts during protracted abstinence for 11—13 months (PA12 group) and twenty heroin addicts during protracted abstinence for 5—7 months (PA6 group) were recruited in the resting-state functional MRI study. Graph theoretical methods were applied to construct topological organization of whole brain network and nodes betweenness of the networks in all subjects, and the between-group differences were analyzed. The correlation of the node betweenness with the abstinence duration was conducted. Results There was no significant difference (P>0.05) in the small world characteristic (γ≈1, λ≫1) between two groups. Compared with the PA6 group, the PA12 group demonstrated significantly decreased nodal betweenness in regions of left parahippocampal gyrus, left precentral gyrus, and significantly enhanced nodal betweenness in regions of the left cuneus, left temporal and right middle occipital gyrus (allP<0.05). Moreover, the betweenness of the left precentral gyrus (r=-0.52,P=0.001) and parahippocampal gyrus (r=-0.49,P=0.002) were negatively related with the abstinence duration, the betweenness of the right middle occipital was positively correlated with the abstinence duration (r=0.49,P=0.003). Conclusion The brain network small world topology of heroin addicts tend to be stable after 5—7 months of abstinence. Long-term abstinence may minimize the addict's memory of drugs and potential drug seeking behavior, and recover addicts' visual spatial attention function.
Heroin dependence; Protracted abstinence; Magnetic resonance imaging
国家自然科学基金(81371532、81401393、81671661)、第四军医大学科技发展基金(学2016XD263)、唐都医院科技创新发展基金(院2013LCYJ003)。
陈佳杰(1986—),男,四川仁寿人,硕士,助理工程师。研究方向:海洛因成瘾脑功能网络的改变。E-mail: ziliaowenjian_1@126.com
李强,第四军医大学唐都医院放射诊断科,710038。E-mail: tdqiangqiang@foxmail.com
2016-08-29
2017-01-17
10.13929/j.1003-3289.201608127
R742; R445.2
A
1003-3289(2017)04-0504-06

