顶空气相色谱法检测环戊丙酸雌二醇原料药中5种残留溶剂
杜碧莹
(广东省广州市药品检验所,广东 广州 510160)
·检验检测·
顶空气相色谱法检测环戊丙酸雌二醇原料药中5种残留溶剂
杜碧莹
(广东省广州市药品检验所,广东 广州 510160)
目的 建立检测环戊丙酸雌二醇原料药中5种残留溶剂的顶空气相色谱法。方法 色谱柱采用 Agilent DB-WAXetr毛细管柱(30m×250μm,0.5μm),程序升温,流速为1.5mL/min;进样方式为分流进样,分流比为10∶1;进样口温度为200℃,检测器为氢火焰离子化检测器,检测器温度为250℃;顶空瓶平衡温度为110℃,平衡时间为30min;进样量为1mL。按外标法进行定量分析。结果 环戊丙酰氯、乙酸乙酯、甲醇、乙醇、吡啶的检测质量浓度线性范围分别为25~100,250~1 000,150~600,250~1 000,12.5~50.0μg/m L,r分别为0.999 49,0.999 73,0.999 68,0.999 73,0.999 58,精密度试验结果的 RSD分别为1.4%,0.7%,1.4%,1.4%,2.5%(n=6);加样回收率分别为104.55%,93.74%,100.94%,96.42%,94.52%,RSD分别为1.19%,1.40%,1.68%,1.02%,3.50%(n=6);检出限为0.04~0.70μg/m L,定量限为0.10~2.5μg/m L。结论 该方法简单,准确,重复性好,可用于环戊丙酸雌二醇原料药中5种残留溶剂的测定。
环戊丙酸雌二醇;顶空气相色谱法;残留溶剂
环戊丙酸雌二醇为长效雌激素,作用比戊酸雌二醇强而持久,临床用于治疗卵巢功能不全、闭经、更年期综合征、老年性阴道炎和前列腺癌等,如环戊丙酸雌二醇与醋酸甲羟孕酮组成复方注射用避孕药(商品名Lunelle),可作为长效避孕针每月使用1次,并已获美国食品药物管理局(FDA)批准上市[1-4],临床应用广泛。企业在生产时使用了环戊丙酰氯、乙酸乙酯、甲醇、乙醇、吡啶等有机溶剂,由于残留溶剂无治疗作用,但又具有一定的毒性,且不同溶剂间可能会有毒性累加作用,故不能仅控制每种溶剂残留量的限度。目前,国内暂无环戊丙酸雌二醇的质量标准,溶剂残留量相关检测方法尚未见报道。根据药物杂质分析指导原则,残留溶剂作为杂质限量检查是质量控制指标之一[5-6]。参考文献[7-10]及残留溶剂指导原则要求,本研究中建立了测定环戊丙酸雌二醇原料药中5种残留溶剂的顶空气相色谱法,方法学验证结果表明,简便、灵敏,检测结果准确可靠,可作为环戊丙酸雌二醇原料药中残留溶剂控制的检测方法。现报道如下。
1 仪器与试药
1.1 仪器
Aglient7890A型气相色谱仪(安捷伦公司);氢火焰离子化检测器(FID);AglientG1888顶空进样器(上海安谱科学仪器有限公司)。
1.2 试药
环戊丙酰氯(批号为10120482,含量为98%),乙酸乙酯(批号为20101003-2,含量为99.5%),甲醇(批号为081029,含量为99.5%),乙醇(批号为20110718,含量为 99.7%),吡啶(批号为 20050302-2,含量为99.5% ),二甲亚砜(色谱纯,批号为 2011094,20110442,含量为99.9%),均购自广州化学试剂厂;环戊丙酸雌二醇(北京紫竹药业有限公司,批号分别为20110941,20110942,20110943)
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:AgilentDB-WAXetr毛细管柱(30m×250μm,0.5μm);程序升温:初始温度40℃,保持8 min,再以20℃ /min的速率升温至200℃,保持5 min;载气:氮气;流速:1.5 m L/min;进样方式:分流进样,分流比10∶1;进样口温度:200℃。检测器为氢火焰离子化检测器,检测器温度:250℃;顶空瓶平衡温度:110℃,平衡时间:30min;进样量:1m L。
系统适用性试验:取对照品溶液顶空进样,各组分色谱峰间的分离度均应符合要求,见图1。再取供试品溶液与对照品溶液顶空进样,记录色谱图。按外标法以峰面积计算,结果见表1。
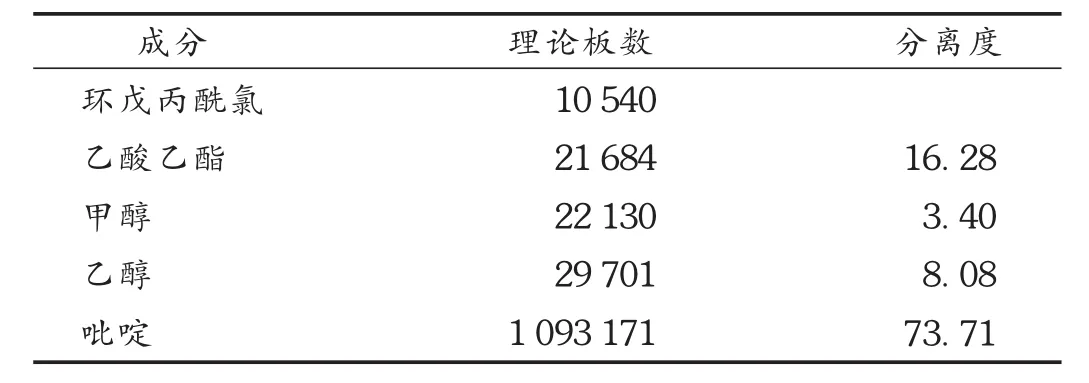
表1 5种成分理论板数与分离度
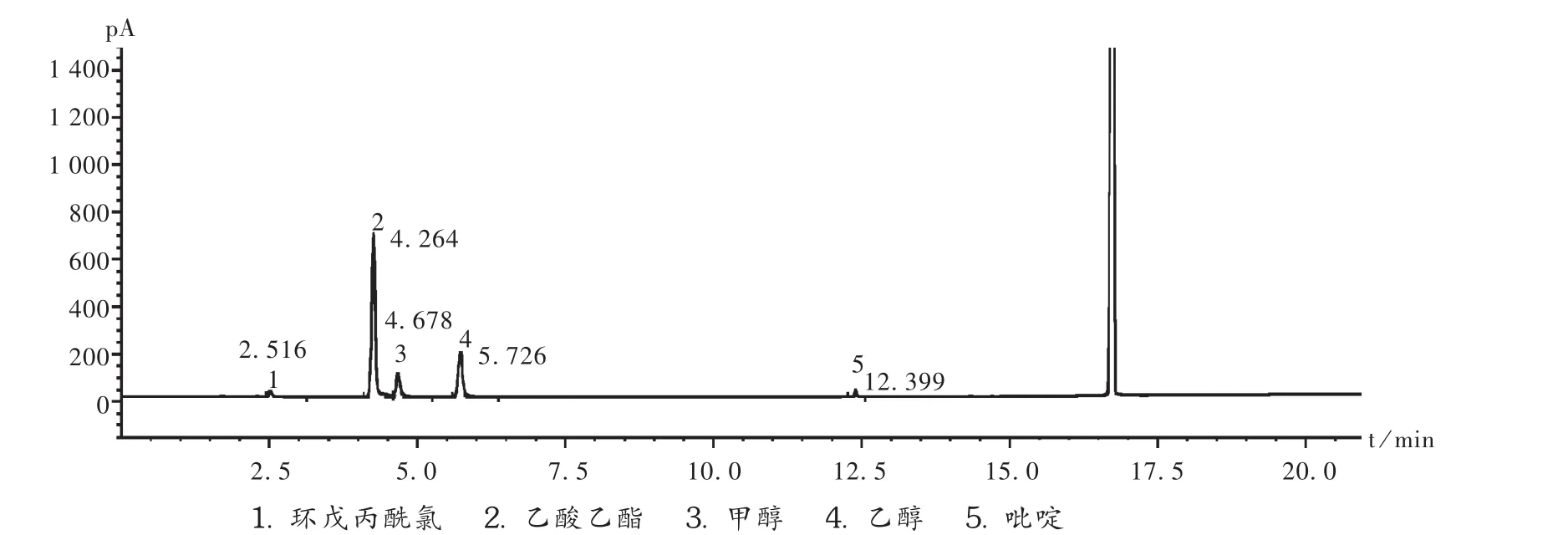
图1 气相色谱图
2.2 溶液制备
混合对照品溶液:称取环戊丙酰氯、乙酸乙酯、甲醇、乙醇、吡啶适量,精密称定,用二甲亚砜定量稀释成每1mL各含50,500,300,500,20μg的混合溶液,精密量取5mL置顶空瓶中,密封,即得。
供试品溶液:取样品0.5 g,精密称定,置顶空瓶中,精密加二甲亚砜5mL使溶解,密封,即得。
2.3 方法学考察
线性关系考察:分别称取环戊丙酰氯、乙酸乙酯、甲醇、乙醇、吡啶适量,用二甲亚砜溶解并稀释成每1m L含环戊丙酰氯5 mg、乙酸乙酯50mg、甲醇30 mg、乙醇50mg、吡啶2.5mg的溶液,得混合对照贮备液。分别精密量取1,2,1,3,3,1 m L,置 200,250,100,250,200,50mL容量瓶中,用二甲亚砜定容并摇匀。精密量取5mL置顶空瓶中,密封。按拟订色谱条件进样测定,以峰面积为纵坐标(Y)、质量浓度为横坐标(X),进行线性回归,线性回归方程见表2。
精密度试验:取2.2项下的对照品溶液连续进样6次,测定,乙酸乙酯、甲醇、乙醇、吡啶、环戊丙酰氯峰面积的 RSD分别为0.7%,1.4%,1.4%,2.5%,1.4%(n=6),表明仪器精密度良好。

表2 残留溶剂线性回归方程(n=6)
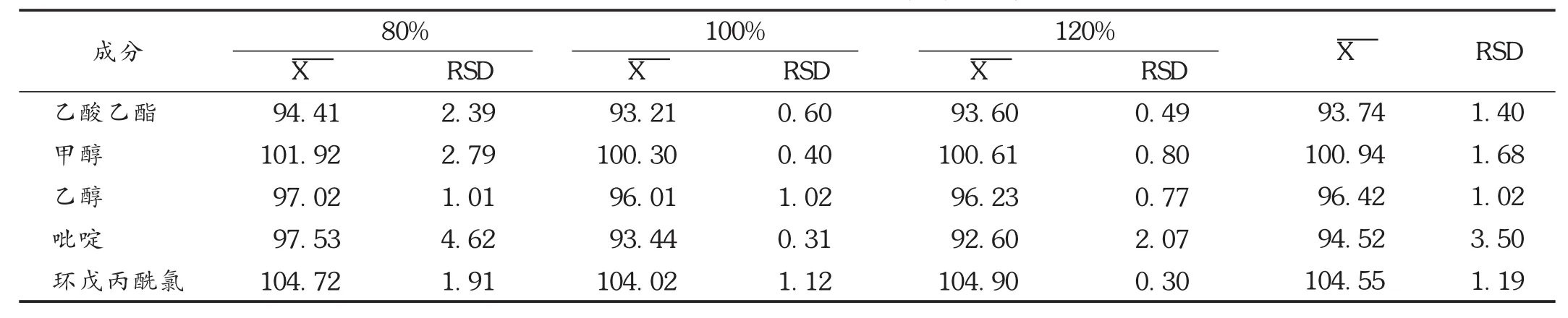
表3 残留溶剂回收试验结果(%,n=9)
重复性试验:取环戊丙酸雌二醇原料药,依法平行制备供试品溶液6份,按拟订色谱条件依法测定。结果乙酸乙酯、甲醇、吡啶均未检出,乙醇和环戊丙酰氯含量的 RSD分别为1.5%和1.6%(n=6),表明方法重复性良好。
加样回收试验:分别称取环戊丙酰氯、乙酸乙酯、甲醇、乙醇、吡啶适量,用二甲亚砜溶解并稀释成每1mL含环戊丙酰氯0.1mg、乙酸乙酯1.0mg、甲醇0.6mg、乙醇1.0mg、吡啶0.04mg的溶液,得回收贮备液。精密称取已知残留溶剂量的原料药0.5 g,共9份,各置于顶空瓶中,分别精密加入上述贮备液 2,2,2,2.5,2.5,2.5,3,3,3m L,二甲亚砜3,3,3,2.5,2.5,2.5,2,2,2m L,密封,摇匀,制成80%,100%,120%的低、中、高浓度,顶空进样。结果见表3。
检出限与定量限:精密量取对照品贮备液适量,作系列稀释,乙酸乙酯、甲醇、乙醇、吡啶及环戊丙酰氯检出限分别为 0.200 4,0.275 5,0.688 1,0.060 8,0.039 9μg/m L,定量限分别为0.668 0,0.918 2,2.293 6,0.202 7,0.133 2μg/m L。
2.4 样品残留溶剂测定结果
按2.2项下方法制备供试品溶液,按拟订色谱条件进样测定。结果见表4。
3 讨论
3.1 限度选择
在合成环戊丙酸雌二醇原料药时,环戊丙酰氯作为起始原料使用,由于起始原料质量与终产物质量有关,且原料中所含的有机溶剂也易引入到终产物。目前,尚无足够毒理学确定控制限度,但考虑合成中多种溶剂使用可能产生溶剂间毒性累加作用,故需对环戊丙酰氯的限度进行严格控制,限度不得过0.05%。其他4种溶剂则根据文献[7-8]要求,甲醇与吡啶属二类溶剂,限度为0.30%和0.02%,此溶剂对人体有一定毒性,限制使用;乙醇与乙酸乙酯属三类溶剂,限度均为0.50%,此溶剂对人体健康危险性较小[9-10],推荐使用。
3.2 溶剂选择
环戊丙酸雌二醇在水中不溶解,使用二甲亚砜为溶剂,结果二甲亚砜在5种待测溶剂之后出峰,对其他溶剂均无干扰。
[1]雷贞武.新的激素避孕方法-LUNELLA注射避孕针[J].国际生殖健康/计划生育杂志,2008,27(1):58-61.
[2]唐 彦,朱 珠.月用避孕针-复方甲羟孕酮[J].中国药学杂志,2001,36(11):785-786.
[3]杨培娟,宋 思,杨秋英,等.含不同生物活性的甾体激素避孕药对中国妇女脂代谢的影响[J].中国计划生育学杂志,2000,8(10):439-445.
[4]杜碧莹.HPLC法检查环戊丙酸雌二醇原料药的有关物质[J].中国药房,2014,25(25):2369-2371.
[5]Council of Europe,European Pharmacopoeia.Eighth Edition Volumel[M].Europe:EDQM,2013:583-584.
[6]KussHJ,Kromidas S.液相与气相色谱定量分析使用指南[M].陈小明,唐雅妍,译.北京:人民卫生出版社,2010:241-250.
[7]周海钧.药品注册的国际技术要求:质量部分[M].北京:人民卫生出版社,2006:112-151.
[8]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:105-109.
[9]杨龙华,宿 洁,陈 涛,等.顶空气相色谱法同时测定硫辛酸中8种残留溶剂含量[J].中国药业,2016,25(3):49-52.
[10]马建芳,朱瀛华,任飞亮,等.毛细管气相色谱法测定注射用利培酮微球中有机溶剂残留量[J].中国药业,2015,24(12):69-71.
Determ ination of Five Residual Solvents in Estradiol Cypionate Crude Drug by Headspace Gas Chromatography
Du Biying
(Guangzhou Institute for Drug Control,Guangdong,Guangzhou,China 510160)
Ob jective To establish a headspace gas chromatography(HS-GC)method for determination of 5 residual solvents in Estradiol Cypionate crude drug.M ethods HS-GC method was performed by using Agilent DB-WAXetr column(30 m×250μm,0.5μm),programmed temperature,flow rate was 1.5 mL/min,split ratio was 10∶1,inlet temperature was 200℃,the detector was flame ionization detector,detecting temperature was 250℃.The bottles equilibrium temperature was 110℃,the equilibrium time was 30 min,and injection volume was 1 mL.External standard method was used for quantitative analysis.Results The Linear range were 25~100μg/mL (r=0.999 49)for cyclopentyl propionyl chloride,250~1 000μg/m L(r=0.999 73)for acetic ether,150~600μg/mL(r=0.999 68) for methanol,250~1 000μg/m L(r=0.999 73)for ethanol,12.5~50.0μg/m L(r=0.999 58)for pyridine.The RSDs of precision were 1.4%,0.7%,1.4%,1.4%,2.5%(n=6),respectively.The recoveries were 104.55%(RSD=1.19%),93.74%(RSD=1.40%), 100.94%(RSD=1.68%),96.42%(RSD=1.02%),94.52%(RSD=3.50%).The detection limit was 0.04~0.70μg/mL and the quantitation limit was 0.10~2.5 μg/m L.Conclusion The method is simple,accurate and reproducible,which can be used for the determination of the 5 residual solvents in Estradiol Cypionate crude drug.
Estradiol Cypionate;headspace gas chromatography;residual solvent
2016-11-24;
2017-01-14)
10.3969/j.issn.1006-4931.2017.07.008
杜碧莹,女,硕士研究生,副主任药师,研究方向为药品质量,(电话)020-26282368(电子信箱)winddby@tom.com。
TQ 460.4;TQ 460.7
A
1006-4931(2017)07-0024-03

