正交试验优选参葛抗衰复方的提取工艺研究
张志超,王 敏,曹青云,李 琦,肖顺丽,关亮俊,高荣凯,张宏桂
(北京中医药大学中药学院,北京 100102)
·实验研究·
正交试验优选参葛抗衰复方的提取工艺研究
张志超,王 敏,曹青云,李 琦,肖顺丽,关亮俊,高荣凯,张宏桂
(北京中医药大学中药学院,北京 100102)
目的 采用正交试验法优选参葛抗衰复方的最佳提取工艺。方法 以葛根素转移率和干膏得率为葛根水提评价指标,以加水量、煎煮时间、煎煮次数为影响因素,以人参总皂苷含量、干膏得率为人参醇提评价指标,以乙醇用量、提取时间、提取次数为影响因素,优选最佳提取工艺。结果 水提最佳条件为加15倍量水煎煮3次,每次1.5 h;醇提最佳条件为9倍量70%乙醇提取3次,每次1.5 h。结论该方法合理可行,稳定可靠,葛根素和人参总皂苷转移率高。
人参;葛根;正交试验;提取工艺
参葛抗衰复方由人参、葛根等中药组方,具有补益元气、健脾益肺、安神生津的功效。人参中的人参皂苷在抗衰老方面效果很好[1-3],用 70%乙醇提取率[4-6]。葛根主要成分葛根素抗氧化效果显著[7-9],葛根水提物比醇提物抗氧化能力强[10]。人参、葛根合并给药比合提给药在消化道内的吸收更快[11],故将人参和葛根单独提取。本研究中确定人参采取乙醇提取和葛根采取加水煎煮提取的工艺路线,通过正交试验,以葛根素转移率和干膏得率为水提评价指标,加水量、煎煮时间、煎煮次数为影响因素;以人参总皂苷含量、干膏得率为醇提评价指标,加醇量、提取时间、提取次数为影响因素进行优选,并分别进行了3次验证试验,结果工艺合理可行、稳定可靠,可为中试及大生产工艺的最终确定提供实验室依据。现报道如下。
1 仪器与试药
1.1 仪器
Waters 1525型高效液相色谱仪(2489UV/Visible检测器,Breeze 2色谱工作站);TU-1810型紫外可见分光光度计(北京普析通用仪器有限责任公司); CPA225D/100型及BSA 124S型电子天平(0.01 mg及0.1mg,北京赛多利斯科学仪器有限公司);DZ-2BC型真空干燥箱(天津市麦斯特仪器有限公司);RE52CS型旋转蒸发器(上海亚荣生化仪器厂);KQ5200型超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
葛根素对照品(批号为110752-201514),人参皂苷Re对照品(批号为110754-201626),均购自中国食品药品检定研究院;葛根药材购自安国药材市场,人参药材购自抚顺昊源生物科技有限公司,经北京中医药大学刘春生教授鉴定为豆科植物野葛 Pueraria lobate (willd.)ohwi的干燥根和五加科植物人参 Panax ginseng C.A.Mey.的干燥根和根茎。甲醇为色谱纯,水为娃哈哈纯净水,其他试剂均为分析纯。
2 方法与结果
2.1 水提工艺优选
2.1.1 因素水平设计
将葛根加水煎煮的工艺路线,通过 L9(34)正交表进行试验设计,以葛根素转移率和干膏得率为水提评价指

表1 葛根水提工艺因素水平表
2.1.2 试验方法
称取葛根药材9份,每份30 g,按 L9(34)正交表条件加水提取,过滤,合并滤液,减压浓缩至100m L,备用。
2.1.3 水提干膏得率测定
精密量取浓缩液25mL,置已干燥至恒重的蒸发皿中,在水浴上蒸干后,减压干燥至恒重,取出,置干燥器中冷却30min,迅速精密称定质量,计算干膏得率。
2.1.4 葛根素含量测定
色谱条件:色谱柱为ThermoC18柱(250mm×4.6mm,5μm);流动相:甲醇-水(25∶75);检测波长:250 nm;流速:1 m L/min;柱温:30℃;进样量:10μL。理论板数按葛根素峰计应不低于4 000。
供试品溶液制备:取葛根提取物干膏,研细,称取0.1 g,精密称定,加50mL 30%乙醇溶解,称定质量,超声30 min,冷却至室温后再称定质量,30%乙醇补足减失的质量,摇匀,滤过,取续滤液,即得供试品溶液。
标准曲线制备:称取葛根素对照品2.86 mg,精密称定,置25m L容量瓶中,加30%乙醇至刻度,摇匀,即得。精密吸取对照品溶液0.1,0.2,0.4,0.6,0.8,1.0mL,分别置1.0mL容量瓶中,加30%乙醇稀释至刻度,摇匀,经0.45μm微孔滤膜过滤,分别吸取10μL注入液相色谱仪,于250 nm波长下检测,记录葛根素峰面积。以各成分峰面积为纵坐标(Y,A)、对照品溶液质量浓度为横坐标(X,C,g/L)绘制标准曲线,得葛根素线性回归方程 Y=45 093 306X-23 640,r=0.999 9(n=6)。结果表明,葛根素质量浓度在0.011 44~0.114 4 g/L范围内与峰面积呈良好线性关系。
样品含量测定:精密吸取供试品溶液10μL,注入液相色谱仪,测定葛根素峰面积,从标准曲线上读出供试品溶液中葛根素的质量浓度,测得样品含量。
2.1.5 正交试验及方差分析
按 L9(34)正交试验条件进行煎煮提取,共得到9份水提取液,依法测定葛根素转移率和干膏得率。结果见表2,方差分析见表3。由表2可见,以葛根素转移率为指标,则最佳提取工艺为A2B3C3,C因素有显著性差异(P<0.05);以干膏得率为指标,则最佳提取工艺为A3B3C3,C因素有显著性差异(P<0.05)。
2.2 醇提工艺优选
2.2.1 因素水平设计
将人参加醇回流的工艺路线,通过 L9(34)正交试验表进行设计,以人参总皂苷含量和干膏得率为醇提评价指标,以加乙醇量(A)、回流时间(B)、回流次数(C)为影响因素进行优化,因素水平表见表4。
2.2.2 试验方法
称取人参药材9份,每份30 g,按 L9(34)正交表的条件加70%乙醇提取,过滤,合并滤液,减压浓缩至100 mL,备用。
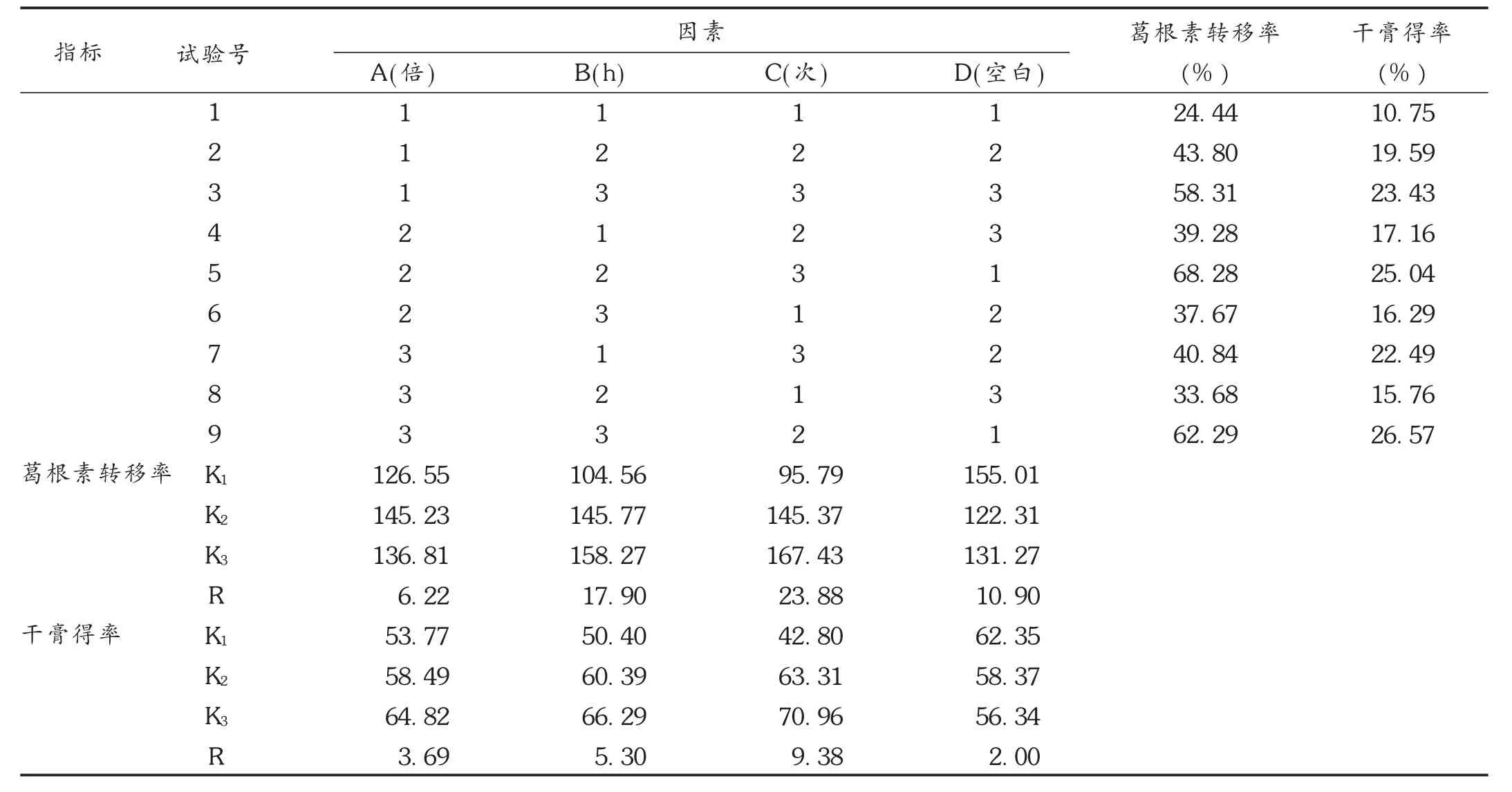
表2 葛根水提工艺优选正交试验结果

表3 葛根水提工艺优选方差分析表
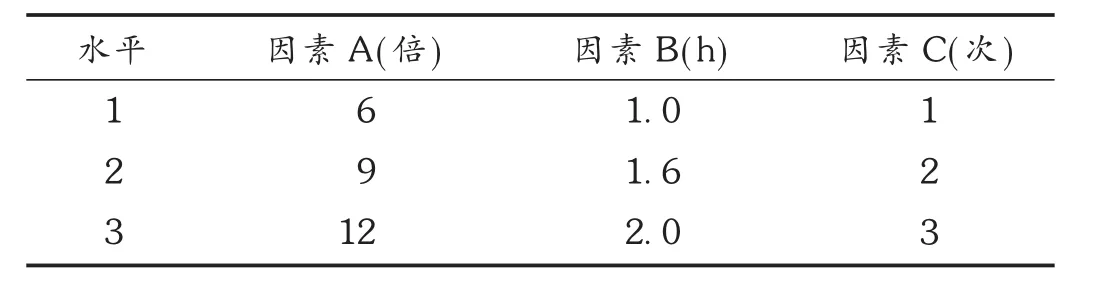
表4 人参醇提工艺优选因素水平表
2.2.3 醇提干膏得率测定
精密量取浓缩液25mL,置已干燥至恒重的蒸发皿中,水浴蒸干后,减压、干燥至恒重,取出,置干燥器中冷却30min,迅速精密称定质量,计算干膏得率。
2.2.4 人参总皂苷含量测定
标准曲线制备:取人参皂苷Re对照品5.34mg,精密称定,置5 mL容量瓶中,加甲醇制成每1 mL含1.068mg的溶液,即得对照品溶液。精密吸取对照品溶液20,40,80,120,160,200μL,分别置具塞试管中,低温挥去溶剂,加入1%香草醛高氯酸试液0.5 mL,置60℃恒温水浴,充分混匀后加热15min,立即用冰水冷却2 min,加入77%硫酸溶液5 mL,摇匀;以试剂作空白。消除气泡后照紫外-可见分光光度法,于540 nm波长处测定吸光度,以人参皂苷Re对照品溶液质量浓度(C,μg/mL)为横坐标、吸光度为纵坐标(Y,A)绘制标准曲线,得线性回归方程 A=0.022 4C+0.003 4,r=0.999 1(n=6)。结果表明,人参皂苷Re质量浓度在3.88~38.84μg/m L范围内与峰面积线性关系良好。
供试品溶液制备:取人参醇提取物干膏,研细,称取0.1 g样品,精密称定,置50m L容量瓶中,加甲醇适量使溶解并稀释至刻度,摇匀,精密吸取100μL,即得。
样品含量测定:按标准曲线制备项下方法,测定吸光度,从标准曲线上读出供试品溶液中人参皂苷Re的量,计算结果乘以0.84,即得人参总皂苷含量。

表5 人参醇提工艺优选正交试验结果

表6 人参醇提工艺优选方差分析表
2.2.5 正交试验及方差分析
按 L9(34)正交试验设计表进行醇提,共得到9份提取液,依法测定人参总皂苷含量及干膏得率。结果见表5,方差分析见表6。以人参总皂苷含量为指标的最佳提取工艺为A2B3C3,C因素有显著差异(P<0.05);以干膏得率为指标的最佳提取工艺为A2B3C3,C因素有显著差异(P<0.05)。综合考虑,人参醇提工艺为A2B2C3,即加入9倍量70%乙醇,提取3次,每次1.5 h。
2.3 验证试验
按处方比例平行称取3份饮片,根据最佳工艺条件进行验证试验,结果见表7。对葛根素、人参总皂苷含量进行测定,平行性较好,表明该工艺合理可行、稳定可靠。
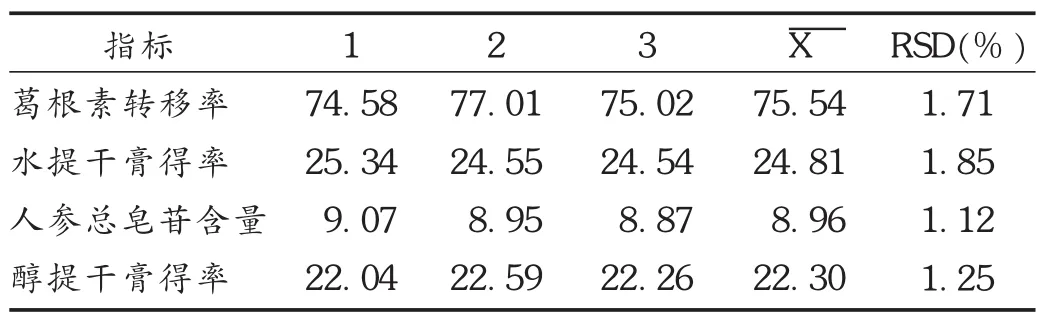
表7 正交试验验证结果(%)
3 讨论
本试验中在对各味药有效成分综合分析的基础上采用水提和醇提相结合的方法,并选取与功能相关的葛根素和人参总皂苷作为评价指标,同时把干膏得率也作为重要指标,综合评价提取工艺中主要影响因素的各项参数,由于A2葛根素转移率最高,干膏得率较A3少,可以减少用药量,考虑工业化生产,减少能源消耗及成本等问题,在不影响提取率的条件下选加水量为15倍即A2。综合考虑,葛根水提取工艺为A2B3C3,即加入15倍量的水,提取3次,每次提取1.5 h。由表5可见,提取1.5 h与提取2 h对总皂苷含量的影响差异不大,而出膏率较小,可以减少服药量,考虑工业化生产,节约时间,减少能源消耗及成本等问题,因此选择提取1.5 h,即B2。最终确定了参葛抗衰复方的最佳提取工艺,为中试及生产提供了依据。
本试验中还对药材浸泡时间与吸水率进行了考察,否则溶剂尚未渗透进饮片,有效成分无法溶解出来。从吸水率曲线中发现,葛根在浸泡60min后的吸水量几乎无变化,说明此时吸水已达到饱和,吸水率为130%,因此确定浸泡时间为60 min。进行正交试验时,第1次须多加葛根质量1.3倍的水,第2,3次加正常倍量水,在中试或大生产中,第1次提取时也需多加1.3倍量的水,提取效果更理想。
[1]韩知忖,刘 冰,周 辉.人参皂苷Rg1对神经细胞衰老和衰老相关异染色质聚集的影响[J].浙江中西医结合杂志,2016,26(4):322-323.
[2]彭 沛,宋志明,刘 勇,等.人参皂苷Rb1抗小鼠脑自然衰老及其对mTOR/p70S6K通路的影响[J].中山大学学报:医学科学版,2015,36(2):176-180.
[3]郑 敏,将裕芸,周 畅,等.人参皂苷对衰老大鼠学习记忆和脑单胺类神经递质的影响[J].宜春学院学报,2013,35(6): 68-71.
[4]韩 宵,朱 磊,闫春风,等.多指标综合加权评分法优选人参醇提工艺[J].中国现代中药,2016,18(1):110-113.
[5]杨宗林,李 慧,王 冰,等.Q-TOF LC/MS技术分析乙醇体积分数对人参单体皂苷提取率的影响[J].中国药房,2015,26(34):4834-4836.
[6]刘继菊.人参总皂苷提取工艺条件优化研究[J].中国中医药现代远程教育,2010,8(14):200-201.
[7]吴景东,王 培,李东子 .葛根及葛根素对自然衰老小鼠m tDNA片段缺失的实验研究[J].辽宁中医杂志,2011,38(11): 2119-2120.
[8]彭少君.葛根素抗衰老作用实验研究[J].山东医药,2009,49(20):45-46.
[9]徐晓虹.葛根素抗 D-半乳糖致衰老小鼠的脂质过氧化作用[J].中国中药杂志,2003,28(1):66-69.
[10]戴红旗,鄢贵龙,刘沐东,等.葛根提取物抗氧化活性研究[J].安徽农业科学,2008,36(24):10508-10509.
[11]陈益杭,李孟璇,孟兆青,等.药对研究(Ⅲ)——葛根人参药对对大鼠肠吸收的影响[J].中国中药杂志,2015,40(15):3094-3099.
Extraction Process of Panax Ginseng and Pueraria Lobata Anti-Aging Com pound Prescripation
Zhang Zhichao,Wang M in,Cao Qingyun,Li Qi,Xiao Shunli,Guan Liangjun,Gao Rongkai,Zhang Honggui
(College of Chinese Medicine,Beijing University of Chinese Medicine,Beijing,China 100102)
Objective To optimize the extraction process of Panax Ginseng and Pueraria Lobata anti-aging compound prescripation by orthogonal design method.M ethods The optimum extraction process was optimized by orthogonal test,the transfer rate and dry extract yield and of puerarin were taken as the index of evaluation of water extracting process,with the amount of water,decocting time,decocting times were influence factors,the ginseng total saponin content and dry paste yield were taken as the evaluation index,the amount of alcohol,refluxing time,refluxing times were taken as influence factors.Resu lts The optimal conditions of water extraction is adding 15 times water boiling for 3 times,each time 1.5 h;the optimal conditions of alcohol extraction is adding 9 times 70% alcohol refluxing for 3 times,each time 1.5 h.Conclusion The method is feasible,stable and reliable,and has high rate of puerarin and total saponin content.
Panax Ginseng;Pueraria Lobata;orthogonal test;extraction process
TQ 460.6
A
1006-4931(2017)07-0005-04
国家自然科学基金资助项目[3 0 8 7 0 2 6 2]。
张志超(1992-),男,硕士研究生,研究方向为中药药效物质基础,(电子信箱)zhangzc5@163.com。
张宏桂(1 9 5 5-),男,教授,研究方向为中药药效物质应用、体内代谢,(电话)0 1 0-8 4 7 3 8 6 4 2(电子信箱)b z y 7 1 4@1 6 3.c om。标,以加水量(A)、煎煮时间(B)、煎煮次数(C)为影响因素进行优化。因素水平表见表1。
2017-01-08)
10.3969/j.issn.1006-4931.2017.07.002

