高效液相色谱法测定盐酸瑞伐拉赞原料药的含量
曾 巧,刘泽荣,张道林
(重庆医药工业研究院有限责任公司,重庆 400061)
·检验检测·
高效液相色谱法测定盐酸瑞伐拉赞原料药的含量
曾 巧,刘泽荣,张道林
(重庆医药工业研究院有限责任公司,重庆 400061)
目的 建立测定盐酸瑞伐拉赞含量的高效液相色谱(HPLC)法。方法 色谱柱采用Inertsil誖-C8柱(250 mm×4.6mm,5μm),流动相为0.01mol/L磷酸氢二钠溶液(用磷酸调节pH为4.0)-乙腈(30∶70),检测波长为271 nm,流速为1.0mL/min,柱温为35℃,进样量为10μL。结果 盐酸瑞伐拉赞的定量限为3.70×10-7g/mL(S/N=10),质量浓度在50~200μg/mL范围内与峰面积线性关系良好,r=0.999 7(n=6)。结论 该方法简便、快捷,准确度高,适用于盐酸瑞伐拉赞含量的测定。
高效液相色谱法;盐酸瑞伐拉赞;含量测定
盐酸瑞伐拉赞(Revaprazan Hydrochloride)是现今全球唯一上市的新一代可逆性钾竞争性酸泵抑制剂或酸泵拮抗剂,目前国内尚未上市销售[1]。由于良好的临床疗效及较少的不良反应,使得盐酸瑞伐拉赞在胃溃疡及胃炎的治疗领域有着极大的市场需求[2-5]。国内外的专利及参考文献资料中未有盐酸瑞伐拉赞的原料药或制剂含量测定的报道[6-7],而含量测定作为原料药控制的关键重要指标,多采用高效液相色谱(HPLC)法、化学滴定法、紫外吸收光谱法测定,其中以HPLC法准确度最高,且稳定性过程中的含量变化的追溯性最好[8-15]。特别是针对此种新开发的化合物而言,本研究中建立了一种简便、快捷,准确度高的测定其含量的HPLC法,可为盐酸瑞伐拉赞的质量评价和质量标准的建立提供科学依据,同时为其质量研究及质量控制奠定了基础。
1 仪器与试药
1.1 仪器
Dionex U3000型高效液相色谱仪(多波长紫外检测器,Dionex公司),包括 Chromeleon色谱工作站;Agi-lent8453型紫外-可见分光光度计(Agilent公司);电子天平(Mettler Toledo公司);PB-10型精密pH计(德国赛多利斯公司)。
1.2 试药
盐酸瑞伐拉赞样品(批号为RF2014001,RF2014002,RF2014003,化学结构见图1),盐酸瑞伐拉赞对照品(批号为RF2014001-DZ,纯度为99.92%),均由重庆福美达科技有限公司提供。磷酸氢二钠、磷酸为分析纯,乙腈为色谱纯,水为超纯水。
图1 盐酸瑞伐拉赞的化学结构
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:Inertsil®-C8柱(250mm×4.6mm,5μm);流动相:0.01mol/L磷酸氢二钠溶液(用磷酸调pH为4.0)-乙腈(30∶70);检测波长:271 nm;流速:1.0mL/min;柱温:35℃;进样量:10μL;溶剂:70%乙腈水溶液。理论板数以瑞伐拉赞峰计不得低于5 000。
精密量取对照品溶液、供试品溶液各10μL,按拟订色谱条件进样分析,记录色谱图,见图2。结果表明,理论板数以瑞伐拉赞峰计为12 047,保留时间为12.140min,色谱峰对称性好,溶剂不干扰瑞伐拉赞的测定。
2.2 溶液制备
供试品溶液:取样品适量,加70%乙腈水溶液溶解,并稀释成质量浓度为0.1 g/L的溶液,即得。
对照品溶液:取对照品适量,加70%乙腈水溶液溶解,并稀释成质量浓度0.1 g/L的溶液,即得。
2.3 方法学考察
专属性试验:依法试验,空白溶剂不干扰盐酸瑞伐拉赞的含量测定。同时,由于含量测定与有关物质测定采用相同的色谱条件进行,仅供试品溶液质量浓度与测试用的波长存在差异。瑞伐拉赞峰与各已知杂质峰的分离度均远大于1.5,且在强酸、强碱、高温、强氧化、强光照下进行的强制降解试验的降解产物均能与瑞伐拉赞峰达到基线分离,不会干扰主峰的测定。在拟订色谱条件下,能保证主峰与各杂质峰有效分离,专属性强。色谱图见图3。
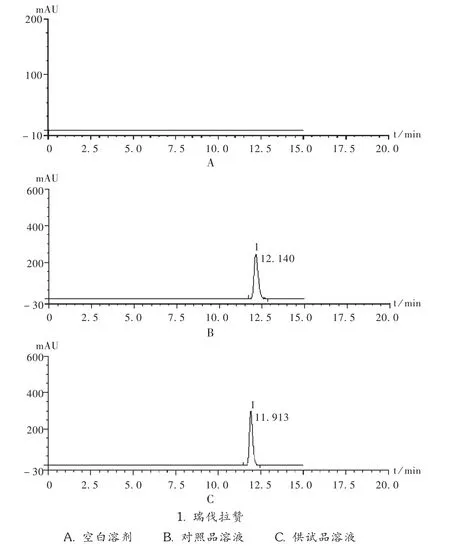
图2 高效液相色谱图
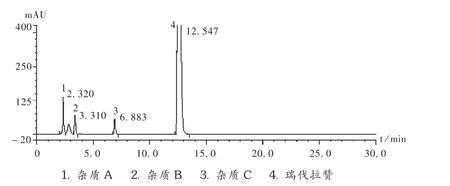
图3 专属性试验高效液相色谱图
检测限与定量限测定:精密量取2.2项下对照品溶液10μL,注入液相色谱仪,记录色谱图,同时采集基线噪声,以10倍噪声计算定量限。即定量限=10 NC/H=0.370μg/m L(N为噪声,mAu;C为对照品溶液的质量浓度,μg/m L;H为峰高,mAu)。
精密度试验:精密量取2.2项下对照品溶液10μL,注入液相色谱仪,连续进样6次,按外标法以峰面积计算含量。结果的 RSD为0.70%(n=6),表明仪器精密度良好。
线性关系考察:取盐酸瑞伐拉赞对照品适量,用70%乙腈水溶液稀释成质量浓度为50,80,100,120,150,200μg/mL的系列溶液,分别相当于供试品溶液质量浓度的50%,80%,100%,120%,150%,200%。精密量取上述溶液各10μL,注入液相色谱仪,记录色谱图,以质量浓度为横坐标(C),峰面积为纵坐标(A)进行线性回归,得线性回归方程 A=144.843 6+38.233 8C,r=0.999 7(n=6)。结果表明,盐酸瑞伐拉赞质量浓度在50~200μg/m L范围内与峰面积线性关系良好,能满足外标法进行含量测定的要求。
稳定性试验:精密量取2.2项下供试品溶液,分别于0,5,10,20,24 h时各精密量取10μL,注入液相色谱仪,记录色谱图。结果的 RSD为1.74%(n=5),表明供试品溶液在24 h内稳定。
重复性试验:取同一批样品,按2.2项下方法配制供试品溶液,依法测试6份,结果分别为99.81%,99.79%,99.33%,99.89%,99.40%,99.92%,平均 99.69%,RSD为0.26%(n=6),表明方法的重复性好。
加样回收试验:取对照品约10mg,精密称定,制得质量浓度为100μg/mL的对照品溶液。取同一批样品,按80%,100%,120%分别配制供试品溶液,每个浓度平行制备3份。按拟订色谱条件进行测定,以外标法计算回收率。结果见表1和表2。
测得的理论量=校正因子×峰面积×稀释倍数
回收率=(测得的理论量/实际称样量)×100%
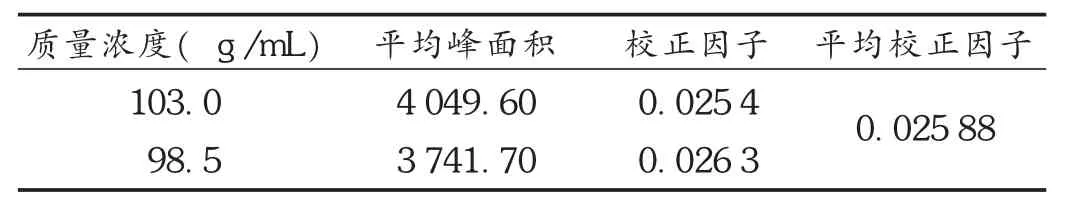
表1 校正因子测定结果
耐用性试验:分别对色谱柱、缓冲液pH、柱温、流动相比例进行考察。在变换不同的色谱柱、不同的缓冲液pH、不同的柱温、不同的流动相比例的条件下,同一批样品的含量测定结果基本一致。将所有测定结果进行分析,平均值为99.80%,结果的 RSD为0.10%,说明方法耐用性好。取同一份供试品溶液和对照品溶液,分别选用2根不同的Inertsil®-C8柱(250mm×4.6mm,5μm)进行试验,按拟订色谱条件进行测试;取同一份供试品溶液和对照品溶液,分别在缓冲液pH为3.9,4.0,4.1条件下,按拟订色谱条件进行测试;取同一份供试品溶液和对照品溶液,分别在柱温为30,35,40℃条件下,按拟订色谱条件进行测试。取同一份供试品溶液和对照品溶液,分别在磷酸氢二钠-乙腈比例为35∶65,30∶70,25∶75条件下,按拟订色谱条件进行测试。结果见表3。
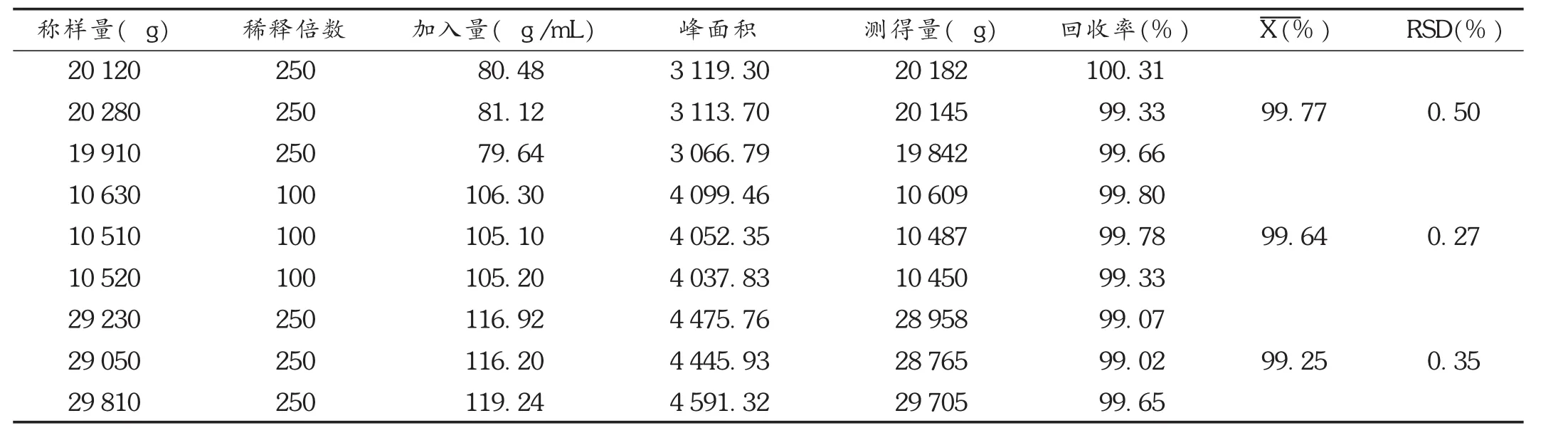
表2 盐酸瑞伐拉赞加样回收试验结果(n=3)
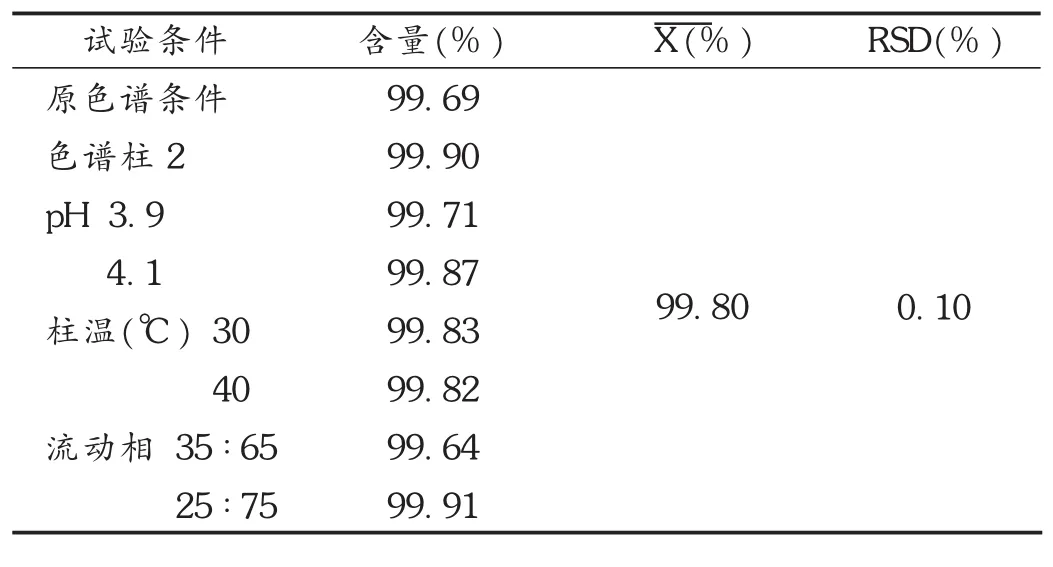
表3 耐用性试验结果
2.4 样品含量测定
取3批盐酸瑞伐拉赞样品,按2.2项下方法配制供试品溶液及对照品溶液,按拟订色谱条件进样测定,按外标法以峰面积计算含量。结果批号为 RF2014001,RF2014002,RF2014003的样品含量分别为标示量的99.69%,99.65%,99.71%。
3 讨论
3.1 检测波长选择
由盐酸瑞伐拉赞的紫外光谱图可知,其于205,271,304 nm波长处均有较大的特征吸收峰,特别是271 nm波长处有特征性的最大吸收峰且相对平滑,故选择了有最大吸收的271 nm作为检测波长,既能保证测试的灵敏度,又能保证测试的耐用性。
3.2 流动相选择
以磷酸盐缓冲液(pH为2.5~7.0)进行试验,发现缓冲液pH为4.0时峰形对称,柱效最高,且以磷酸氢二钠为缓冲液效果最佳。同时以甲醇、乙腈为有机相进行了试验,以乙腈为流动相效果更好,故选择磷酸氢二钠-乙腈的流动相体系。通过对各已知杂质及强制降解试验后的样品测定,发现在该流动相体系条件下,能有效地保证主峰与各杂质峰及降解产物的分离,故选择磷酸氢二钠-乙腈的流动相体系进行盐酸瑞伐拉赞的含量测定是可行的。
综上所述,通过系统方法学验证试验研究,所建立的测试方法操作简便、快捷,结果准确可靠,能满足盐酸瑞伐拉赞含量测定的要求,可为盐酸瑞伐拉赞的质量评价和质量标准的建立提供测试依据。
[1]Corp Y,Park YJ,Hyun CK.Revaprazan-containing solid dispersion and process for the preparation thereof:WO,2008078922 A1[P].2008-07-03.
[2]Jung JW,Kang HR,Kwon JW,et al.The potential inhibitory effect of revaprazan,an acid pump antagonist,on anticoagulation with warfarin[J].Tohoku JExp Med,2011,224(4):293-300.
[3]Kim JH,Kim EH,Ock C,et al.Mitigating endoplasmic reticulum stress with revaprazan ameliorates stress-related mucosal disease[J].JournalofGastroenterology and Hepatology,2012,27(1): 120-129.
[4]宋伟国,厦 艳 .质子泵抑制剂研究进展[J].中国药业,2011,20(9):80-82.
[5]陈 坚,蒋蔚茹.新型质子泵抑制剂的研究进展[J].上海医药,2013,34(21):2023.
[6]孙政进,马玉卓,陈静波,等.盐酸瑞伐拉赞的合成[J].中国医药工业杂质,2008,39(5):321-324.
[7]何 姗,任会静,曹云云,等.盐酸瑞伐拉赞及其关键中间体的合成研究进展[J].化学通报,2014,77(8):751.
[8]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:374-377,通则目次9101.
[9]蒲小琴,曾 巧,徐 溢,等.高效液相色谱法测定盐酸瑞伐拉赞的有关物质[J].中国药业,2014,23(14):58-60.
[10]张 敏,赵春才,徐健峰,等.HPLC法测定尼洛替尼胶囊的含量[J].中国药房,2014,25(1):69-70.
[11]仲 婕,朱德领,李保山,等.HPLC法测定尼鲁米特原料药的含量和杂质[J].中国药房,2014,25(1):61-63.
[12]汤 瑶,李 响,闻 镍,等.反相高效液相色谱法测定磷酸西他列汀的含量[J].药物分析杂志,2009,29(8):1370-1372.
[13]刘 琦,梁翠荣,谢元超,等.HPLC法测定布地奈德气雾剂的含量和有关物质[J].药物分析杂志,2014,34(3):471-474.
[14]白青山,张文萌.高效液相色谱法测定盐酸瑞伐拉赞片的含量及有关物质[J].药物分析杂志,2015,35(9):1660-1663.
[15]王红卫,周 斌.HPLC法测定盐酸瑞伐拉赞片有关物质[J].医学信息,2015,28(8):290.
Content Determ ination of Revaprazan Hydrochloride Crude Drug by HPLC
Zeng Qiao,Liu Zerong,Zhang Daolin
(Chongqing Pharmaceutical Research Institute Co.,Ltd,Chongqing,China 400061)
Ob jective To establish an HPLC method for content determination of Revaprazan Hydrochloride crude drug.M ethods Inertsil誖-C8column(250 mm×4.6 mm,5μm)was adopted with the mobile phase of 0.01 mol/L DSP solution(with phosphoric acid adjustable pH value to 4.0)-CAN(30∶70)at a flow rate of 1.0 m L/min,the detection wavelength was 271 nm.The column temperature was 35℃,the sample size was 10μL.Results The LOQ of Revaprazan Hydrochloride was 3.70×10-7g/mL(S/N=10).The concentration in the range of 50-200μg/mL showed a good linear relationship with the peak area,r=0.999 7(n=6).Conclusion The method is simple,fast,accurate,and can be applied to the content determination of Revaprazan Hydrochloride crude drug.
HPLC;Revaprazan Hydrochloride;content determination
TQ 460.4;TQ 460.7
A
1006-4931(2017)07-0017-04
2017-01-06)
10.3969/j.issn.1006-4931.2017.07.006
曾巧(1985-),女,硕士研究生,工程师,研究方向为药物分析,(电话)023-62505966-204(电子信箱)zeno1985@163.com。
张道林,男,硕士研究生,高级工程师,研究方向为药物分析,(电话)0 2 3-6 2 5 0 5 9 6 6-8 6 8(电子信箱)z h a n g d a o l i n@cpri.com.cn。

