动脉斑块内骨桥蛋白靶向的新型超声对比剂的制备及体外实验研究
苟田田,陈 敏,王亚斌,韩 东,乔红玉,黄 旭,许梦琪,汪 奇,戴志飞,冯旭阳*,曹 丰*
(1第四军医大学西京医院心血管内科,西安 710032;2解放军总医院心血管内科,北京 100853;3北京大学工学院,北京100871)
2015年中国心血管病报告显示,心血管病为我国居民的首位死因,占疾病死亡构成的40%以上,而冠心病更是威胁居民健康的第二大疾病,其中急性心肌梗死死亡率自2005年始呈快速上升趋势[1]。急性心肌梗死多由冠状动脉粥样硬化不稳定斑块在多种诱因下破裂导致冠状动脉阻塞引起,因此,早期评估不稳定斑块刻不容缓。
当今应用于临床的诊疗手段尚存在一定缺陷,如冠状动脉造影、冠状动脉CT造影(coronary computed tomography angiography,CCTA)和血管内超声(intravascular ultrasound,IVUS)等虽然可以评估斑块解剖结构,但对斑块内早期分子事件无法检测。新兴的分子影像技术从分子生物学水平对生物内环境变化进行识别及量化,近年来在更加精细化的诊断及治疗中呈现出良好的应用前景[2]。
不稳定斑块由薄纤维帽、包含脂质和活化巨噬细胞的较大坏死物核心及微钙化构成[3]。骨桥蛋白(osteopontin,OPN)是一种磷酸化糖蛋白,动脉粥样硬化发生时巨噬细胞、血管平滑肌细胞及内皮细胞均有表达,我们前期研究结果表明在由巨噬细胞吞噬脂质形成的泡沫细胞中OPN表达明显增加[4-6]。超声对比剂有很好的临床应用前景,本研究以OPN为靶点,将OPN抗体与包裹全氟溴辛烷(perfluorooctyl bromide,PFOB)的聚乳酸纳米颗粒(poly lactic acid nanoparticles,PLA NPs)偶联,制备靶向超声造影剂,并对造影剂的体外寻靶及成像能力进行初步验证。
1 材料与方法
1.1 材料
小鼠单核/巨噬细胞系 RAW264.7购自美国ATCC细胞库。PLA购自山东省医疗器械研究所,PFOB、聚乙烯醇、N-羟基琥珀酰亚胺(NHS)、1-(3-二甲氨基丙基)3-乙基碳二亚胺盐酸盐(EDC)、2-(N-吗啡啉)乙磺酸(MES)购自美国Sigma公司,二氯甲烷购自国药试剂公司,NH2-PEGCOOH购自北京凯正公司,标记别藻青蛋白(allophycocyanin,APC)的OPN抗体、小鼠IgG抗体购自北京博奥森公司,CCK-8试剂盒购自日本同仁公司。超声波破碎仪购自美国 Misonix公司(Sonicator 4000),超声诊断仪购自深圳迈瑞公司(DC-8),粒度分析仪购自美国 Brookhaven公司(90Plus/ZetaPALS),共聚焦显微镜购自日本Olympus公司(FV1000)。
1.2 方法
1.2.1 PLA NPs的制备 取100 mg PLA、4 ml二氯甲烷、100 μl PFOB充分混匀,加入20 ml PVA水溶液(2%),冰浴超声2 min得到乳剂,室温搅拌4 h使二氯甲烷充分挥发。所得混合液5000 g离心5 min,取沉淀部分去离子水清洗离心并充分分散重悬,取100 μl液体冻干计算总量。
1.2.2 PLA NPs的表征 取微量样品分散于超纯水中,检测PLA NPs的水合粒径,适量样品滴于铜网上,2%磷钨酸染色后透射电镜观察粒子形态及粒径大小。
1.2.3 携 OPN抗体靶向PLA NPs的制备 以与PLA摩尔比为1∶500的比例计算所需EDC及NHS,与PLA NPs在MES缓冲液(pH5.5)中室温反应1 h活化颗粒表面羧基,后于PBS缓冲液中加入与PLA摩尔比为1∶3的NH2-PEG-COOH,室温搅拌48 h完成亲水性修饰。
将OPN抗体原液(1 mg/ml)50 μl 100 k超滤管中除去牛血清白蛋白。PEG-PLA NPs置于MES缓冲液中,以与PEG摩尔比为1∶10加入EDC及NHS室温反应30 min活化末端羧基,PBS缓冲液中与OPN抗体室温避光搅拌过夜,所得产物经离心重悬得到Anti-OPN-PEG-PLA-PFOB(OPN NPs)。
1.2.4 PLA NPs的细胞毒性检测 将对数生长期细胞以104/孔接种于96孔板中,待细胞长至70%后分别加入不同浓度梯度(0.00,0.01,0.02,0.05,0.10,0.20,0.50 mg/ml)的靶向探针悬液孵育 6 h。每孔加入100 μl新鲜培养基和10 μl CCK-8溶液后孵育1 h,酶标仪测定450 nm处吸光度(A450nm)。
1.2.5 OPN NPs的体外寻靶实验 将 RAW264.7细胞以3×105/皿接种于数块共聚焦皿中,与氧化低密度脂蛋白(oxygenized low density lipoprotein,ox-LDL)80 μg/ml共孵育24 h诱导泡沫细胞形成,设实验组(OPN NPs)和无关对照组(Anti-IgG-PEGPLA-PFOB,IgG NPs),分别加入终浓度为0.2 mg/ml的纳米颗粒各1 ml,孵育4 h。4%多聚甲醛固定,DAPI染核后于激光共聚焦显微镜下观察摄取结果。
1.2.6 OPN NPs的体外显像实验 将OPN NPs稀释至5 mg/ml,取1 ml注入乳胶管中,以去离子水作为对照组,无气水为透声窗,Mindray DC-8超声诊断仪进行成像,探头频率为12 MHz,机械指数为0.453。
1.3 统计学处理
利用SPSS20.0软件包进行数据分析。计量资料以均数±标准差(珋x±s)表示。两组数据组间差异采用t检验,比较多组数据组间差异,采用单因素方差分析(one-way ANOVA)。以P<0.05为差异具有统计学意义。
2 结果
2.1 探针的表征
PLA NPs以串联方式通过碳二亚胺法先后进行PEG亲水性修饰及抗体偶联(图1A),透射电镜结果显示颗粒呈球形或类球形,表面较光滑,粒径100~300 nm,形态规则,未见明显的团聚及粘连现象(图1B)。粒度分析仪显示颗粒水合粒径约为(267.60 ±82.40)nm(图1C)。
2.2 探针的毒性检测
CCK-8结果显示,不同浓度的探针(0.00,0.01,0.02,0.05,0.10,0.20,0.50 mg/ml)相较于对照组,细胞活性差异无统计学意义(A450nm:1.13±0.05,1.11±0.04,1.10±0.05,1.08 ±0.04,1.08 ±0.06,1.06±0.04,1.02±0.07;P >0.05),可见实验浓度范围内,所构建的纳米颗粒未显现出明显的细胞毒性。以空白对照组细胞存活率为100%,当探针浓度达到0.50 mg/ml时,细胞存活率仍>90%。
2.3 探针的细胞摄取实验
激光共聚焦显微镜下见标记抗体的APC染料呈现红色荧光,实验组细胞内红色荧光信号强于无关对照组(图2A)。荧光半定量结果显示实验组OPN NPs摄取量显著高于无关对照组IgG NPs(P<0.05;图2B),说明探针靶向识别性能佳。
2.4 探针的乳胶管超声成像
乳胶管超声成像示纳米探针在反向脉冲谐波(pulse inversion harmonic imaging,PIHI)模式下显示为点状密集高回声(图3A),在较高机械指数(MI=0.453)下信号无衰减,表明纳米颗粒无明显破裂,支持动态观察,可长时间显影。空白对照组去离子水在相同造影模式下为无回声液性暗区(图3B)。
3 讨论
分子影像已经逐渐成为生物医学及材料化学领域的研究热点。通过对材料包壳及核心的修饰,可达到多种诊断模式互补,并对疾病的治疗起到辅助作用。本课题组曾将抗体与四氧化三铁纳米颗粒偶联,成功制备出可用于不稳定斑块识别的磁共振成像纳米探针[5,7]。本实验选择广泛应用且廉价易得的超声造影技术,制备纳米超声造影剂。
相较于临床应用的超声造影剂如声诺维(SonoVue)等,纳米超声造影剂不易被网状内皮系统识别吞噬,血液循环时间长,组织穿透能力强。同时纳米超声造影剂依赖聚集效应显影,这就要求所选择的靶点灵敏度高[8]。OPN不仅在活化的巨噬细胞中过表达,同时其可促进骨骼肌细胞重构及纤维变性,尸检结果示微钙化灶内OPN含量明显增加[9,10]。本实验结合不稳定斑块中炎症反应泡沫细胞富集和微钙化形成的特点,以OPN作为靶点,可同时识别不稳定斑块两种关键的预测因素,理论上较单一靶点成像能力更佳。

图1 探针的表征Figure 1 Characterization of PLA NPs
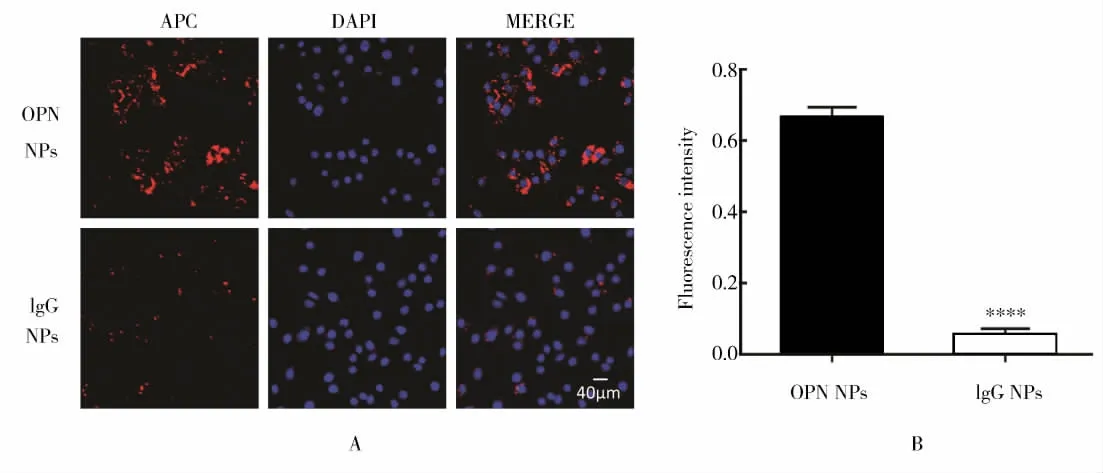
图2 靶向OPN纳米探针的体外寻靶实验Figure 2 Targeting test of OPN NPs in vitro
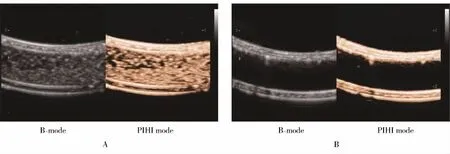
图3 靶向OPN纳米探针的体外超声成像Figure 3 Ultrasound imaging of OPN NPs in vitro
与磷脂微泡造影剂对比,高分子微泡造影剂稳定性佳,抗声压能力强,且在携载药物方面具有独特的优势[11]。PLA为美国FDA批准的可用于生物工程领域的材料,PLA可降解支架已成功应用于临床[12],其在体内可降解为乳酸和羟基乙酸参与代谢,以二氧化碳和水排出体外。PFOB性质稳定,携氧能力强,已有多项研究表明其可用于在体超声成像[13]。根据实验结果,本实验制备的靶向造影剂具有生物相容性好、稳定性佳、可敏感识别靶向分子、成像能力优良的特点。根据前人研究成果推测,本探针可用于经体表大血管成像,同时已有学者对IVUS的对比剂成像功能进行探索[14],相较临床使用的超声诊断仪,IVUS的高频换能器穿透力弱但分辨率更佳,结合本探针的使用,理论上可对未来冠状动脉斑块的易损性评估提供参考。
目前针对不稳定斑块各种组分的标志物尚在进一步发掘中,识别不稳定斑块的影像学手段也有较多选择[15]。本实验所选材料PLA和PFOB具有独特的载药及多模态成像优势,尚待进一步研究。我们仍需构建并优化可应用于临床的靶向分子探针,做到更加精确的斑块成分识别及性质诊断,指导临床治疗,并对材料进行载药修饰,以期实现诊疗一体化。
[1] 陈伟伟,高润霖,刘力生,等.《中国心血管病报告 2015》概要[J].中国循环杂志,2016,31(6):521-528.DOI:10.3969/j.issn.1000-3614.2016.06.001.Chen WW,Gao RL,Liu LS,et al.Summary of Chinese Cardiovascular Disease Report 2015[J].Chin Circ J,2016,31(6):521 -528.DOI:10.3969/j.issn.1000-3614.2016.06.001.
[2] Gao D,Sun X,Gao L,et al.Recent advances in molecular imageguided cancer radionuclide therapy[J].Curr Drug Targets,2015,16(6):634 -644.DOI:10.2174/1389450116666150-531155513.
[3] Shaw LJ,Narula J,Chandrashekhar Y.The never-ending story on coronary calcium:is it predictive,punitive,or protective[J]?J Am Coll Cardiol,2015,65(13):1283 - 1285.DOI:10.1016/j.jacc.2015.02.024.
[4] Qiao R,Qiao H,Zhang Y,et al.Molecular imaging of vulnerable atherosclerotic plaques in vivo with osteopontin-specific upconversion nanoprobes[J].ACS Nano,2017,11(2):1816 - 1825.DOI:10.1021/acsnano.6b07842.
[5] Qiao H,Wang Y,Zhang R,et al.MRI/optical dual-modality imaging of vulnerable atherosclerotic plaque with an osteopontintargeted probe based on Fe3O4nanoparticles[J].Biomaterials,2017,112:336 -345.DOI:10.1016/j.biomaterials.2016.10.011.
[6] 乔红玉,王亚彬,高 磊,等.骨桥蛋白靶向磁性纳米探针对动脉斑块的分子成像[J].中华老年多器官疾病杂志,2016,15(4):283 - 288.DOI:10.11915/j.issn.1671-5403.2016.04.067.Qiao HY,Wang YB,Gao L,et al.Molecular imaging of atherosclerotic plaques via osteopontin targeted Fe3O4nanoparticles[J].Chin J Mult Organ Dis Elderly,2016,15(4):283-288.DOI:10.11915/j.issn.1671-5403.2016.04.067.
[7] Wang Y,Chen J,Yang B,et al.In vivo MR and fluorescence dual-modality imaging of atherosclerosis characteristics in mice using profilin-1 targeted magnetic nanoparticles[J].Theranostics,2016,6(2):272 -286.DOI:10.7150/thno.13350.
[8] 张美琴,周彩云,罗 红.纳米级超声造影剂的技术进展[J].华西医学,2012,27(10):1585-1587.Zhang MQ,Zhou CY,Luo H.Technical progress of nanoscale ultrasound contrast agent[J].West China Med J,2012,27(10):1585-1587.
[9] Tousoulis D,Siasos G,Maniatis K,et al.Novel biomarkers assessing the calcium deposition in coronary artery disease[J].Curr Med Chem,2012,19(2):901 -920.DOI:10.2174/092986712799034833.
[10] Quattrocelli M,Spencer MJ,McNally EM.Outside in:the matrix as a modifier of muscular dystrophy[J].Biochim Biophys Acta,2017,1864(3):572 -579.DOI:10.1016/j.bbamcr.2016.12.020.
[11]朱建平,超声分子成像技术的应用进展[J].功能与分子医学影像学,2015,4(1):558 -561.DOI:10.3969/j.issn.2095-2252.2015.01.001.Zhu JP.The progress of the application of ultrasonic molecular imaging technology[J].Funct Mol Med Imaging,2015,4(1):558 -561.DOI:10.3969/j.issn.2095-2252.2015.01.001.
[12]Lee CH,Yu CY,Chang SH,et al.Promoting endothelial recovery and reducing neointimal hyperplasia using sequential-like release of acetylsalicylic acid and paclitaxel-loaded biodegradable stents[J].Int J Nanomedicine,2014,9:4117 - 4133.DOI:10.2147/IJN.S67721.
[13] Li H,Wang P,Wang X,et al.Perfluorooctyl bromide traces selfassembled with polymeric nanovesicles for blood pool ultrasound imaging[J].Biomater Sci,2016,4(6):979 - 988.DOI:10.1039/c6bm00080k.
[14] Dixon AJ,Kilroy JP,Dhanaliwala AH,et al.Microbubble-mediated intravascular ultrasound imaging and drug delivery[J].IEEE Trans Ultrason FerroelectrFreq Control, 2015, 62(9):1674 -1685.DOI:10.1109/TUFFC.2015.007143.
[15] Bourantas CV,Garcia-Garcia HM,Torii R,et al.Vulnerable plaque detection:an unrealistic quest or a feasible objective with a clinical value[J]?Heart,2016,102(8):581 -589.DOI:10.1136/heartjnl-2015-309060.

