一次性大负荷运动对淋巴细胞钙瞬态、通道基因表达和刺激剂诱导细胞增殖能力的影响
刘仁仪,李一新
一次性大负荷运动对淋巴细胞钙瞬态、通道基因表达和刺激剂诱导细胞增殖能力的影响
刘仁仪1,李一新2
目的:淋巴细胞增殖反应通常被用作细胞免疫功能的检测指标,运动性免疫抑制是运动医学研究的一个热点,然而其机制至今不甚明了。通过构建一次性大负荷运动模型,研究急性运动对淋巴细胞钙离子瞬态、钙通道基因表达和增殖功能的影响,从而探讨运动性免疫抑制的分子机制。方法:相互匹配的雄性小白鼠随机被分成控制组和运动组(分为运动后即刻处死组和运动后3 h处死组);运动组执行80%最大摄氧量强度跑台运动至力竭;淋巴细胞分离自小鼠脾脏;淋巴细胞内钙离子浓度通过荧光稳态/瞬态分析系统测量fura-2(AM)负载细胞悬液而确定;结合流式细胞术与羧基荧光素琥珀酰亚胺酯(CFSE)负载法评估细胞增殖反应;实时荧光定量PCR法检测淋巴细胞相关通道基因表达。结果:在运动后即刻处死组,植物血凝素(PHA)诱导淋巴细胞内游离钙离子浓度变化幅度和钙离子释放率显著低于控制组(P<0.05);在运动后3 h处死组,毒胡萝卜素(TG)诱导淋巴细胞钙离子释放率显著低于控制组(P<0.05),且淋巴细胞内钙通道基因RYR核酸表达水平显著高于控制组(P<0.05),但细胞膜钙通道基因STIM表达在两组之间没有显著性差异(P>0.05),刺激剂体外刺激诱导细胞增殖水平显著低于控制组(P<0.05)。结论:急性大负荷运动可能通过下调淋巴细胞内质网网膜钙通道基因表达,抑制胞内钙离子释放以及胞内Ca2+信号转导过程,相应降低刺激剂诱导淋巴细胞增殖能力,即:淋巴细胞免疫功能削弱。这可能是急性运动引起机体免疫抑制的一个重要分子机制。
大负荷运动;钙离子;通道;淋巴细胞
1 前言
运动是一种复杂的、独特的、可控的、可量化的和可重复进行的应激刺激[11]。它可致机体功能明显改变,也是影响机体免疫功能的一个关键因子,它与许多临床的生理应激刺激引起免疫反应模式类似[11]。机体免疫功能增强或减弱取决于身体活动强度和持续时间。一般认为,适宜的运动刺激免疫机能增强,而力竭性运动被证明有损机体免疫应答。一次大负荷或过度负荷的运动可造成机体免疫功能削弱的“开窗”期(运动结束3~72 h)[10],而关于运动性诱发免疫抑制的机理至今不甚明了。细胞内游离钙离子涉及胞内主要的信号转导通路,它是联系淋巴细胞激活、增殖、吞噬及细胞因子分泌等过程至关重要的中间环节。在静息条件下,细胞内游离钙离子浓度([Ca2+]i)逆细胞内外电化学梯度力作用,被控制在纳摩尔级的低水平状态。在不同类型的细胞,胞内钙稳态失调可诱导细胞凋亡。有研究显示,一次急性运动可以引起一系列免疫参数的变化,尽管其运动时间和运动负荷有限[14]。长时间、持续、中到高强度的运动导致机体的免疫抑制是非常明显的[2]。研究在运动刺激过程中,机体免疫细胞内钙信号如何以一个可靠的、有效的方式进行转导,对于我们了解运动影响机体免疫功能这样一个生物过程是非常重要的。免疫细胞增殖可被视作评价免疫机能重要的指标。为了探讨运动性诱发免疫抑制的分子机制,本研究试图调查一次性大强度、长时间运动是否能影响静息或刺激作用下淋巴细胞内钙离子稳态、相关钙调控基因表达及刺激剂体外诱导细胞增殖反应能力。
2 材料与方法
2.1 实验动物
本研究对象为C57BL/6雄性小鼠,实验分组前鼠龄:12周,体重:26.0±2.5 g。动物饲养在标准动物房内,光照周期被控制为12 h/12 h明暗循环(07:00亮灯)。小鼠被饲养在标准笼内(4~6只/笼),饮食自由。室温:21±1 ℃。实验动物使用获得相关的动物管理及使用委员会的批准。动物有氧能力通过跑台肺活量测定系统(定制)进行评估。具体操作过程如下:所有的动物首先需要适应跑台运动。最大摄氧量(VO2max)和最大跑速在正式实验至少7天前就被确定。动物随机分为3组:控制组,运动后即刻处死组,运动后3 h处死组,每组5只。运动小鼠在跑道内适应10 min时间后,执行持续递增负荷运动至力竭。运动检测开始的速度为0.20 m/s,每3 min,速度递增0.05 m/s。运动小鼠执行80%VO2max强度运动,速度为0.40±0.05 m/s运动直至力竭[4]。分别于运动后即刻和3 h,在麻醉状态下将小鼠断颈处死。运动小鼠运动的时间为60.0±5.0 min。控制组小鼠暴露在跑台噪音中,但无运动,处死方式同运动组。
2.2 淋巴细胞分离
密度梯度离心法分离淋巴细胞:将一个细胞滤网(孔径:100μm)置入培养皿,且在其中加1 mL PBS溶液;处死动物,从其体内取出脾脏,将其置入滤网上,轻轻地研磨脾脏;加1 mL PBS溶液清洗滤网和培养皿;在一个试管内加3 mL Biocoll分离液(密度:1.077 g/mL);小心地将细胞悬液加到分离液上;2 000 r/min离心20 min;将淋巴细胞层移出; 加PBS溶液1500 r/min离心10 min,清洗细胞2次;弃细胞上清液,重悬细胞入1 ml PBS溶液。整个过程在无菌条件下操作完成。胎盘兰检测细胞的活性在98%以上,流式细胞仪前向—侧向散射模式确定淋巴细胞纯度在99%以上。全自动血细胞分析仪计数淋巴细胞。
2.3 药剂和溶液
fura-2AM (Molecular Probes™) 溶解在二甲亚砜(DMSO),储备液浓度为1 mmol/L,-80 ℃保存。洋地黄皂苷(Digitonin),植物血凝素(PHA),毒胡萝卜素(TG)购自 Sigma-Aldrich公司。乙二醇双(2-氨基乙醚)四乙酸(EGTA),DMSO购自 Carl Roth公司。鼠单克隆抗体CD3(OKT3)(1 mg/mL)购自Janssen-Cilag公司。达尔伯克改良伊格尔培养基(DMEM),胎牛血清(FBS)购自PAA公司。PE/Cy7 anti-mouse CD3 购自Biolegend公司。
2.4 细胞内钙离子浓度的检测
检测方法:1)细胞孵育:1 mL含9×106个淋巴细胞的含钙缓冲液与5μL fura-2AM(储备浓度:1 mmol/L)在室温下孵育30 min,多余染料通过3次离心(1 500 r/min×10min)移除,将细胞重悬在不含钙PBS溶液中,细胞在冰箱冷藏条件下保存;2)荧光扫描:通过应用荧光稳态/瞬态分析系统(Deltascan;PTI,加拿大)测定细胞悬液fura-2荧光强度,每次负载fura-2/AM细胞悬液(包含2.7×106个细胞),加入到荧光比色杯中,激发光波长设为:340~380 nm,发射光波长设为:510 nm,双波长交替扫描,比色杯和溶液等自体荧光在实验前检测,在2 h内完成fura-2负载细胞测量实验;3)刺激检测:为测定在含钙缓冲液中细胞内钙离子浓度,在静息状态下扫描比色杯荧光信号100 s以后,使用PHA(应用浓度:20μg/mL)或者TG(应用浓度:10μmol/L)刺激细胞650 s;为测定在不含钙缓冲液中细胞内钙离子浓度,在无钙PBS溶液(加0.1 mmol/L EGTA),扫描荧光100秒,刺激剂加入测试介质中扫描荧光250 s,然后将CaCl2溶液(0.8 mmol/L)加入比色杯中扫描荧光350 s;(4)浓度计算:加破膜剂10 mM Digitonin,使fura-2和Ca2+结合达饱和,测得F340/F380为Rmax;加入高浓度Ca2+螯合剂EGTA(终浓度为5 mmol/L,pH8.5),以充分螯合Ca2+,使fura-2游离,测得的F340/F380为Rmin。根据Grynkiewicz等[8]方程式进行计算:
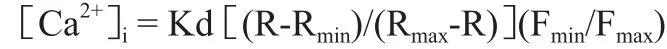
其中,Kd为钙离子特异性荧光探针,fura-2与Ca2+反应的解离常数,生理条件下,其值是220 nmol·L–1;R为各测定点F340/F380荧光强度比值;Rmax和Rmin分别为上述测定的最大和最小荧光比值;Fmin和Fmax分别代表Ca2+为零及饱和时,在380 nm激发光下测得的fura-2荧光强度(F380)。
2.5 淋巴细胞增殖能力评估
根据 Quah等[13]的实验方案,淋巴细胞重悬在包含10%(v/v)热灭活胎牛血清的DMEM培养基中,细胞浓度为6×106/mL;小心地将细胞悬液置于15 mL锥形试管底;然后将试管水平放平;小心地在试管顶部加11μL PBS溶液;重悬1.1μL 5mmol/L CFSE储存液于此PBS溶液中;迅速盖紧试管,上下颠倒,漩涡混匀;铝箔纸包裹试管,在室温条件下孵育细胞5 min;在室温条件下加入8 mL包含10%(v/ v)FBS的PBS溶液终止标识反应,淬灭游离CFSE;20 ℃,2 500 r/min 离心5 min,弃上清液;重复洗涤2次;单个培养皿中含有的细胞数为2×106,植物凝集素(10μg/mL)刺激培养细胞;2 mL DMEM加入100μg/mL青霉素和100μg/ mL链霉素及10%(v/v)胎牛血清;细胞在5% CO2,37 ℃培养箱培养72 h;收集培养细胞,PBS溶液洗涤2次,然后流式细胞仪(EPICS XL Beckman Coulter,美国)分析anti-CD3-PE Abs 标识细胞,每个样本至少获取10 000个细胞进行分析。细胞增殖能力通过计算母代增殖的各子代细胞总数进行评估。流式细胞仪前向—侧向散射模式评估细胞死亡率。
2.6 实时荧光定量PCR检测
2.6.1 总RNA抽提
应用试剂盒RNeasy Mini Kit(Qiagen),按照生产商提供的产品使用说明,抽提分离冰冻裂解的CD3+淋巴细胞总RNA另外,可能的DNA污染通过RNA分离试剂盒提供的RNase- Free DNase Set消化移除。抽提的RNA被重新溶解于RNase free water,储存于-80 ℃冰箱,直至使用。分离的总RNA定量及其完整性通过ND-1 000 微量紫外分光光度计(Nano-Drop Technologies)进行分析。
2.6.2 逆转录
使用高容量cDNA反转录试剂盒(Applied Biosystems),据产品使用说明,以0.5~1 μg总RNA为模板,加0.8 μL(25 ×,100mmol/L each) dNTP混合物,1 μL (50 U/ μL) MultiScribe™逆转录酶,2 μL (10×) RT随机引物, 2μl (10×) R T 缓冲液和无菌蒸馏水至20 μL,合成第一链cDNA。
2.6.3 实时定量荧光PCR
mRNA表达利用实时荧光定量PCR仪iCycler(Bio-Rad)通过高灵敏DNA 荧光染料iQ SYBR Green Supermix进行定量分析。反应条件为:1个循环95 ℃预变性3 min;42个循环95 ℃变性15 s;61 ℃退火30 s;72 ℃延伸30 s,自动采集荧光信号,绘制溶解曲线。所有的引物是跨内含子设计的,检测最佳的退火温度。各个引物序列如:基因STIM1(Stromal interaction molecule 1)正向引物:TGAAGAGTCTACCGAAGCAGA,反向引物:AGGTGCTATGTTT CACTGTTGG;基因RYR2 (Ryanodine receptor;2)正向引物:ATTATGAAGGTGGTGCC GTATCA,反向引物TTCCACTCCACGCGACTCTTA。样本双倍检测。通过基因β-actin (正向引物:GTGACGTTGACATCCGTAAAGA,反向引物:GCCGGACT CATCGTACTCC)恒定表达标准化测试目标基因cDNA水平。通过溶解曲线判断基因表达的特异性。样本扩增通过循环阈值(Ct)表示。计算目标基因的循环阈值(Cttarget)与看家基因(Ctβ-aCtin)循环阈值之间的差值(ΔCt),运动组和控制组特定基因表达的变化使用如下公式计算2−Δ(ΔCt),Δ(ΔCt)=(ΔCtEG–ΔCtCG)。
2.7 统计分析
3 结果
3.1 急性运动对PHA诱导淋巴细胞内游离钙离子瞬态的影响
如图1-A所示,在含钙缓冲液中,第100 s加PHA刺激比色杯中淋巴细胞,[Ca2+]i迅速增加;如图1-B所示,以20μg/mL PHA刺激淋巴细胞650 s后,在控制组,[Ca2+]i达到:99.04±9.047 nmol/L,而在运动即刻组,[Ca2+]i减至:87.17±13.020 nM。在运动即刻组和控制组,[Ca2+]i没有显著性差异(P>0.05,n=7);如图1-C所示,与刺激前比较,PHA引起淋巴细胞[Ca2+]i的增幅(加PHA刺激时[Ca2+]i—刺激前[Ca2+]i),在控制组增幅为:56.27±6.236 nmol/ L,而在运动即刻组增幅为:34.53±7.024 nmol/L,运动即刻组淋巴细胞[Ca2+]i增幅与控制组相比差异具有显著性(P<0.05,n=7)。如图1-D所示,在100 s时,在含有0.1 mmol/L EGTA的无钙PBS溶液中加入PHA(应用浓度:20μg/ml)时, [Ca2+]i增幅非常少,在控制组和运动即刻组分别达到38.10±5.335 nmol/L和19.78±5.104,两组差异具有显著性意义(P<0.05,n=6)。为了评估细胞外溶液Ca2+内流对[Ca2+]i增加的贡献度,在第350 s时,加入CaCl2溶液,[Ca2+]i迅速增加,这意味着胞外大量Ca2+可通过胞膜涌入细胞内,在控制组和运动即刻组,PHA诱导的[Ca2+]i分别达到142.8±16.44 nmol/L和185.0±51.45 nmol/L,两组差异具有显著性意义(P<0.05,n=6,如图1-E);如图1-F,Ca2+从细胞内钙库净释放量在控制组和运动即刻组分别为28.28±5.906 nmol/L和11.82±3.919 nmol/L,差异具有显著性(P<0.05,n=6);PHA诱导细胞外钙离子净流入量分别达到104.7±16.84 nM和165.3±52.95 nmol/L,差异不具有显著性意义(P>0.05,n=6)。
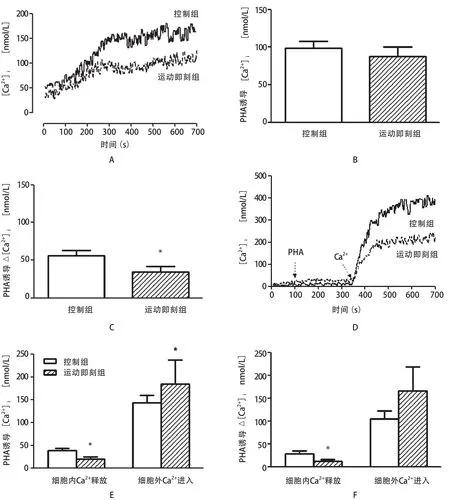
图1 急性运动对PHA诱导淋巴细胞内游离钙离子瞬态的影响Figure 1 The Effect of Treadmill Running on PHA-induced Ca2+Transient State of Lymph Cells
3.2 急性运动对TG诱导淋巴细胞内游离钙离子瞬态的影响
如图2-A所示,在含钙缓冲液中,以10μmol/L TG刺激淋巴细胞,在控制组,[Ca2+]i达到:511.1±38.51 nmol/L,在运动后3 h组达到:635.9±88.52 nmol/L,两组不具有显著性差异(P>0.05,n=5);如图2-B所示,与刺激前[Ca2+]i比较,TG引起淋巴细胞[Ca2+]i的增幅(加TG刺激时[Ca2+]i-刺激前[Ca2+]i),在控制组为:464.9±51.53 nmol/L,而在运动后3 h组为:534.8±111.4 nmol/L,2组淋巴细胞[Ca2+]i的增幅差异具有显著性(P>0.05,n=5)。如图2-C所示,在100 s时,在含有0.1 mmol/L EGTA无钙PBS溶液中加入TG(应用浓度:10μmol/L)时,[Ca2+]i增幅非常少,在控制组和运动后3 h处死组分别达到42.14±9.177 nmol/L和13.25±5.828 nmol/L,两组差异具有显著性(P<0.05,n=7)。为了评估细胞外溶液Ca2+内流对 [Ca2+]i增加的贡献度,在第350 s时,加入CaCl2溶液,[Ca2+]i迅速增加,这意味着胞外大量Ca2+可通过胞膜涌入细胞内,在控制组和运动后3 h组,TG诱导[Ca2+]i分别达到269.4±60.93 nmol/L和169.4±47.08 nmol/ L,两组差异不具有显著性(P>0.05,n=7)(如图2-C);如图2-D,Ca2+从细胞内钙库净释放量在控制组和运动后3 h组分别为23.26±5.161 nmol/L和5.300±1.709 nmol/L,差异具有显著性(P<0.05,n=7);TG诱导细胞外钙离子净流入量分别达到227.3±57.89 nmol/L和156.2±50.44 nmol/L,差异不具有显著性(P>0.05,n=7)。
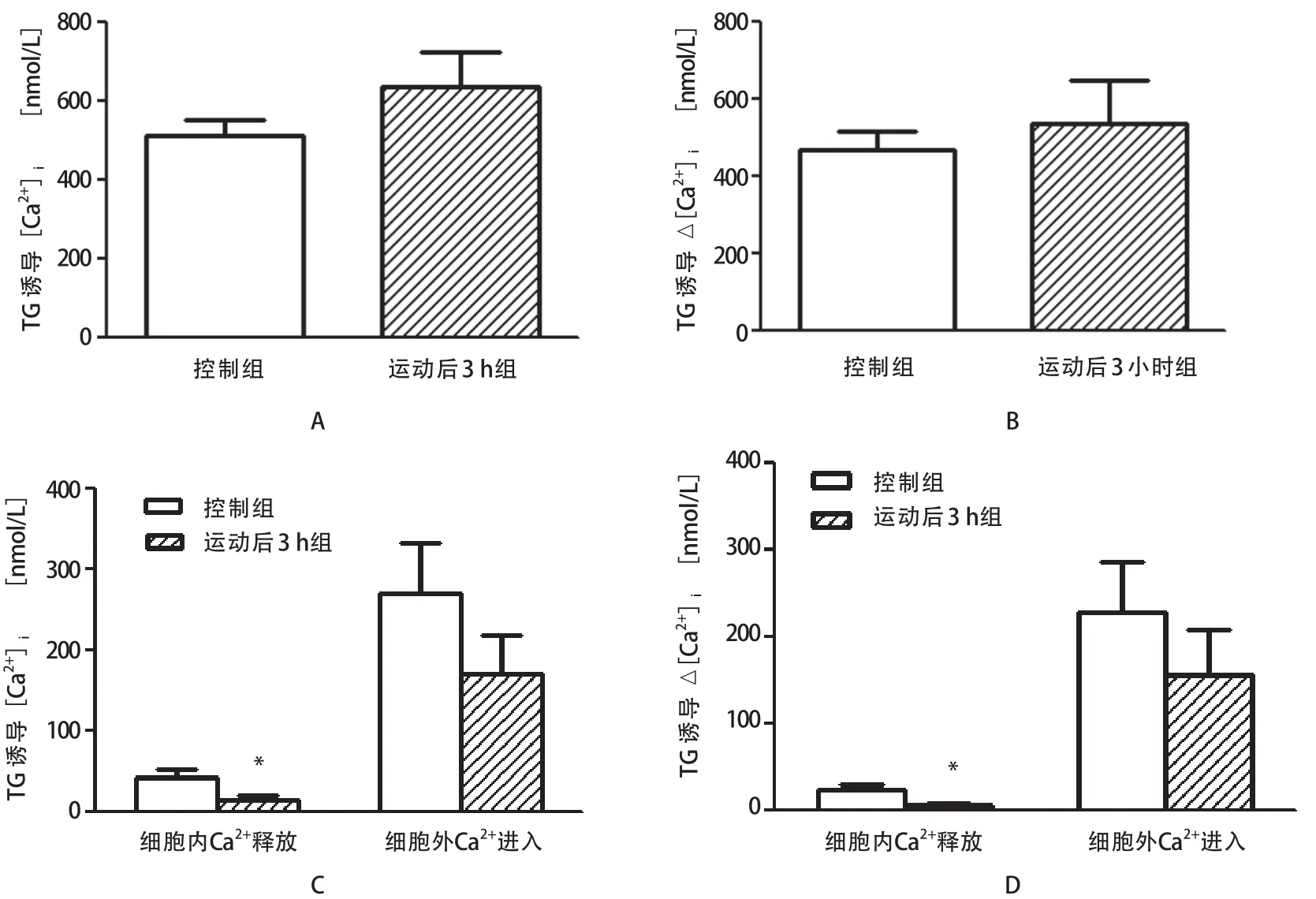
图2 急性运动对TG诱导淋巴细胞内游离钙离子瞬态的影响Figure 2 The Effect of Treadmill Running on TG-induced Ca2+Transient State of Lymph Cells
3.3 急性运动对淋巴细胞增殖能力的影响
为了评估淋巴细胞的增殖能力,用CFSE标识 CD3+ T细胞, 分析各代细胞增殖数。如图3所示,在运动后3 h组,当应用植物血凝素体外刺激淋巴细胞时,其增殖能力被显著抑制(P<0.05,n=10)。
3.4 急性运动对淋巴细胞钙调基因表达的影响
如图4所示,应用实时荧光定量PCR的相对定量法分析,控制组基因表达设定为100%,在运动后3 h组与控制组相比较,STIM1基因表达不具有显著性差异(P>0.05,n=5),而RYR2基因表达显著上调(P<0.05,n=5)。
4 分析与讨论
我们知道,运动可以影响机体免疫系统的结构和功能显型。在外部刺激作用下,淋巴细胞增殖是细胞免疫反应一个至关重要的部分。在许多实验设计中,多克隆有丝分裂原,如植物血凝素,可以用作刺激剂,借此评估淋巴细胞增殖能力。本研究利用的荧光染料CFSE染色结合流式细胞仪技术分析方法,是一种新型研究淋巴细胞增值反应的方法。CFSE是可对活细胞进行荧光标记,高效、流行的监控淋巴细胞增殖过程的一种新型染料。CFSE以荧光染料(羧基荧光素)共价的方式标记长寿命的细胞内蛋白分子,水解发出绿色荧光。它标记淋巴细胞群具有高荧光强度,特别低的不一致性,加上其低的细胞毒性,使其成为评估细胞增殖水平的理想染料。因为它是一种基于荧光素的染料,与其他众多的荧光染料兼容使其适用于多色流式细胞仪分析[16]。
先前已经有实验使用人体或动物模型研究急性运动对淋巴细胞增殖能力的影响。例如:Kwak等[5],Randall等[15],Lin等[6]报道了急性运动引起伴刀豆凝集素A(Con A)刺激脾脏淋巴细胞增殖能力降低;Potteiger等[12],Mazzeo等[7],Gleeson等[3]等也研究显示,急性运动引起T细胞增殖能力下降;Tian[17]报道相比运动前水平,急性运动下调淋巴细胞增殖能力;人体实验研究显示,在急性运动结束2 h到几小时内,PHA和 Con A刺激会引起的淋巴细胞增殖反应水平下降[9]。有研究表明,淋巴细胞增殖反应与运动负荷有关。Siedlik指出,持续时间超过1 h的急性运动,不管其运动强度如何,对淋巴细胞增殖反应都会有一个更大幅度的抑制效应[16];Dohi等[1]报道,抗阻力运动仅减少在大强度组受试者淋巴细胞增殖反应水平;纵向研究显示,在高水平运动员,T淋巴功能对运动负荷非常敏感,随着负荷加大,其增殖反应水平下降[19];然而,Nehlsen-Cannarella 等[8]报道,45 min步行,相比静坐休息,没有引起自发的或Con A刺激淋巴细胞增殖反应能力显著变化,但急性运动1.5 h以后,相比静息条件而言,PHA刺激淋巴细胞增殖能力有一降低的趋势。本研究所采用的运动强度是VO2max80%,长时间力竭性运动被证明引起PHA刺激淋巴细胞增殖反应能力下降,与上述研究报道一致。当然也有研究报道30 min 亚极量强度运动对PHA刺激淋巴细胞增殖能力没有影响[18]。可是,急性运动下调淋巴细胞增殖反应能力的分子机制是什么呢?

图3 急性运动对刺激剂诱导淋巴细胞增值水平的影响Figure 3 The Effect of Treadmill Running on Agonist-induced Cellular Differentiation of Lymph Cells
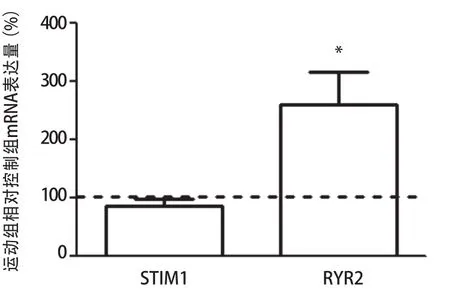
图4 急性运动对淋巴细胞STIM1和RYR2基因表达的影响Figure 4 The Effect of Treadmill Running on Expression of STIM1 and RYR2 of Lymph Cells
Ca2+是非常重要的“第二信使”分子,它是细胞内信号转导网络中的一个焦点。细胞内钙离子浓度,即[Ca2+]i,其增减可成为众多细胞生化反应“启”和“闭”的开关,它广泛参与细胞功能反应过程。细胞内Ca2+荧光指示剂及其双波长测定模式的研发开启了细胞内Ca2+稳态和信号转导研究一次革命。细胞内Ca2+指示剂的特异性及其对其他大多数生理离子不敏感性提供了可直接测量活细胞[Ca2+]i技术,这种荧光指示剂是以非破坏性的方式负载细胞,而且双波长测定可大大减少染料浓度不一,负载不均匀,渗漏,光照,光漂白等因素影响,提供改良的信号和噪声比,更高的时间分辨率,更稳定,可重现的结果。本研究使用的fura-2,作为一种比率测量Ca2+的钙荧光指示剂,它对Ca2+有高敏感性,而对Mg2+敏感性小,使其可在几十微摩尔级准确检测细胞内[Ca2+]i。
在本研究中,我们观察到在刺激剂(PHA,TG)作用下,淋巴细胞胞内Ca2+变化的动态学过程,它可分两个阶段:在刺激剂加入后,[Ca2+]i立刻增加,并经过数十秒达到一个高的水平(第1阶段);然后逐渐降低,但是没有恢复到基础水平,仍然保持一个增加的趋势并稳定在一水平(第2阶段)。本研究结果显示,急性运动结束即刻,PHA诱导淋巴细胞内Ca2+浓度变化幅度和Ca2+释放率下降,运动结束3 h,TG诱导淋巴细胞内“钙库” Ca2+释放率降低。这意味着急性运动引起淋巴细胞内Ca2+信号转导的减弱。这些研究建议,急性运动对淋巴细胞钙信号转导的影响可能存在时相关系。
T淋巴细胞表面的特异性抗原受体(TCR)是一种与细胞内Ca2+动员耦合的受体,它与CD3紧密联结形成蛋白复合物。在抗原结合T细胞受体,形成TCR-CD3复合物以后,激活酪氨酸激酶依赖性的肌醇磷脂酶C(PLC-γ),导致肌醇1,4,5-三磷酸(IP3)形成。IP3与内质网上的IP3配体门控钙通道结合,开启钙通道促使Ca2+从胞内钙库释放,继而引起持续的胞外Ca2+跨膜涌入,使胞内Ca2+浓度升高。刺激终止以后,在内质网膜和质膜Ca2+-ATP酶(SERCA,PMCA)作用下,[Ca2+]i被调控恢复到刺激前水平。在免疫细胞,胞外Ca2+内流主要由胞膜上钙释放激活钙通道(CRAC)完成, Orai蛋白是组成CRAC通道的关键蛋白,STIM(Stormal interaction molecule)分子是定位在内质网膜上的钙离子传感器,STIM分子(包括STIM1和STIM2两个亚型,而STIM1是最重要的)能感受内质网腔内钙离子浓度变化,与Orai通道相互作用并激活Orai通道,最后开放CRAC通道,引起细胞外Ca2+内流。RYR2是定位在内质网膜上的Ca2+释放通道基因,本研究显示,急性运动下调其核酸表达水平,这可以进一步解释急性运动引起细胞内Ca2+释放的机制。本研究显示,在急性运动3 h以后, RyR通道基因表达下调可能致使“钙库”释放Ca2+水平下降,抑制Ca2+信号转导过程,因而降低淋巴细胞增殖分化能力。
5 小结
综上所述,急性大负荷运动下调淋巴细胞内质网网膜钙通道基因表达,从而抑制胞内钙离子释放以及胞内Ca2+信号转导过程,相应地降低刺激剂诱导淋巴细胞增殖能力,即:淋巴细胞免疫功能削弱。这可能是急性运动引起机体免疫抑制的一个重要分子机制。
[1] DOHI K,MASTRO A M,MILES M P,et al. Lymphocyte proliferation in response to acute heavy resistance exercise in women:influence of muscle strength and total work[J]. Eur J Appl Physiol,2001,85(3-4):367-373.
[2] GLEESON M.Immune system adaptation in elite athletes[J]. Curr Opin Clin Nutr Metab Care,2006,9(6):659-665.
[3] GLEESON M,BISHOP N C.The T cell and NK cell immune response to exercise[J]. Ann Transplant,2005,10(4):43-48.
[4] KRUGER K,AGNISCHOCK S,LECHTERMANN A,et al. Intensive resistance exercise induces lymphocyte apoptosis via cortisol and glucocorticoid receptor-dependent pathways[J]. J Appl Physiol ,2011,110(5):1226-1232.
[5] KWAK Y S. Effects of training on spleen and peritoneal exudate reactive oxygen species and lymphocyte proliferation by splenocytes at rest and after an acute bout of exercise[J]. J Sports Sci,2006,24(9):973-978.
[6] LIN Y S,JAN M S,CHEN H I. The effect of chronic and acute exercise on immunity in rats[J]. Int J Sports Med,1993,14(2):86-92.
[7] MAZZEO R S,RAJKUMAR C,ROLLAND J,et al. Immune response to a single bout of exercise in young and elderly subjects[J]. Mech Ageing Dev,1998,100(2):121-132.
[8] NEHLSEN-CANNARELLA S L,NIEMAN D C,JESSEN J,et al. The effects of acute moderate exercise on lymphocyte function and serum immunoglobulin levels[J]. Int J Sports Med,1991,12(4):391-398.
[9] NIELSEN H B,PEDERSEN B K. Lymphocyte proliferation in response to exercise[J]. Eur J Appl Physiol Occup Physiol,1997,75(5):375-379.
[10] NIEMAN D C. Is infection risk linked to exercise workload?[J]. Med Sci Sports Exerc,2000,32(7 Suppl):S406-411.
[11] PEDERSEN B K,HOFFMAN-GOETZ L.Exercise and the immune system:regulation,integration,and adaptation[J]. Physiol Rev,2000,80(3):1055-1081.
[12] POTTEIGER J A,CHAN M A,HAFF G G,et al. Training status inf l uences T-cell responses in women following acute resistance exercise[J]. J Strength Cond Res,2001,15(2):185-191.
[13] QUAH B J,WARREN H S,PARISH C R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fl uorescent dye carboxyf l uorescein diacetate succinimidyl ester[J]. Nat Protoc,2007,2(9):2049-2056.
[14] RADAK Z,SASVARI M,NYAKAS C,et al. Single bout of exercise eliminates the immobilization-induced oxidative stress in rat brain[J]. Neurochem Int,2001,39(1):33-38.
[15] RANDALL J A,HOFFMAN-GOETZ L,THORNE R,et al. Exercise stress alters the percentage of splenic lymphocyte subsets in response to mitogen but not in response to interleukin-1[J]. Brain Behav Immun,1989,3(2):119-128.
[16] SIEDLIK J A,BENEDICT S H,LANDES E J,et al. Acute bouts of exercise induce a suppressive effect on lymphocyte proliferation in human subjects:A meta-analysis[J]. Brain Behav Immun,2016,56:343-351.
[17] TIAN Y,NIE J,TONG T K,et al. The release of immunosuppressive factor(s) in young males following exercise[J]. Sens (Basel),2012,12(5):5586-5595.
[18] WALSH N P,GLEESON M,SHEPHARD R J,et al. Position statement. Part one:Immune function and exercise[J]. Exerc Immunol Rev,2011,17:6-63.
[19] VERDE T,THOMAS S,SHEPHARD R J. Potential markers of heavy training in highly trained distance runners[J]. Br J Sports Med,1992,26(3):167-175.
The Effect of Treadmill Running With High Load on the Transient State of Endocellular Calciumion,the Expression of Relative Channel Genes and Agonist-stimulated Cellular Differentiation in Lymph Cells
LIU Ren-yi1,LI Yi-xin2
The cellular differentiation response of lymph cells is usually used to assess immune cell function. Physical activity-induced immunosuppression is a hot topic in sports medicine research,but its mechanism is still unclear. The study examines the effect of a single bout of treadmill running on the transient state of endocellular calcium ion,expression of the genes,STIM1 and RYR2 and PHA-stimulated cellular differentiation in lymph cells in order to investigate the molecular mechanism of physical activity with high load-induced immunosuppression. In this study,matched male mice were assigned to 3 groups of chontrol,0 h and 3 h after a single bout of running,randomly. The running mice carried out a single bout of treadmill-running with 80% Vo2max. Lymph cells were isolated from animal spleens. Endocellular calcium ion was decided by using a fl uorospectrophotometer to measure fura-2(AM)-dyed cell suspension. The combination of fl ow cytometry with carboxy-f l uorescein succinimidyl ester (CFSE) loading method was used to decide cellular differentiation. The expressions of STIM and RYR genes were determined by real-time PCR. In this study,we found that PHA-induced change of [Ca2+]i;and endocellular Ca2+release and were signif i cantly reduced (P<0.05) at 0 h after treadmill running;TG-induced endocellular Ca2+release was signif i cantly reduced (P<0.05),agonist-induced cellular different -iation were signif i cantly decreased at 3 h after treadmill running (P<0.05),and RYR gene expression of lymph cells was signif i cantly reduced (P<0.05) at 3h after treadmill running. The study suggests that a single bout of intensive running could cause impairment of endocellular calcium ion release and calcium signaling transduction,expression of the relative channel genes and cellular differentiation in lymph cells;the mechanism of physical activity with high load-induced immunosuppression could be related with impairment of the transient state of endocellular calcium ion.
physical activity with high load,calcium ion,channels,lymph cells
G804.7
A
1002-9826(2017)03-0048-07
10. 16470/j. csst. 201703008
2016-07-12;
2017-04-06
中央高校基本科研业务费专项资金项目(CUG150607)。
刘仁仪,男,副教授,博士,主要研究方向为运动与免疫,Tel:027-67883652,E-mail:renyi.liu@foxmail. com。
1.中国地质大学(武汉),湖北 武汉430074;2.湘南学院,湖南 郴州423000
1.China University of Geosciences(Wuhan) ,Wuhan 430074,China;2.Xiangnan University,Chenzhou 423000,China.

