熊果酸通过AMPK/STAT3/COX-2信号通路抑制胃癌细胞增殖*
焦 政 朱国琴 周逸婵 徐 娴 李晓林 李剑萍 何晓璞 徐 伟 邵 耘 孙为豪#
南京医科大学第一附属医院老年消化科1(210029)
南京医科大学附属南京医院消化科2 盐城市第一人民医院肿瘤科3
熊果酸通过AMPK/STAT3/COX-2信号通路抑制胃癌细胞增殖*
焦 政1朱国琴1周逸婵1徐 娴2李晓林1李剑萍3何晓璞1徐 伟1邵 耘1孙为豪1#
南京医科大学第一附属医院老年消化科1(210029)
南京医科大学附属南京医院消化科2盐城市第一人民医院肿瘤科3
背景:前期研究发现,熊果酸通过下调环氧合酶2(COX-2)表达抑制胃癌细胞增殖,但熊果酸抑制COX-2表达的分子机制尚未完全明确。目的:探讨单磷酸腺苷活化蛋白激酶(AMPK)/信号转导与转录活化因子3(STAT3)/COX-2信号通路在熊果酸抑制胃癌细胞增殖中的作用。方法:构建AMPK-pLVX、AMPK-shRNA、STAT3-pLVX、STAT3-shRNA质粒,分别转染胃癌细胞株SGC-7901和MKN-45,并给予不同浓度或不同培养时间的熊果酸进行培养。以蛋白质印迹法检测磷酸化AMPK、磷酸化STAT3和COX-2表达,CCK-8法检测胃癌细胞增殖。结果:在SGC-7901和MKN-45细胞中,熊果酸呈剂量和时间依赖性地促进AMPK磷酸化、抑制STAT3磷酸化和COX-2表达。敲除AMPK基因能阻断熊果酸抑制STAT3磷酸化和COX-2表达的作用,过表达STAT3基因能逆转熊果酸抑制COX-2表达的作用。敲除AMPK基因和过表达STAT3基因均可逆转熊果酸抑制胃癌细胞增殖的作用。结论:熊果酸可能通过AMPK/STAT3通路下调COX-2表达而抑制胃癌细胞增殖。
熊果酸; 胃肿瘤; AMP活化蛋白激酶类; STAT3转录因子; 环氧化酶2; 细胞增殖
胃癌是严重影响我国人民生命健康的恶性肿瘤,术后总体5年生存率约20%,有远处转移者的5年生存率不到5%[1]。根治性手术是目前治疗胃癌的最有效方法,但近70%的患者确诊时已发生局部或全身转移,而无法行手术切除。因此,寻求有效的辅助治疗药物十分必要,天然药物及其提取物的抗癌作用近年已引起国内外学者的广泛关注。熊果酸具有抑制肿瘤细胞增殖、诱导细胞凋亡、抑制血管生成和抗突变等生物学活性,已成为肿瘤化学预防的研究热点[2-3]。本研究的前期研究[4-5]发现,环氧合酶2(COX-2)在胃癌发生、浸润和转移中发挥重要作用,熊果酸通过下调COX-2表达而抑制胃癌细胞增殖、诱导细胞凋亡。但熊果酸抑制COX-2表达的分子机制目前尚不明确。
单磷酸腺苷活化蛋白激酶(AMPK)在人类恶性肿瘤的发生、发展中扮演重要角色[6-7],与胃癌的预后密切相关[8]。信号转导与转录活化因子(STAT)是一种重要的信号级联分子,参与与细胞周期进程、细胞凋亡、血管生成、肿瘤细胞侵袭和转移相关靶基因的表达,在肿瘤发生、发展中发挥重要的调控作用[9]。本研究通过转染人胃腺癌细胞株敲除或过表达AMPK、STAT3的质粒,旨在探讨AMPK/STAT3/COX-2通路在熊果酸抑制胃癌细胞增殖中的作用。
材料与方法
一、主要材料
1. 药物和试剂:熊果酸由中国药品生物制品检定所(北京)提供;BCA试剂盒购自Pierce公司;兔抗人AMPK和磷酸化AMPK(p-AMPK)、COX-2、β-actin单克隆抗体、STAT3和磷酸化STAT3(p-STAT3)多克隆抗体购自Cell Signaling Technology公司;辣根过氧化物酶标记的山羊抗兔IgG抗体购自Santa Cruz公司。ECL试剂盒购自Amersham公司;无内毒素质粒小提中量试剂盒购自天根生化科技(北京)有限公司,CCK-8试剂盒购自日本同仁化学研究所。LipofectamineTM2000转染试剂购自Invitrogen公司,AMPK-shRNA、AMPK-pLVX、STAT3-shRNA、STAT3-pLVX、NC-shRNA以及NC-pLVX质粒购自汉恒生物科技有限公司。
2. 细胞株:人胃腺癌中分化细胞株SGC-7901购自中国科学院上海细胞生物学研究所,人胃腺癌低分化细胞株MKN-45购自南京凯基生物科技发展有限公司。
二、研究方法
1. 药物配制:熊果酸以DMSO溶解后加入RPMI-1640培养液稀释至所需浓度,DMSO的终浓度不超过0.1%,4 ℃保存备用。
2. 细胞培养:SGC-7901和MKN-45细胞常规传代培养于含10%胎牛血清的RPMI-1640培养基中,于37 ℃、5% CO2、饱和湿度的孵箱中培养,隔天换液,3 d传代一次。
3. 质粒提取:AMPK、STAT3特异性shRNA和pLVX寡核苷酸链合成以及DNA序列测定由汉恒生物科技有限公司完成,提取纯化质粒DNA。
4. 细胞转染:转染前24 h,取对数生长期细胞接种于6孔培养板,以无抗菌药物培养基培养至转染当日细胞融合度达70%~80%,按LipofectamineTM2000转染试剂说明书步骤行瞬时转染。将细胞分为空白对照组、阴性对照组和转染组,分别给予未转染、转染NC-shRNA或NC-pLVX、转染敲除或过表达AMPK和STAT3的质粒(转染与脂质体配比为 1∶2.5)。转染后37 ℃孵箱培养6 h,更换培养基继续孵育 24 h,荧光显微镜下检测绿色荧光蛋白的表达。
5. 蛋白质印迹法:取对数生长期细胞,以熊果酸(0、10、20、30 μmol/L)干预24 h,或以30 μmol/L 熊果酸干预培养不同时间(0 h、6 h、12 h、24 h、48 h),或转染24 h后,加或不加30 μmol/L熊果酸干预24 h,收集细胞。预冷的PBS洗涤3次,加入细胞裂解液裂解细胞,4 ℃ 12 000×g离心30 min,取上清,BCA法测定蛋白浓度。取等量蛋白进行SDS-PAGE电泳后转印至PVDF膜,4 ℃封闭 2 h,分别加入兔抗人AMPK、p-AMPK、STAT3、p-STAT3、COX-2和β-actin抗体(工作浓度均为1∶1 000),4 ℃ 孵育过夜,加入二抗,4 ℃孵育2 h。ECL发光,使用全自动荧光/化学发光成像分析系统(Tanon 5200 Multi,上海天能科技有限公司)对蛋白电泳条带行成像和半定量分析。实验重复3次。
6. CCK-8法检测细胞增殖活力:取对数生长期5×103个细胞,制成单细胞悬液,接种于96孔培养板,常规培养24 h至细胞贴壁,换无血清RPMI-1640培养液继续培养24 h。加入熊果酸(0、10、20、30 μmol/L)干预24 h,或转染24 h后,加或不加30 μmol/L 熊果酸干预24 h,然后每孔加入无血清RPMI-1640培养液100 μL和CCK-8溶液10 μL,作用2~4 h。以空白对照组调零,于波长450 nm处测定各孔吸光度(A)值。细胞活力=(处理组A值-空白对照组A值)/(非处理组A值-空白对照组A值),实验重复3次,每组设5个复孔。
三、统计学分析
结 果
一、熊果酸对AMPK、STAT3磷酸化和COX-2表达的影响
熊果酸可呈剂量和时间依赖性地诱导SGC-7901和MKN-45细胞AMPK磷酸化、抑制STAT3磷酸化和COX-2表达(图1、图2)。
二、熊果酸通过AMPK抑制STAT3磷酸化和COX-2表达
与空白对照组和阴性对照组相比,AMPK敲除组SGC-7901和MKN-45细胞p-AMPK蛋白表达显著降低,而AMPK过表达组显著升高(P<0.05)。空白对照组与阴性对照组之间差异无统计学意义(P>0.05)(图3)。
在SGC-7901和MKN-45细胞中,与阴性对照组相比,熊果酸组p-STAT3和COX-2蛋白表达显著降低(P<0.01),AMPK敲除组p-STAT3和COX-2蛋白表达显著升高(P<0.01)。与熊果酸组相比,熊果酸+AMPK敲除组p-STAT3和COX-2蛋白表达显著升高(P<0.05)(图4)。与AMPK过表达组相比,熊果酸+AMPK过表达组p-STAT3和COX-2蛋白表达显著降低(P<0.05)(图5)。
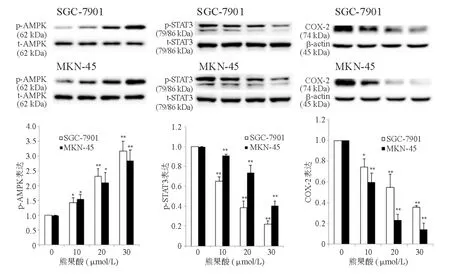
与SGC-7901或MKN-45细胞0 μmol/L熊果酸组比较,*P<0.05,**P<0.01
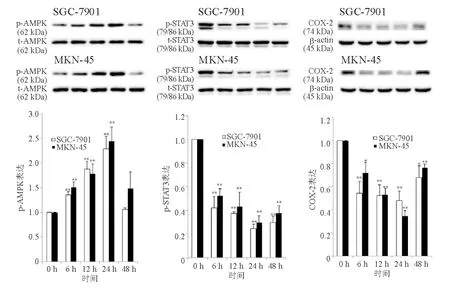
与SGC-7901或MKN-45细胞0 h熊果酸比较,*P<0.05,**P<0.01
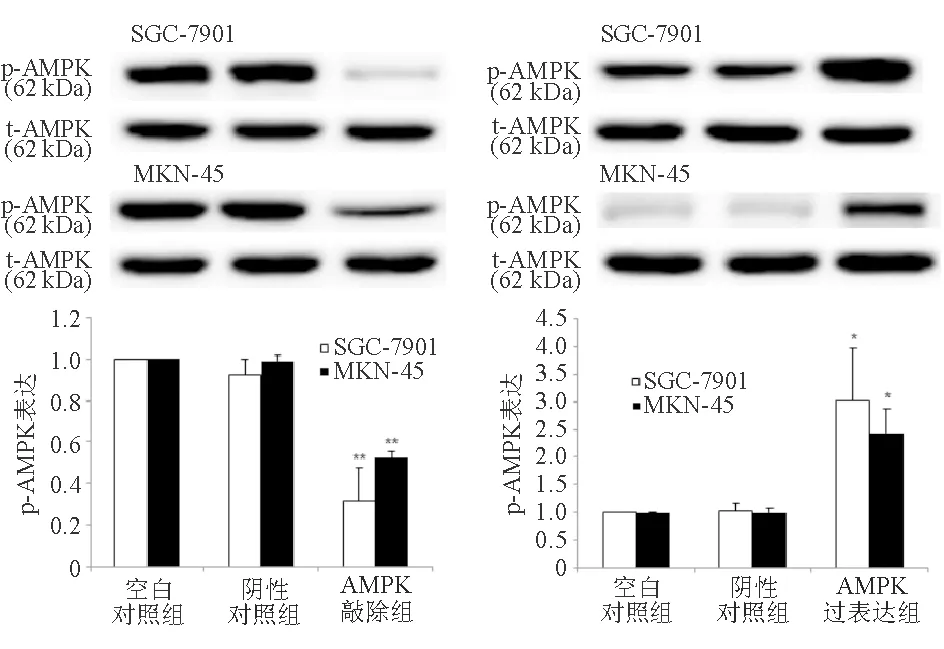
与SGC-7901或MKN-45细胞空白对照组和阴性对照组比较,*P<0.05,**P<0.01
图3 敲除或过表达AMPK对胃癌细胞p-AMPK蛋白表达的影响(蛋白质印迹法)
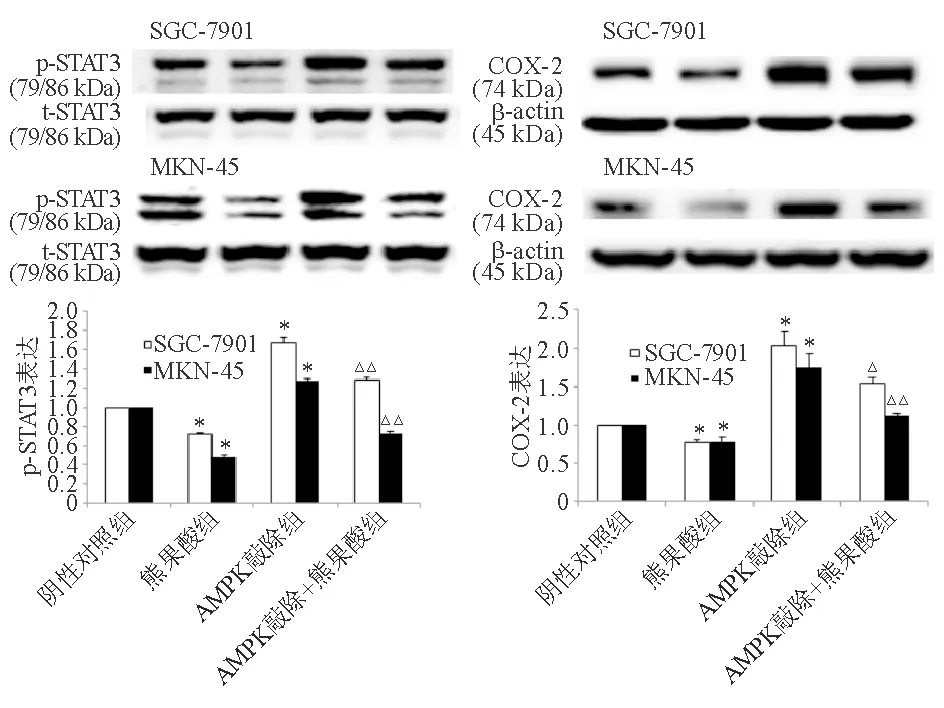
与SGC-7901或MKN-45细胞阴性对照组比较,*P<0.01;与SGC-7901或MKN-45细胞熊果酸组比较,△P<0.05,△△P<0.01
图4 敲除AMPK基因对熊果酸抑制胃癌细胞p-STAT3和COX-2蛋白表达的影响(蛋白质印迹法)
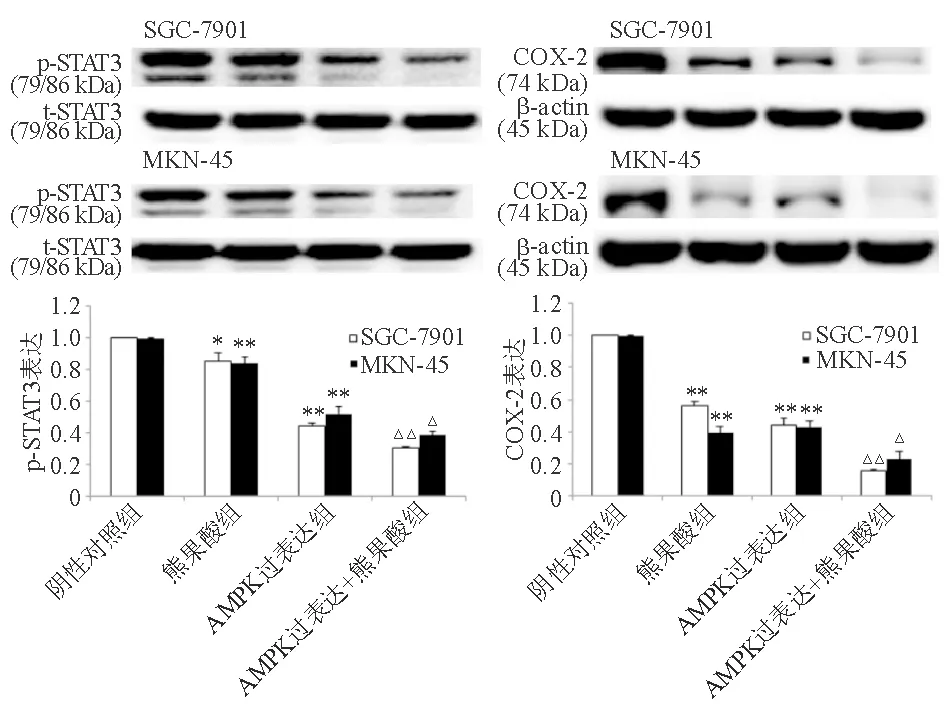
与SGC-7901或MKN-45细胞阴性对照组比较,*P<0.05,**P<0.01;与SGC-7901或MKN-45细胞AMPK过表达组比较,△P<0.05,△△P<0.01
图5 过表达AMPK对熊果酸抑制胃癌细胞p-STAT3和COX-2蛋白表达的影响(蛋白质印迹法)
三、熊果酸通过STAT3抑制COX-2表达
与空白对照组和阴性对照组相比,STAT3敲除组p-STAT3蛋白表达显著降低(P<0.01),而STAT3过表达组显著升高(P<0.05)。空白对照组与阴性对照组之间差异无统计学意义(P>0.05)(图6)。
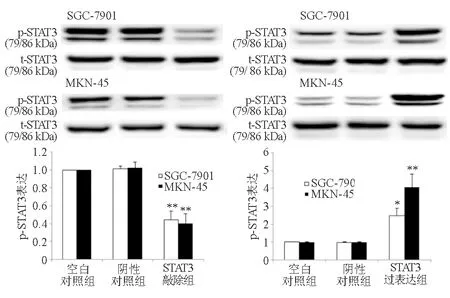
与SGC-7901或MKN-45细胞空白对照组和阴性对照组比较,*P<0.05,**P<0.01
图6 敲除或过表达STAT3对胃癌细胞p-STAT3蛋白表达的影响(蛋白质印迹法)
在SGC-7901和MKN-45细胞中,与阴性对照组相比,熊果酸组COX-2蛋白表达显著降低(P<0.01),STAT3敲除组COX-2蛋白表达显著降低(P<0.01)。与STAT3敲除组相比,熊果酸+STAT3敲除组COX-2蛋白表达显著降低(P<0.05);与熊果酸组相比,熊果酸+STAT3过表达组显著升高(P<0.05)(图7)。
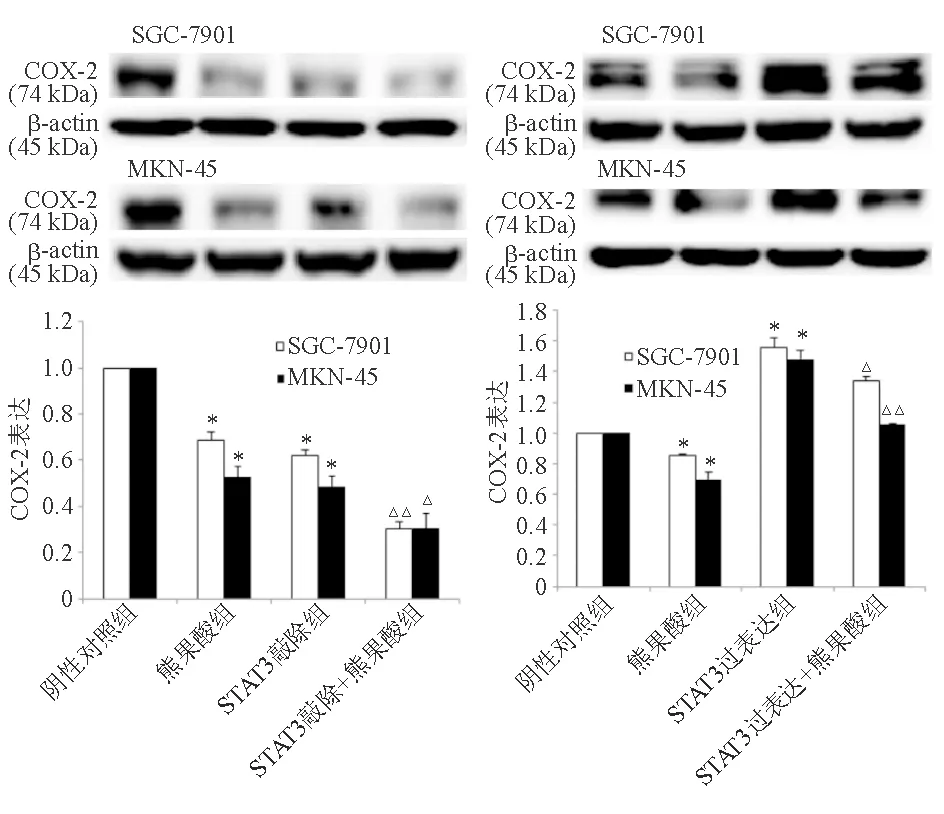
与SGC-7901或MKN-45细胞阴性对照组比较,*P<0.01;与SGC-7901或MKN-45细胞STAT3敲除组、熊果酸组比较,△P<0.05,△△P<0.01
图7 敲除或过表达STAT3对胃癌细胞COX-2蛋白表达的影响(蛋白质印迹法)
四、熊果酸抑制胃癌细胞增殖作用的调控
熊果酸呈剂量依赖性地抑制SGC-7901和MKN-45细胞增殖。在SGC-7901和MKN-45细胞中,空白对照组与阴性对照组细胞活力差异无统计学意义(P>0.05),熊果酸组较阴性对照组显著降低(P<0.05),熊果酸+AMPK敲除组细胞活力显著高于熊果酸组(P<0.05),熊果酸+STAT3过表达组细胞活力显著高于熊果酸组(P<0.05)(图8)。
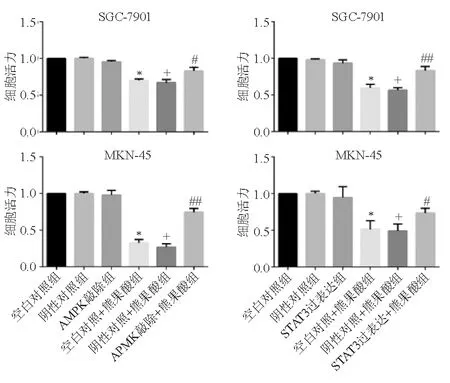
*与SGC-7901或MKN-45细胞空白对照组比较,P<0.01;+与SGC-7901或MKN-45细胞阴性对照组比较,P<0.01;与SGC-7901或MKN-45细胞熊果酸组比较,#P<0.05,##P<0.01
图8 敲除AMPK或过表达STAT3对胃癌细胞增殖作用的调控(CCK-8法)
讨 论
近年随着分子生物学技术的发展以及新化疗药物的应用,胃癌诊治水平有了一定程度的提高,但其预后仍不尽如人意。防止肿瘤复发和转移的辅助治疗越来越受到国内外学者的重视。熊果酸是一种五环三萜类化合物,广泛存在于白花蛇舌草、夏枯草、女贞子和乌梅等天然植物中。动物实验[3,10]显示熊果酸在转基因肿瘤动物模型和裸鼠移植瘤模型中的抑瘤作用显著,具有良好的临床应用前景。有研究[11-12]发现,熊果酸通过激活AMPK诱导肝癌和膀胱癌细胞凋亡。AMPK是细胞能量代谢的主要调节器[13],激活AMPK可诱导胃癌和胰腺癌等肿瘤细胞发生凋亡[14-15]。白藜芦醇(resveratrol)的抗肿瘤作用与AMPK活化有关[16],另一种植物提取物小檗碱(berberine)通过激活AMPK减少COX-2表达而抑制黑色素瘤细胞的转移潜能[17]。
本研究结果显示,熊果酸促进胃癌细胞AMPK磷酸化,并抑制STAT3磷酸化和COX-2表达。敲除AMPK基因和过表达STAT3基因均可逆转熊果酸诱导的COX-2蛋白表达下调,降低熊果酸对胃癌细胞的增殖抑制作用。Yamaoka等[18]证实在大鼠、小鼠以及人类COX-2基因启动子内含有一种GAS序列,该序列为STAT结合区域,提示STAT3可能参与COX-2的上游转录调节过程。本研究结果证实,过表达AMPK和敲除STAT3基因可进一步促进熊果酸诱导的COX-2表达下调,从而增强熊果酸对胃癌细胞的增殖抑制作用。熊果酸通过抑制TNF、佛波酯等引起的NF-κB激活作用,抑制NF-κB依赖性COX-2、MMP-9以及cyclin D1表达,从而产生抗肿瘤的作用[19]。文献报道JAK2/STAT3和PI3K/Akt信号途径能诱导COX-2的表达[20-21],而熊果酸能阻断STAT3通路而抑制多发性骨髓瘤细胞的增殖[22]。STAT3在各种人胃癌细胞株和胃癌组织中均具有较高的活性,JAK/STAT信号转导途径可能在胃癌的发生、发展中起有重要作用[23]。综上所述,本研究推测熊果酸通过AMPK/STAT3通路下调COX-2表达进而抑制胃癌细胞增殖。当然,由于细胞内信号转导机制十分复杂,熊果酸抑制胃癌细胞COX-2表达尚不排除存在其他通路的作用,且不同通路之间可能存在关联(如cross-talk等),全面了解其机制还需行大量而深入的研究。
1 Zhang ZX, Gu XZ, Yin WB, et al. Randomized clinical trial on the combination of preoperative irradiation and surgery in the treatment of adenocarcinoma of gastric cardia (AGC) -- report on 370 patients[J]. Int J Radiat Oncol Biol Phys, 1998, 42 (5): 929-934.
2 Zhao C, Yin S, Dong Y, et al. Autophagy-dependent EIF2AK3 activation compromises ursolic acid-induced apoptosis through upregulation of MCL1 in MCF-7 human breast cancer cells[J]. Autophagy, 2013, 9 (2): 196-207.
3 Shanmugam MK, Manu KA, Ong TH, et al. Inhibition of CXCR4/CXCL12 signaling axis by ursolic acid leads to suppression of metastasis in transgenic adenocarcinoma of mouse prostate model[J]. Int J Cancer, 2011, 129 (7): 1552-1563.
4 He XP, Shao Y, Li XL, et al. Downregulation of miR-101 in gastric cancer correlates with cyclooxygenase-2 overexpression and tumor growth[J]. FEBS J, 2012, 279 (22): 4201-4212.
5 Zhang H, Li X, Ding J, et al. Delivery of ursolic acid (UA) in polymeric nanoparticles effectively promotes the apoptosis of gastric cancer cells through enhanced inhibition of cyclooxygenase 2 (COX-2)[J]. Int J Pharm, 2013, 441 (1-2): 261-268.
6 Wang J, Qi Q, Feng Z, et al. Berberine induces autophagy in glioblastoma by targeting the AMPK/mTOR/ULK1-pathway[J]. Oncotarget, 2016, 7 (41): 66944-66958.
7 徐亚洲, 廖红, 张陆勇, 等. 腺苷一磷酸激活蛋白激酶激活剂研究进展[J]. 药学进展, 2014, 38 (2): 125-131.
8 Zheng Z, Zheng Y, Zhang M, et al. Reciprocal expression of p-AMPKa and p-S6 is strongly associated with the prognosis of gastric cancer[J]. Tumour Biol, 2016, 37 (4): 4803-4811.
9 Siveen KS, Sikka S, Surana R, et al. Targeting the STAT3 signaling pathway in cancer: role of synthetic and natural inhibitors[J]. Biochim Biophys Acta, 2014, 1845 (2): 136-154.
10 Prasad S, Yadav VR, Sung B, et al. Ursolic acid inhibits growth and metastasis of human colorectal cancer in an orthotopic nude mouse model by targeting multiple cell signaling pathways: chemosensitization with capecitabine[J]. Clin Cancer Res, 2012, 18 (18): 4942-4953.
11 Son HS, Kwon HY, Sohn EJ, et al. Activation of AMP-activated protein kinase and phosphorylation of glycogen synthase kinase3 β mediate ursolic acid induced apoptosis in HepG2 liver cancer cells[J]. Phytother Res, 2013, 27 (11): 1714-1722.
12 Zheng QY, Jin FS, Yao C, et al. Ursolic acid-induced AMP-activated protein kinase (AMPK) activation contributes to growth inhibition and apoptosis in human bladder cancer T24 cells[J]. Biochem Biophys Res Commun, 2012, 419 (4): 741-747.
13 Hardie DG. AMPK: positive and negative regulation, and its role in whole-body energy homeostasis[J]. Curr Opin Cell Biol, 2015, 33: 1-7.
14 Saitoh M, Nagai K, Nakagawa K, et al. Adenosine induces apoptosis in the human gastric cancer cells via an intrinsic pathway relevant to activation of AMP-activated protein kinase[J]. Biochem Pharmacol, 2004, 67 (10): 2005-2011.
15 Wang B, Wang XB, Chen LY, et al. Belinostat-induced apoptosis and growth inhibition in pancreatic cancer cells involve activation of TAK1-AMPK signaling axis[J]. Biochem Biophys Res Commun, 2013, 437 (1): 1-6.
16 Yuan Y, Xue X, Guo RB, et al. Resveratrol enhances the antitumor effects of temozolomide in glioblastoma via ROS-dependent AMPK-TSC-mTOR signaling pathway[J]. CNS Neurosci Ther, 2012, 18 (7): 536-546.
17 Kim HS, Kim MJ, Kim EJ, et al. Berberine-induced AMPK activation inhibits the metastatic potential of melanoma cells via reduction of ERK activity and COX-2 protein expression[J]. Biochem Pharmacol, 2012, 83 (3): 385-394.
18 Yamaoka K, Otsuka T, Niiro H, et al. Activation of STAT5 by lipopolysaccharide through granulocyte-macrophage colony-stimulating factor production in human monocytes[J]. J Immunol, 1998, 160 (2): 838-845.
19 Shishodia S, Majumdar S, Banerjee S, et al. Ursolic acid inhibits nuclear factor-kappaB activation induced by carcinogenic agents through suppression of IkappaBalpha kinase and p65 phosphorylation: correlation with down-regulation of cyclooxygenase 2, matrix metalloproteinase 9, and cyclin D1[J]. Cancer Res, 2003, 63 (15): 4375-4383.
20 Xu W, Chen GS, Shao Y, et al. Gastrin acting on the cholecystokinin2 receptor induces cyclooxygenase-2 expression through JAK2/STAT3/PI3K/Akt pathway in human gastric cancer cells[J]. Cancer Lett, 2013, 332 (1): 11-18.
21 Gao J, Tian J, Lv Y, et al. Leptin induces functional activation of cyclooxygenase-2 through JAK2/STAT3, MAPK/ERK, and PI3K/AKT pathways in human endometrial cancer cells[J]. Cancer Sci, 2009, 100 (3): 389-395.
22 Pathak AK, Bhutani M, Nair AS, et al. Ursolic acid inhibits STAT3 activation pathway leading to suppression of proliferation and chemosensitization of human multiple myeloma cells[J]. Mol Cancer Res, 2007, 5 (9): 943-955.
23 Huang W, Yu LF, Zhong J, et al. Stat3 is involved in angiotensin Ⅱ-induced expression of MMP2 in gastric cancer cells[J]. Dig Dis Sci, 2009, 54 (10): 2056-2062.
(2016-11-07收稿;2016-12-25修回)
Ursolic Acid Inhibits Gastric Cancer Cells Proliferation through AMPK/STAT3/COX-2 Signaling Pathway
JIAOZheng1,ZHUGuoqin1,ZHOUYichan1,XUXian2,LIXiaolin1,LIJianping3,HEXiaopu1,XUWei1,SHAOYun1,SUNWeihao1.
1DepartmentofGeriatricGastroenterology,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing(210029);2DepartmentofGastroenterology,NanjingFirstHospitalAffiliatedtoNanjingMedicalUniversity,Nanjing;3DepartmentofOncology,YanchengCityNo.1People’sHospital,Yancheng,JiangsuProvince
SUN Weihao, Email: swh@njmu.edu.cn
Ursolic Acid; Stomach Neoplasms; AMP-Activated Protein Kinases; STAT3 Transcription Factor; Cyclooxygenase 2; Cell Proliferation
10.3969/j.issn.1008-7125.2017.04.004
国家自然科学面上项目(No.81372659)
#本文通信作者,Email: swh@njmu.edu.cn
Background: Previous study has found that ursolic acid (UA) inhibited the proliferation of gastric cancer cells by the down-regulation of cyclooxygenase-2 (COX-2) expression. However, its molecular mechanism is not fully clear. Aims: To investigate the role of adenosine monophosphate-activated protein kinase (AMPK)/signal transducer and activator of transcription 3 (STAT3)/COX-2 signaling pathway in UA-mediated inhibition of gastric cancer cells proliferation. Methods: AMPK-pLVX, AMPK-shRNA, STAT3-pLVX, STAT3-shRNA plasmids were constructed, and then were transfected into human gastric cancer cell lines SGC-7901 and MKN-45, respectively. Gastric cancer cells were cultured with different concentrations of UA for different times. The expressions of phosphorylated AMPK (p-AMPK), phosphorylated STAT3 (p-STAT3) and COX-2 were measured by Western blotting, and cell proliferation was detected by CCK-8 assay. Results: UA dose- and time-dependently increased p-AMPK expression, inhibited p-STAT3 and COX-2 expressions in SGC-7901 and MKN-45 cells. Knockdown of AMPK blocked UA-induced inhibition of STAT3 phosphorylation and COX-2 expression. Overexpression of STAT3 blocked UA-induced down-regulation of COX-2 expression. Knockdown of AMPK and overexpression of STAT3 blocked UA-induced inhibition of proliferation of gastric cancer cells. Conclusions: UA may inhibit the proliferation of gastric cancer cells via down-regulation of COX-2 expression through AMPK/STAT3 pathway.

