维生素D3对结肠炎大鼠肠黏膜Toll样受体4表达的影响*
高鸿亮 周 禾 姚 萍
新疆医科大学第一附属医院消化科(830000)
维生素D3对结肠炎大鼠肠黏膜Toll样受体4表达的影响*
高鸿亮#周 禾 姚 萍△
新疆医科大学第一附属医院消化科(830000)
背景:近年我国溃疡性结肠炎(UC)的患病率明显增高,Toll样受体4(TLR4)与UC的发生、发展可能密切相关。目的:探讨维生素D3对结肠炎模型大鼠肠黏膜TLR4表达的影响。方法:将30只Sprague-Dawley大鼠随机分为正常对照组、模型组和维生素D3组。模型组和维生素D3组大鼠给予三硝基苯磺酸(TNBS)灌肠制备结肠炎模型,维生素D3组给予胆维丁乳灌肠。行HE染色,评估疾病活动指数(DAI)和组织病理学评分,采用免疫组化法检测结肠组织TLR4表达。结果:与正常对照组相比,模型组DAI、组织病理学评分显著增高(P<0.05),结肠组织TLR4表达显著增高(P<0.05)。给予维生素D3干预后,DAI、组织病理学评分显著降低(P<0.05),TLR4表达显著降低(P<0.05)。结论:结肠炎大鼠结肠组织中TLR4高表达,可能与UC发病有关。维生素D3可通过抑制TLR4表达减轻结肠炎大鼠的肠道炎症反应,从而发挥辅助治疗UC的作用。
结肠炎,溃疡性; 胆骨化醇; Toll样受体4
溃疡性结肠炎(ulcerative colitis, UC)是一种非特异性肠道炎症性疾病,具有慢性、反复发作的特点。UC以溃疡为主要病理表现,病变主要局限于黏膜层和黏膜下层。近年随着经济的飞速发展和饮食习惯的改变,我国UC的患病率明显增高[1-3]。目前UC的病因和确切发病机制尚不明确,多种因素参与其发病。UC治疗效果并不理想,世界卫生组织(WHO)已将其列为现代难治病之一。动物实验[4]发现,1,25-二羟基维生素D3有抑制肠道炎症的作用。维生素D3是维生素D中生物代谢率最高的一种活性形式,已在多种自身免疫病中发现其具有重要的免疫调节作用[5],特别是Th1细胞介导的自身免疫病。维生素D3对免疫的调控途径之一为调控抗原呈递细胞(APC)上Toll样受体(TLRs)家族的表达及其功能。本研究通过给予结肠炎大鼠维生素D3治疗,并检测TLR4的表达,旨在阐明维生素D3治疗UC的可能机制,为临床推广应用维生素D3提供理论和实验依据。
材料与方法
一、实验动物、主要试剂
1. 实验动物:SPF级Sprague-Dawley(SD)大鼠30只,雌雄各半,体质量(230±40) g,购于新疆医科大学实验动物中心,常规饲养1周。
2. 主要试剂:2,4,6-三硝基苯磺酸(TNBS)购于Sigma公司;胆维丁乳(商品名:英康利)原液购于北京索莱宝科技有限公司;兔抗大鼠TLR4多克隆抗体购于Santa Cruz公司;山羊抗兔二抗、DAB显色剂等购于北京中杉金桥生物技术有限公司。
二、研究方法
1. 模型制备和分组:按随机数字表法,将大鼠分为正常对照组、模型组和维生素D3组,每组10只。造模前,模型组和维生素D3组大鼠禁食24 h并称重,10%水合氯醛(300 mg/kg)腹腔注射进行麻醉,将8FR小儿导尿管缓慢插入肛门约8 cm处。5% TNBS与50%乙醇等体积混合,0.4 mL/100 g缓慢注入大鼠肠道,保持肛门高位5 min,以防止药液流出[6]。正常对照组以等量0.9% NaCl溶液灌肠。灌肠24 h后分别从模型组和正常对照组中随机抽取2只大鼠,处死后观察结肠组织情况,判断模型的制备情况。维生素D3组造模成功后第2天给予胆维丁乳原液(每支含维生素D330万单位/8 mL)1 875 U 灌胃,每天1次,持续10 d。正常对照组和模型组给予等量0.9% NaCl溶液灌胃。
2. HE染色:药物干预第10天,麻醉大鼠,仰卧位固定于动物手术台,分别切取溃疡、充血水肿明显处约1 cm的结肠末端、结肠中部、结肠起始处肠段,4%多聚甲醛溶液固定,石蜡切片,行HE染色。镜下观察结肠黏膜病理改变,按Cooper等[7]的方法行组织病理学评分。
3. 疾病活动指数(DAI)[7]:造模后每日观察大鼠体质量变化、粪便性状、血便和粪便隐血情况,计算DAI。
4. 免疫组化染色:石蜡切片经脱蜡、封闭、抗原热修复后,加兔抗大鼠多克隆抗体TLR4(工作浓度 1∶100);滴加生物素标记的山羊抗兔IgG二抗;显色;复染;封片。以PBS液代替一抗作为空白对照。
结果判断[8]:以细胞膜和(或)细胞质呈棕黄色者为阳性细胞。高倍镜下随机选择5个视野,以阳性细胞数与染色强度评分之和作为染色评分。阳性细胞数<5%,0分;5%~25%,1分;26%~50%,2分;51%~75%,3分;>75%,4分。染色强度:不着色,0分;浅黄色,1分;棕色,2分;深棕色,3分。
三、统计学分析
结 果
一、一般情况和DAI
正常对照组大鼠活动如常,毛色亮泽,饮食正常,活跃好动,体质量稳定增长,粪便性状正常。模型组大鼠灌肠后第1天出现少动,食欲不佳,毛发粗糙、无光泽,肛周皮毛被粪便污染,排便次数增多且多为稀便,体质量明显减轻。维生素D3组灌胃1周后食欲较模型组改善,活动度增加,排便转为糊状便或正常。与正常对照组相比,模型组体质量显著降低(P<0.05),DAI显著增高(P<0.05);给予维生素D3干预后,体质量显著增加(P<0.05),DAI显著降低(P<0.05)(表1)。
二、组织病理学评分
正常对照组大鼠肠壁结构清晰,黏膜上皮完整,细胞排列整齐,固有层杯状细胞丰富,腺体排列规则,仅见少量散在炎性细胞浸润。模型组大鼠黏膜上皮细胞大量破坏,固有层杯状细胞减少、腺体排列紊乱、纤维组织增生,黏膜层、黏膜下层大量炎性细胞(中性粒细胞和淋巴细胞)浸润,隐窝脓肿形成。维生素D3组病理损害较模型组有不同程度减轻(图1)。与正常对照组相比,模型组组织病理学评分显著升高(P<0.05);给予维生素D3干预后,组织病理学评分显著降低(P<0.05)(表1)。
三、免疫组化染色
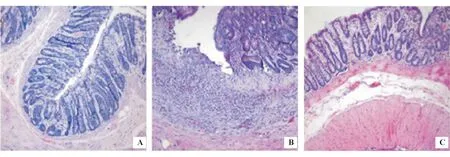
A:正常对照组;B:模型组;C:维生素D3组


组 别例数体质量(g)DAI组织病理学评分TLR4表达正常对照组10167.8±5.3 001.86±0.80 模型组1096.0±6.4∗4.35±0.67∗1.69±0.33∗6.12±0.60∗维生素D3组10133.5±2.1∗#2.28±1.22∗#0.43±0.01∗#4.09±0.90∗#
*与正常对照组比较,P<0.05;#与模型组比较,P<0.05
TLR4在正常对照组和维生素D3组大鼠结肠黏膜层、黏膜下层和固有层中的表达较弱,而在模型组黏膜表面炎性细胞胞质和胞膜中强表达,可见棕黄色颗粒,且上皮表达呈连续性,越接近上皮部位,表达越强(图2)。与正常对照组相比,模型组TLR4表达显著增高(P<0.05);给予维生素D3干预后,TLR4表达显著降低(P<0.05)(表1)。
讨 论
UC患者存在自身免疫功能失衡,肠黏膜伴有大量炎性细胞聚集,产生大量炎性介质和细胞因子,引起并放大黏膜炎症。目前多数学者认为免疫反应异常是UC发病的主要原因[9]。UC在患病群体中有年轻化趋势,对个体健康、生活和工作带来巨大影响。近年发现维生素D除对钙、磷的代谢具有调节作用外,在抗感染和调节免疫方面亦有广泛作用[10-12]。维生素D可调节免疫系统发育和功能,其活性形式通过直接或间接作用抑制炎症性肠病(IBD)致病T细胞的功能,诱导调节T细胞从而抑制IBD发展,故维生素D可能对IBD的发病产生影响。同时,IBD患者容易发生骨量减少和骨质疏松,从而大大增加了骨折的风险,使患者生活质量受到严重影响。
目前,越来越多的证据支持TLRs与UC的发生、发展有密切联系[13]。TLRs是一种重要的模式识别受体,广泛表达于天然免疫细胞和特异性免疫细胞表面,与病原生物上的配体结合,从而启动非特异性免疫应答,释放白细胞介素(IL)-1、IL-8、IL-6、IL-10、肿瘤坏死因子(TNF)-α、IL-12、B7分子、一氧化氮合成酶等细胞因子,最终导致炎症反应的发生。据文献报道,TLR4引发的信号转导通路在类风湿性关节炎、系统性红斑狼疮等自身免疫病的发病中起有重要作用[14-15]。维生素D3通过TLRs信号通路可影响初始T细胞的分化,使组织中Treg细胞和Th1细胞的比例发生变化。随着对肠黏膜免疫的深入研究,越来越多证据显示肠黏膜上皮细胞除作为固有屏障的作用外,还可作为免疫活性细胞参与肠黏膜天然免疫反应。肠黏膜上皮细胞将腔内高浓度抗原与黏膜免疫系统分隔开来,并分泌黏液形成黏液层。在受抗原刺激或致病微生物的入侵时肠黏膜上皮还能通过表达MHC-Ⅱ类抗原,参与抗原呈递,将信号传递至固有层内的炎性细胞,而且自身能表达并释放多种细胞因子、趋化因子和抗菌肽,如IL-6、IL-1α、IL-1β、TNF-α、GM-CSF、IL-8等。
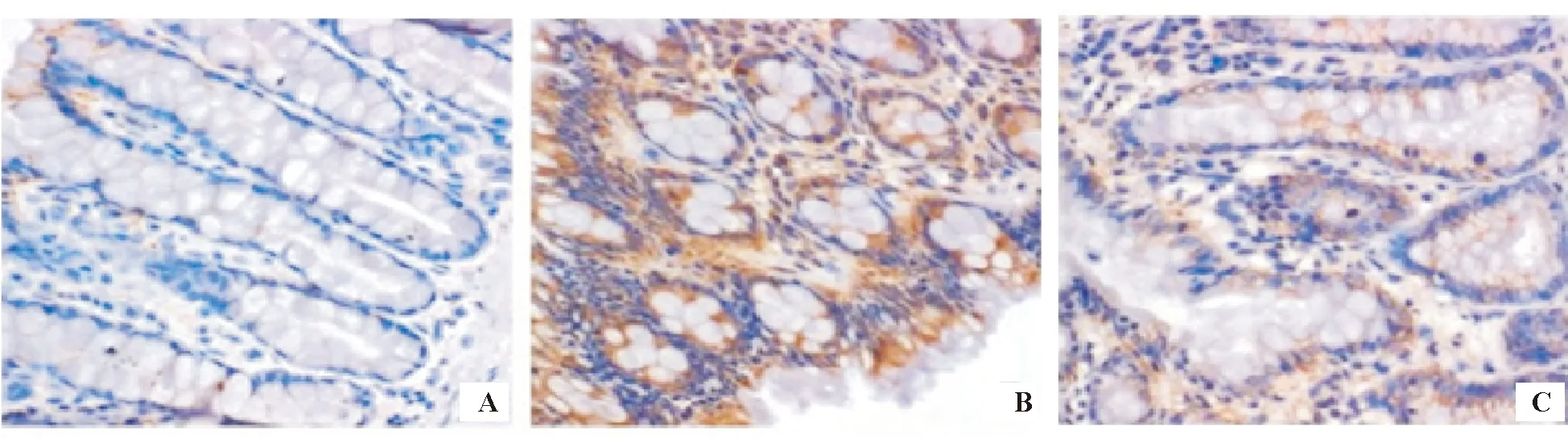
A:正常对照组;B:模型组;C:维生素D3组
本研究发现正常对照组大鼠结肠黏膜微弱表达TLR4,说明正常大鼠通过下调细胞表面TLR4表达,使肠道对细菌产生良好耐受能力,减少细胞对细菌抗原的识别,减轻肠黏膜的免疫反应。模型组大鼠肠黏膜TLR4表达较正常对照组明显增加,且病理结果示肠黏膜出现腺体结构紊乱,黏膜上皮细胞破坏,中性粒细胞、巨噬细胞浸润等炎症反应,提示TLR4在UC的发病中起有一定作用,可能参与UC的发生、发展,与Hausmann等[16]的研究结果一致。而采用维生素D3干预后,大鼠饮食、毛色、体质量、精神状况等一般状态明显改善,组织病理炎症反应以及TLR4表达有不同程度的改善,说明维生素D3可抑制TLR4表达,减少了细菌抗原物质触发异常免疫反应的机会,有效缓解了TNBS诱导的实验性结肠炎。
综上所述,结肠炎大鼠TLR4表达明显增加,而维生素D3可通过抑制肠黏膜上皮细胞TLRs介导的异常免疫反应而发挥抗炎作用。为临床应用维生素D3辅助治疗UC提供了良好的实验依据,但研究结论仍需进一步验证。
1 王福彦. 炎症性肠病的发病率、患病率与环境因素的影响[J]. 中国社会医学杂志, 2007, 24 (2): 138-139.
2 齐海鑫, 徐伟祥. 药物治疗溃疡性结肠炎进展[J]. 现代中西医结合杂志, 2011, 20 (30): 3900-3902.
3 Loftus EV Jr. Clinical epidemiology of inflammatory bowel disease: Incidence, prevalence, and environmental influences[J]. Gastroenterology, 2004, 126 (6): 1504-1517.
4 Laverny G, Penna G, Vetrano S, et al. Efficacy of a potent and safe vitamin D receptor agonist for the treatment of inflammatory bowel disease[J]. Immunol Lett, 2010, 131 (1): 49-58.
5 Cantorna MT. Vitamin D, multiple sclerosis and inflammatory bowel disease[J]. Arch Biochem Biophys, 2012, 523 (1): 103-106.
6 Cheon GJ, Cui Y, Yeon DS, et al. Mechanisms of motility change on trinitrobenzenesulfonic acid-induced colonic inflammation in mice[J]. Korean J Physiol Pharmacol, 2012, 16 (6): 437-446.
7 Cooper HS, Murthy SN, Shah RS, et al. Clinicopathologic study of dextran sulfate sodium experimental murine colitis[J]. Lab Invest, 1993, 69 (2): 238-249.
8 郝俊鸣, 江学良, 佟艳铭. 奥沙拉秦钠对溃疡性结肠炎一氧化氮合酶表达的影响[J]. 世界华人消化杂志, 2005, 13 (19): 2392-2394.
9 Neuman MG. Immune dysfunction in inflammatory bowel disease[J]. Transl Res, 2007, 149 (4): 173-186.
10 Raman M, Milestone AN, Walters JR, et al. Vitamin D and gastrointestinal diseases: inflammatory bowel disease and colorectal cancer[J]. Therap Adv Gastroenterol, 2011, 4 (1): 49-62.
11 Holick MF. Vitamin D deficiency[J]. N Engl J Med, 2007, 357 (3): 266-281.
12 Cantorna MT. Vitamin D, multiple sclerosis and inflammatory bowel disease[J]. Arch Biochem Biophys, 2012, 523 (1): 103-106.
13 Cario E. Toll-like receptors in inflammatory bowel diseases: a decade later[J]. Inflamm Bowel Dis, 2010, 16 (9): 1583-1597.
14 Frisard MI, McMillan RP, Marchand J, et al. Toll-like receptor 4 modulates skeletal muscle substrate metabolism[J]. Am J Physiol Endocrinol Metab, 2010, 298 (5): E988-E998.
15 Migita K, Miyashita T, Maeda Y, et al. Toll-like receptor expression in lupus peripheral blood mononuclear cells[J]. J Rheumatol, 2007, 34 (3): 493-500.
16 Hausmann M, Kiessling S, Mestermann S, et al. Toll-like receptors 2 and 4 are up-regulated during intestinal inflammation[J]. Gastroenterology, 2002, 122 (7): 1987-2000.
(2016-09-21收稿;2016-11-02修回)
Effect of Vitamin D3on Expression of Toll-like Receptor 4 in Intestinal Mucosa in Colitis Model in Rats
GAOHongliang,ZHOUHe,YAOPing.
DepartmentofGastroenterology,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi(830000)
YAO Ping, Email: pingyaozh@sina.com
Colitis, Ulcerative; Cholecalciferol; Toll-Like Receptor 4
10.3969/j.issn.1008-7125.2017.04.008
*本课题由新疆维吾尔自治区自然科学基金(2015211C087)资助
#Email: gaohongliang2008@163.com
△本文通信作者,Email: pingyaozh@sina.com
Background: The prevalence of ulcerative colitis (UC) in China has significantly increased in recent years, and Toll-like receptor 4 (TLR4) may be closely related to the development of UC. Aims: To study the effect of vitamin D3on expression of TLR4 in the intestinal mucosa in colitis model in rats. Methods: Thirty Sprague-Dawley rats were randomly divided into normal control group, model group and vitamin D3group. Rats in model group and vitamin D3group were given trinitro-benzene-sulfonic acid (TNBS) to induce colitis model. Rats in vitamin D3group were given vitamin D3. HE staining was performed, and disease activity index (DAI) and colon histopathological score were evaluated, the expression of TLR4 was measured by immunohistochemistry. Results: Compared with normal control group, DAI and histopathological score in model group were significantly increased (P<0.05), and expression of TLR4 was significantly increased (P<0.05). After giving vitamin D3, DAI and histopathological score were significantly decreased (P<0.05), and expression of TLR4 was significantly decreased (P<0.05). Conclusions: The expression of TLR4 is increased in colon tissue in colitis model in rats, which may be involved in the pathogenesis of UC. Vitamin D3can alleviate intestinal inflammation via inhibiting expression of TLR4, thereby playing a role in the adjunctive therapy of UC.

