肝细胞核因子4α抑制人肝癌细胞株血管内皮生长因子表达和人脐静脉内皮细胞小管形成*
汪海天 张 勇 吴 宁 周 琎 杭化莲 马 永# 卞建民#
南京医科大学附属南京医院普外科1(210006) 上海交通大学医学院附属仁济医院肝脏外科2
·论 著·
肝细胞核因子4α抑制人肝癌细胞株血管内皮生长因子表达和人脐静脉内皮细胞小管形成*
汪海天1张 勇1吴 宁1周 琎1杭化莲2马 永1#卞建民1#
南京医科大学附属南京医院普外科1(210006) 上海交通大学医学院附属仁济医院肝脏外科2
背景:肝细胞核因子4α(HNF4α)在肝脏的发育过程中发挥重要作用。研究证实HNF4α与肝细胞癌(HCC)的发生相关。然而HNF4α对人肝癌细胞株血管内皮生长因子(VEGF)表达和人脐静脉内皮细胞(HUVEC)小管形成的调控作用尚不明确。目的:探讨HNF4α对人肝癌细胞株VEGF表达和HUVEC小管形成的影响。方法:构建过表达HNF4α的慢病毒,并转染人肝癌细胞株HepG2和SMMC-7721(实验组),以转染慢病毒空载体和未转染的细胞分别作为阴性对照组和空白对照组。分别以qRT-PCR、蛋白质印迹法检测HNF4α、VEGF mRNA和蛋白表达。将HUVEC与HepG2和SMMC-7721细胞不含血清的条件培养基共培养,检测小管形成数量。结果:成功构建了过表达HNF4α的HepG2和SMMC-7721稳转株。与阴性对照组和空白对照组相比,实验组HepG2和SMMC-7721细胞中VEGF mRNA和蛋白表达均明显降低(P<0.05),HUVEC小管形成数量明显减少(P<0.05)。结论:HNF4α能明显抑制人肝癌细胞株中VEGF表达以及HUVEC小管的形成。
肝细胞核因子4α; 癌,肝细胞; 血管内皮生长因子类; 人脐静脉内皮细胞
肝细胞癌(HCC)是最常见的恶性肿瘤之一。目前治疗方法主要包括肝切除、肝移植、肿瘤消融、化疗,但总体疗效不太理想。近年大量癌基因和抑癌基因功能的研究促进了对HCC发病机制的了解,为HCC的治疗提供了新思路[1]。肝细胞核因子4α(HNF4α)在肝脏的发育过程中发挥重要作用。近年研究发现HNF4α与HCC的发生、发展、转移密切相关[2-4]。血管新生是HCC发生的重要条件,血管内皮生长因子(VEGF)是HCC相关的血管生成因子,在HCC转移复发中的作用尤为突出[5-7]。本研究通过将过表达HNF4α的慢病毒载体转染人肝癌细胞株HepG2和SMMC-7721,旨在探讨HNF4α对VEGF表达以及人脐静脉内皮细胞(HUVEC)体外小管形成的影响。
材料与方法
一、细胞株和主要试剂
人肝癌细胞株HepG2和SMMC-7721购自中国科学院上海细胞库,HUVEC由上海交通大学医学院附属仁济医院中心实验室提供;DMEM高糖培养基、RPMI-1640培养基、PBS和胰酶(Hyclone公司),胎牛血清(Gibco公司),HNF4α过表达慢病毒由吉凯基因公司构建;TRIzol试剂(Invitrogen公司),逆转录试剂盒、SYBR Green Real-time PCR Master Mix(Takara公司);GAPDH、HNF4α单克隆抗体(Abcam公司),VEGF单克隆抗体(武汉博士徳生物工程有限公司);Matrigel MatrixTM(BD Biosciences公司)。
二、研究方法
1. 细胞培养:人肝癌细胞株HepG2、SMMC-7721和HUVEC培养于37 ℃ 5% CO2培养箱中,HepG2和SMMC-7721细胞使用含10%胎牛血清的高糖DMEM培养基培养,HUVEC使用含10%胎牛血清的RPMI-1640培养基培养。
2. 构建人HNF4α慢病毒载体:设计合成HNF4α引物,引物上游为5’-GAG GAT CCC CGG GTA CCG GTC GCC ACA TGC GAC TCT CCA AAA CCC TC-3’,下游为5’-TCC TTG TAG TCC ATA CCG ATA ACT TCC TGC TTG GTG ATG-3’。提取人原代肝细胞总RNA,通过PCR扩增目的基因片段,反应体系20 μL,反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,循环30次;72 ℃ 10 min。PCR产物行琼脂糖凝胶电泳,回收并纯化目的基因片段。将纯化的目的基因片段送吉凯基因公司测序验证,构建携带绿色荧光蛋白(GFP)的慢病毒载体,包括HNF4α过表达载体和不含HNF4α的慢病毒空载体。
3. 细胞分组和处理:将HepG2和SMMC-7721细胞接种于6孔板,确保转染时细胞密度约30%。将细胞分为实验组、阴性对照组和空白对照组,实验组细胞转染20 μL 1×108TU/mL慢病毒(MOI=10),以转染不含HNF4α的慢病毒空载体和未转染的细胞分别作为阴性对照和空白对照。培养8~12 h后弃上清,更换为2 mL新鲜培养基,继续培养,3~4 d后使用荧光显微镜观察荧光表达情况。
4. qRT-PCR法检测HNF4α和VEGF mRNA表达:取各组细胞,TRIzol试剂抽提,逆转录合成cDNA,行PCR反应。反应条件:94 ℃ 2 min;94 ℃ 30 s,55 ℃ 1 min,72 ℃ 1 min,循环33次;72 ℃ 10 min。HNF4α、VEGF和内参β-actin的引物序列见表1。以2-△△Ct法计算目的基因表达。
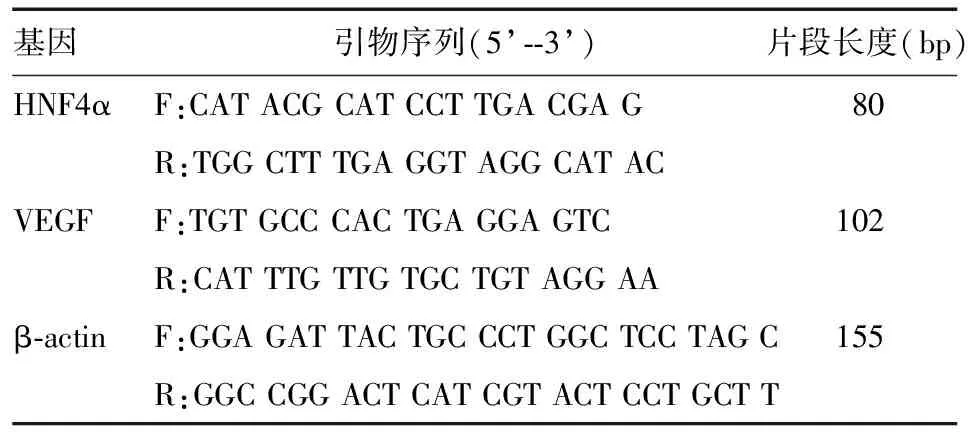
表1 引物序列和片段长度
5. 蛋白质印迹法检测HNF4α和VEGF蛋白表达:取各组细胞,加入RIPA裂解液裂解细胞,4 ℃ 12 000×g离心15 min。取20 μg蛋白行8% SDS-PAGE电泳,分离,转膜,室温封闭1 h。分别加入GAPDH(工作浓度1∶1 000)、HNF4α(工作浓度1∶2 000)、VEGF(工作浓度 1∶200)单克隆抗体,4 ℃ 孵育过夜。加入二抗室温孵育1 h,扫膜成像。
6. 条件培养基的收集:将各组细胞接种于100 mm 培养皿中,保证贴壁融合度为70%左右。过夜后更换为3 mL无血清培养基,继续培养48 h。收集细胞上清,4 °C 800×g离心10 min,-80 ℃ 保存待用。
7. HUVEC小管形成实验:在预冷的96孔板中每孔加入50 μL Matrigel基质胶,37 ℃培养箱放置30 min。在每孔固化的Matrigel基质胶上加入4×104HUVEC以及100 μL条件培养基,然后于37 ℃ 5% CO2培养箱中培养。培养3 h和8 h后倒置显微镜下观察,随机选取3个视野,取均值。
三、统计学分析
结 果
一、过表达HNF4α的慢病毒构建、转染情况
转染72 h后,实验组HepG2和SMMC-7721细胞中HNF4α mRNA和蛋白表达均明显高于阴性对照组和空白对照组(P<0.05)(图1)。
免疫荧光染色结果显示,实验组和阴性对照组中约90%的HepG2和SMMC-7721细胞GFP表达阳性(图2)。提示慢病毒转染成功。
二、VEGF mRNA和蛋白表达
实验组HepG2和SMMC-7721细胞中VEGF mRNA和蛋白表达均明显低于阴性对照组和空白对照组(P<0.05)(图3)。
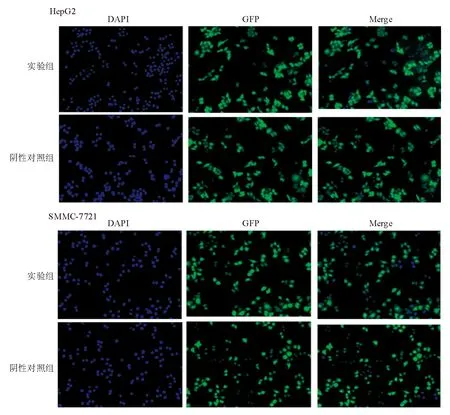
图2 各组HepG2和SMMC-7721细胞免疫荧光染色(×100)
三、HUVEC小管形成情况
培养3 h后,实验组HepG2和SMMC-7721细胞的小管数量均明显低于阴性对照组和空白对照组(P<0.05)(图4A)。培养8 h后,实验组HepG2和SMMC-7721细胞的小管数量均明显低于阴性对照组和空白对照组(P<0.05)(图4B)。
讨 论
HNF4α在调控肝脏基因表达以及肝细胞分化方面发挥重要作用[8]。近年关于HNF4α与HCC发生、发展、转移复发关系的研究不断增多。多项研究[9-10]发现在二乙基亚硝胺诱导的大鼠肝癌模型以及人肝癌组织中HNF4α表达明显降低。HNF4α可能通过β-catenin信号通路抑制肝细胞上皮-间质转化和肿瘤干细胞形成,最终抑制HCC的发生。Yao等[4]发现HNF4α可能通过上皮-间质转化在HCC转移中发挥重要作用。本课题组的前期研究[3]将过表达HNF4α的慢病毒转染至人间充质干细胞(MSC)发现,HNF4α-MSC条件培养基培养的肝癌细胞株生长和转移明显受到抑制,同时发现注射HNF4α-MSC的裸鼠肿瘤体积明显小于注射MSC以及0.9% NaCl溶液的裸鼠。说明HNF4α可明显抑制HCC的发生。
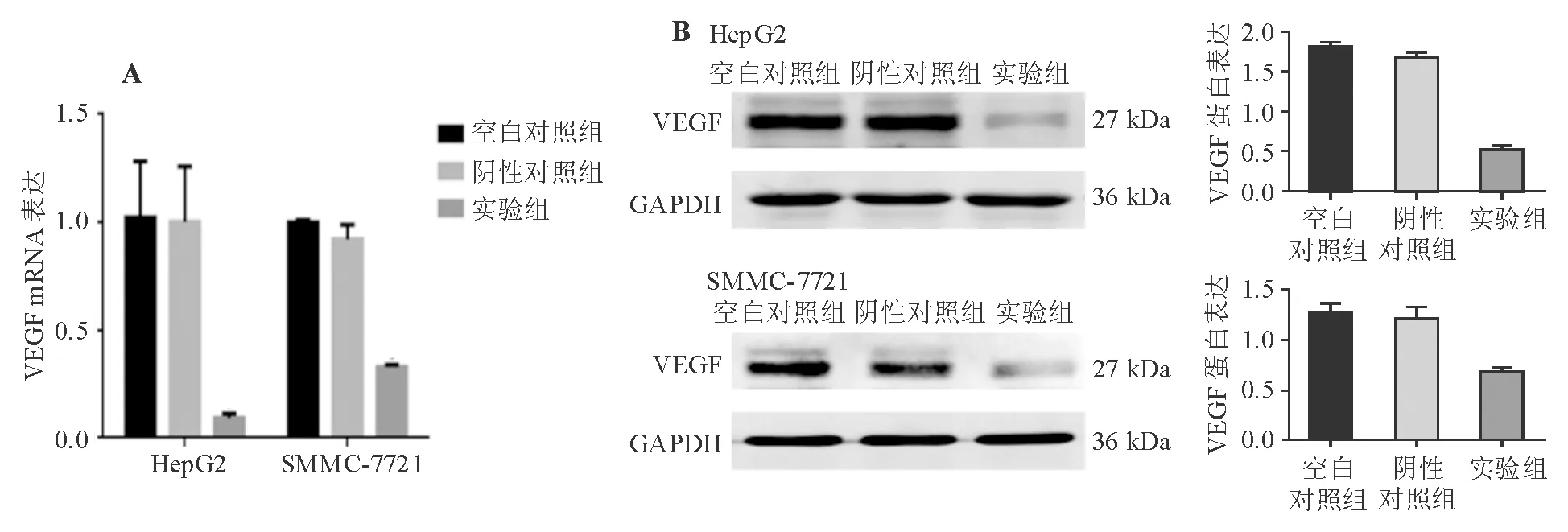
A:mRNA表达(qRT-PCR法);B:蛋白表达(蛋白质印迹法)

A:培养3 h;B:培养8 h
HCC是一种血供丰富的肿瘤,其生长和转移明显依赖血管新生。VEGF是作用最强的血管生成因子之一,在HCC中明显高表达,与手术切除后HCC复发转移呈正相关[7]。多项研究[11-13]表明HCC中VEGF表达和循环具有一定的临床意义,血清或血浆VEGF升高可作为评估HCC的预后指标之一。随着分子生物学研究的深入,针对HCC的新生血管,多个具有抑制肿瘤血管生成作用的药物正处于临床研究中。多激酶抑制剂Sorafenib通过抑制Raf/MEK/细胞外信号调控的激酶信号通路、VEGFR-2、VEGFR-3以及PDGFR-β来抑制细胞增殖和肿瘤血管的形成。目前该药物已投入临床使用,并作为进展期HCC患者的标准治疗方案[14]。抑制肿瘤血管新生已成为控制HCC的主要目标之一。本课题的前期研究[15]证实HNF4α可抑制大鼠肝癌细胞株CBRH-7919新生血管生成相关基因的表达。
本实验以HNF4α慢病毒转染人肝癌细胞株HepG2和SMMC-7721,分别利用qRT-PCR和蛋白质印迹法检测VEGF mRNA和蛋白表达,结果显示HNF4α过表达的肝癌细胞中VEGF mRNA和蛋白表达明显受到抑制。以HNF4α-HepG2和HNF4α-SMMC-7721条件培养基处理HUVEC后,小管形成能力明显降低。综上所述,过表达HNF4α具有抑制HCC血管新生的作用,但具体机制尚不清楚,值得进一步研究,为探索抑制HCC的生长和转移机制以及HCC的治疗提供重要线索。
1 Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2012, 379 (9822): 1245-1255.
2 Ning BF, Ding J, Liu J, et al. Hepatocyte nuclear factor 4α-nuclear factor-κB feedback circuit modulates liver cancer progression[J]. Hepatology, 2014, 60 (5): 1607-1619.
3 Wu N, Zhang YL, Wang HT, et al. Overexpression of hepatocyte nuclear factor 4α in human mesenchymal stem cells suppresses hepatocellular carcinoma development through Wnt/β-catenin signaling pathway downregulation[J]. Cancer Biol Ther, 2016, 17 (5): 558-565.
4 Yao D, Peng S, Dai C. The role of hepatocyte nuclear factor 4alpha in metastatic tumor formation of hepatocellular carcinoma and its close relationship with the mesenchymal-epithelial transition markers[J]. BMC Cancer, 2013, 13: 432.
5 Semela D, Dufour JF. Angiogenesis and hepatocellular carcinoma[J]. J Hepatol, 2004, 41 (5): 864-880.
6 Fernández M, Semela D, Bruix J, et al. Angiogenesis in liver disease[J]. J Hepatol, 2009, 50 (3): 604-620.
7 Muto J, Shirabe K, Sugimachi K, et al. Review of angiogenesis in hepatocellular carcinoma[J]. Hepatol Res, 2015, 45 (1): 1-9.
8 Odom DT, Zizlsperger N, Gordon DB, et al. Control of pancreas and liver gene expression by HNF transcription factors[J]. Science, 2004, 303 (5662): 1378-1381.
9 Ning BF, Ding J, Yin C, et al. Hepatocyte nuclear factor 4 alpha suppresses the development of hepatocellular carcinoma[J]. Cancer Res, 2010, 70 (19): 7640-7651.
10 Walesky C, Edwards G, Borude P, et al. Hepatocyte nuclear factor 4 alpha deletion promotes diethylnitrosamine-induced hepatocellular carcinoma in rodents[J]. Hepatology, 2013, 57 (6): 2480-2490.
11 Llovet JM, Pea CE, Lathia CD, et al; SHARP Investigators Study Group. Plasma biomarkers as predictors of outcome in patients with advanced hepatocellular carcinoma[J]. Clin Cancer Res, 2012, 18 (8): 2290-2300.
12 Kaseb AO, Morris JS, Hassan MM, et al. Clinical and prognostic implications of plasma insulin-like growth factor-1 and vascular endothelial growth factor in patients with hepatocellular carcinoma[J]. J Clin Oncol, 2011, 29 (29): 3892-3899.
13 Zhang W, Zhao CG, Sun HY, et al. Expression characteristics of KAI1 and vascular endothelial growth factor and their diagnostic value for hepatocellular carcinoma[J]. Gut Liver, 2014, 8 (5): 536-542.
14 Zhu AX. Systemic treatment of hepatocellular carcinoma: dawn of a new era? [J]. Ann Surg Oncol, 2010, 17 (5): 1247-1256.
15 张勇, 吴宁, 马永, 等. 肝细胞核因子4α抑制大鼠肝癌细胞增殖、侵袭能力和新生血管生成相关基因表达[J]. 南京医科大学学报(自然科学版), 2016, 36 (4): 430-434.
(2016-10-21收稿;2016-11-20修回)
Hepatocyte Nuclear Factor 4α Inhibits Expression of Vascular Endothelial Growth Factor in Human Hepatocellular Carcinoma Cell Lines and Tube Formation of Human Umbilical Vein Endothelial Cell
WANGHaitian1,ZHANGYong1,WUNing1,ZHOUJin1,HANGHualian2,MAYong1,BIANJianmin1.
1DepartmentofGeneralSurgery,NanjingHospitalAffiliatedtoNanjingMedicalUniversity,Nanjing(210006);2DepartmentofLiverSurgery,RenJiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity,Shanghai
Co-correspondence to: MA Yong, Email: yma0917@163.com; BIAN Jianmin, Email: jianminbian@163.com
Background: Hepatocyte nuclear factor 4α (HNF4α) plays an important role in the development of liver, and studies demonstrate that it is correlated with the pathogenesis of hepatocellular carcinoma (HCC). However, the regulatory effect of HNF4α on expression of vascular endothelial growth factor (VEGF) in human HCC cell lines and tube formation of human umbilical vein endothelial cell (HUVEC) is not yet clear. Aims: To investigate the effect of HNF4α on expression of VEGF in human HCC cell lines and tube formation of HUVEC. Methods: Lentiviral vector overexpressed HNF4α was constructed, and then transfected into HepG2 and SMMC-7721 cells (experimental group), cells transfected with lentiviral blank vector and cells without transfection were served as negative control group and blank control group, respectively. The mRNA and protein expressions of HNF4α, VEGF were detected by qRT-PCR and Western blotting, respectively. The conditioned media of HepG2 and SMMC-7721 cells were co-cultured with HUVEC, and number of HUVEC tube formation was measured. Results: HepG2 and SMMC-7721 cells with stable overexpression of HNF4α were successfully established. Compared with negative control group and blank control group, mRNA and protein expressions of VEGF in experimental group were significantly decreased (P<0.05), and number of HUVEC tube formation was significantly decreased (P<0.05). Conclusions: HNF4α can significantly inhibit the expression of VEGF in HepG2 and SMMC-7721 cells and tube formation of HUVEC.
Hepatocyte Nuclear Factor 4-alpha; Carcinoma, Hepatocellular; Vascular Endothelial Growth Factors; Human Umbilical Vein Endothelial Cells
10.3969/j.issn.1008-7125.2017.04.003
南京市医学科技发展项目(201308014)
#本文共同通信作者,马永,Email: yma0917@163.com; 卞建民,Email: jianminbian@163.com

