乌司他丁对过氧化氢诱导的肠上皮屏障损伤的保护作用
王 改 王志华 段红年 徐 欢 马江涛 刘鑫惠 刘佳琪 李 宁 常春鹏 郝京霞
保定市儿童医院重症监护病房1(071051) 河北省儿童医院重症监护病房2
乌司他丁对过氧化氢诱导的肠上皮屏障损伤的保护作用
王 改1*王志华1段红年1徐 欢1马江涛1刘鑫惠1刘佳琪1李 宁1常春鹏1郝京霞2
保定市儿童医院重症监护病房1(071051) 河北省儿童医院重症监护病房2
背景:肠上皮细胞间紧密连接的破坏及其所致的肠黏膜屏障功能受损在一系列胃肠道疾病的发生、发展中起重要作用。目的:探讨乌司他丁对过氧化氢(H2O2)诱导的肠上皮屏障损伤的保护作用。方法:以Caco-2细胞体外培养制备肠单层上皮屏障模型,将其分为空白对照组(不予干预)、H2O2组(500 μmol/L H2O2)和低浓度(500 U/mL)、高浓度(3 000 U/mL)乌司他丁治疗组并予相应处理。检测丙二醛(MDA)水平、超氧化物歧化酶(SOD)活性,以跨上皮细胞电阻(TEER)和荧光素钠透过率评估上皮屏障功能,蛋白质印迹法和免疫荧光法检测紧密连接蛋白ZO-1、occludin的表达和定位,透射电镜观察紧密连接超微结构。结果:与空白对照组相比,H2O2组Caco-2细胞单层上皮MDA水平、荧光素钠透过率明显升高,SOD活性、TEER、ZO-1和occludin蛋白表达明显降低,差异均有统计学意义(P<0.05)。透射电镜观察和免疫荧光法检测显示H2O2组细胞刷状缘受损,细胞间连接模糊,ZO-1、occludin蛋白分布断续不完整,荧光强度低。乌司他丁治疗组上述指标均较H2O2组显著改善(P<0.05),高浓度组改善更为明显。结论:乌司他丁对H2O2诱导的肠单层上皮屏障损伤有一定保护作用,其机制可能与其抗氧化活性以及调节紧密连接蛋白表达和分布有关。
乌司他丁; 过氧化氢; 肠黏膜屏障; 上皮细胞; 紧密连接部
肠黏膜屏障是机体最重要的防御屏障之一,其能选择性吸收维生素、氨基酸、离子等营养物质,并阻止细菌、毒素等有害物质透过肠黏膜进入血液循环和其他组织器官。肠黏膜上皮细胞间完整的紧密连接(tight junction)是肠黏膜屏障的解剖基础,zonula occludens-1(ZO-1)、claudins、occludin蛋白作为紧密连接的重要组成部分,对于肠黏膜屏障功能的维持至关重要[1-2]。在各种病理状态下,肠上皮细胞间紧密连接破坏,黏膜屏障受损、通透性增加,有害物质通过受损肠黏膜进入血液循环,导致败血症、脓毒症甚至多器官功能衰竭[3-5]。乌司他丁(ulinastatin)是从健康成年男性新鲜尿液中分离纯化的一种糖蛋白,可抑制胰蛋白酶等多种胰酶活性,常用于胰腺炎的治疗。本研究旨在探讨乌司他丁对过氧化氢(hydrogen peroxide, H2O2)诱导的肠上皮屏障损伤的保护作用。
材料与方法
一、细胞株、主要试剂和仪器
Caco-2细胞株(中科院上海细胞库);H2O2、荧光素钠(Sigma-Aldrich Co. LLC.);乌司他丁(广东天普生化医药股份有限公司);丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所);总蛋白提取试剂盒(碧云天生物技术);兔抗ZO-1多克隆抗体、兔抗occludin多克隆抗体(InvitrogenTM, Thermo Fisher Scientific);小鼠抗occludin单克隆抗体、兔抗GAPDH多克隆抗体、HRP标记山羊抗兔IgG、FITC标记山羊抗兔IgG(H+L)、CY3标记山羊抗小鼠IgG(H+L)(Santa Cruz Biotechnology);Transwell小室(Corning Costar);Millcell电阻仪(Merck Millipore);激光共聚焦显微镜(OLYMPUS);H-7500透射电镜(日立)。
二、方法
1. 肠单层上皮屏障模型制作和分组:Caco-2细胞培养于Transwell小室中,培养基为含4 mmol/L谷氨酰胺、100 U/mL青霉素、100 μg/mL链霉素、10%胎牛血清、10 mmol/L HEPES的DMEM培养基,在37 ℃、5% CO2条件下培养。隔日换液,监测跨上皮细胞电阻(transepithelial electrical resistance, TEER)。细胞培养21~28 d后TEER明显增高,证明体外肠单层上皮屏障模型形成。将Caco-2细胞单层上皮分为4组:空白对照组不予特殊处理;H2O2组与终浓度500 μmol/L H2O2共孵育6 h;低浓度(500 U/mL)和高浓度(3 000 U/mL)乌司他丁治疗组予相应终浓度乌司他丁和500 μmol/L H2O2共孵育6 h,乌司他丁在H2O2之前30 min给予。乌司他丁高浓度和低浓度治疗组具体药物浓度系参考相关文献中乌司他丁干预其他细胞(结肠癌LoVo细胞、肥大细胞、人脐静脉内皮细胞)的浓度(50~5 000 U/mL),选取数个浓度梯度进行预实验后根据实验结果确定。每项实验均选取至少3组非同代细胞进行。
2. MDA、SOD测定:参照试剂盒说明书,分别采用硫代巴比妥酸法和黄嘌呤氧化酶法测定Caco-2细胞MDA水平和SOD活性。
3. TEER测定:将Millcell电阻仪的两个电极分别插入Transwell小室顶侧和基底侧,浸没于液体中测量Caco-2细胞单层上皮电阻,整个过程在恒温37 ℃ 下进行。每个小室取不同方向的3个点重复测定3次。电阻值以Ω/cm2表示。
4. 荧光素钠透过率测定:于Transwell小室顶侧加入终浓度为67 mg/mL的荧光素钠,基底侧加入0.6 mL HBSS,37 ℃孵育6 h后收集基底侧液体,荧光分光光度计测定荧光强度(激发波长490 nm,发射波长520 nm),根据标准曲线计算荧光素钠浓度。荧光素钠透过率(%·h-1·cm-2)=[(基底侧荧光素钠荧光量/最初加入顶侧的荧光素钠荧光量)/h]/Transwell有效膜面积×100%[6]。
5. 蛋白质印迹法:参照试剂盒说明书提取各组Caco-2细胞总蛋白,测定蛋白含量。取80 μg蛋白上样,行SDS-PAGE电泳;分别加入兔抗ZO-1多克隆 抗体(1∶250)或兔抗occludin多克隆抗体(1∶300),4 ℃过夜;加入HRP标记山羊抗兔IgG(1∶3 000),室温摇动孵育2 h,ECL显影,凝胶成像分析仪采集图像,ImageJ软件分析蛋白相对表达量。
6. 免疫荧光法:Caco-2细胞单层上皮以4%甲醛固定20 min,PBS漂洗,分别加入兔抗ZO-1多克隆 抗体(1∶80)或小鼠抗occludin单克隆抗体(1∶100),4 ℃过夜;漂洗后加入FITC标记山羊抗兔IgG(1∶50)或CY3标记山羊抗小鼠IgG(1∶250),室温孵育1 h,PBS漂洗5 min×3,防淬灭封片剂封片,激光共聚焦显微镜下观察、拍照。
7. 透射电镜检查:Caco-2细胞单层上皮以4%戊二醛前固定、1%四氧化锇后固定2 h,不同浓度丙酮脱水,组织块置于纯丙酮和包埋剂中浸透,包埋,切片,乙酸双氧铀和枸橼酸铝双重染色,透射电镜下拍照。
三、统计学分析
结 果
一、乌司他丁对H2O2所致氧化应激的影响
与空白对照组相比,H2O2组Caco-2细胞MDA水平明显升高,SOD活性明显降低,差异均有统计学意义(P<0.05)。乌司他丁治疗组MDA水平较H2O2组显著降低(P<0.05),SOD活性较H2O2组显著升高(P<0.05),其中高浓度组MDA水平显著低于低浓度组(P<0.05),SOD活性与低浓度组相比差异无统计学意义(P>0.05)(表1)。
二、乌司他丁对H2O2诱导的肠上皮屏障损伤的影响
1. TEER:Caco-2细胞体外培养21~28 d时,肠单层上皮屏障TEER为(288.85±26.11) Ω/cm2。H2O2组TEER显著低于空白对照组(P<0.05),乌司 他丁治疗组TEER较H2O2组显著增高(P<0.05),高浓度组较低浓度组增高更为明显(P<0.05)(表1)。
2. 荧光素钠透过率:Caco-2细胞体外培养21~28 d时,荧光素钠透过率为(6.48±1.85)%·h-1·cm-2。H2O2组荧光素钠透过率显著高于空白对照组(P<0.05),乌司他丁治疗组荧光素钠透过率较H2O2组显著降低(P<0.05),高浓度组较低浓度组降低更为明显(P<0.05)(表1)。
3. 紧密连接蛋白表达和定位:蛋白质印迹法检测显示,与空白对照组相比,H2O2组ZO-1、occludin蛋白相对表达量明显降低,差异均有统计学意义(P<0.05)(表1、图1)。透射电镜观察显示,空白对照组Caco-2细胞刷状缘完整,排列整齐,细胞间连接清晰,密度高,H2O2组细胞刷状缘受损,排列紊乱,细胞间连接模糊,密度降低(图2),从超微结构角度证实H2O2组肠单层上皮屏障受损、紧密连接破坏。乌司他丁治疗组两种紧密连接蛋白相对表达量均较H2O2组显著增高(P<0.05),高浓度组较低浓度组增高更为明显(P<0.05)(表1、图1)。
免疫荧光法检测显示,空白对照组ZO-1蛋白沿细胞膜分布,发出绿色荧光,呈铺路石样连续完整,荧光强度高;H2O2组ZO-1蛋白分布断续不完整,荧光强度低;乌司他丁则可明显改善H2O2对紧密连接蛋白表达的抑制作用,使之恢复至近似空白对照组的状态,高浓度组作用更为明显。Occludin蛋白发出红色荧光,在各组中的分布表现和荧光强度同ZO-1蛋白(图3)。
讨 论
肠上皮细胞间紧密连接是维持肠黏膜屏障功能的解剖基础,紧密连接破坏及其所致的肠黏膜屏障功能受损在一系列胃肠道疾病的发生、发展中起重要作用。各种病理状态如严重脓毒症、败血症、急性胰腺炎、急性坏死性小肠炎、轮状病毒肠炎等均可导致紧密连接破坏和肠黏膜屏障功能受损,致使细菌、毒素等有害物质透过肠黏膜进入组织器官和血液循环, 形成恶性循环[3-5]。跨膜蛋白occludin是最早被发现、也是研究最多的紧密连接蛋白,具有4次跨膜结构,形成两个外环、 一个内环, 封闭细胞旁间隙,是紧密连接中的主要功能蛋白[7]。ZO-1分布于细胞内膜表面,连接occludin蛋白与细胞骨架蛋白,是紧密连接蛋白家族重要的支架蛋白,其表达和分布的变化可直接影响紧密连接结构和功能,进而影响肠黏膜功能[2,6]。儿童肠壁较薄,肠黏膜屏障功能差、通透性高,此特征在儿科疾病发生、发展中的作用越来越受到关注,保护肠黏膜屏障功能成为相关儿科疾病治疗的关键。

表1 各组Caco-2细胞单层上皮氧化应激和上皮屏障功能相关指标比较±s)
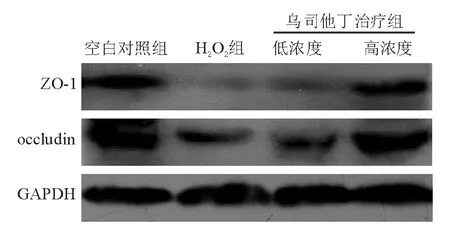
图1 各组Caco-2细胞单层上皮ZO-1、occludin蛋白表达(蛋白质印迹法)
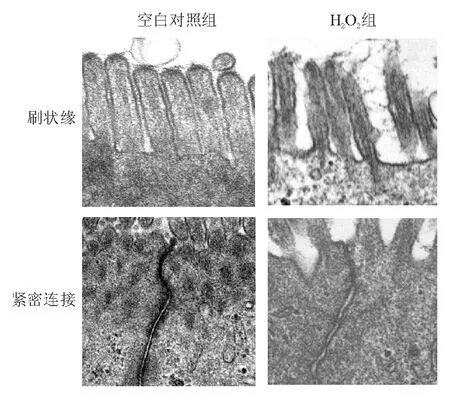
图2 空白对照组和H2O2组Caco-2细胞单层上皮透射电镜 图(×30 000)
Caco-2细胞单层上皮是公认的研究上皮细胞间紧密连接的体外模型[8]。TEER系由离子通过细胞间隙流动而形成,荧光素钠透过率体现的是肠单层上皮对小分子的通透性,这两项指标常用于评价肠单层上皮屏障功能。氧化应激是指体内活性氧的生成超过抗氧化系统防御能力的一种状态,H2O2是众所周知的参与氧化应激致细胞损伤的主要物质。研究证实H2O2对肠黏膜屏障功能具有明显破坏作用,20 μmol/L的浓度即可致Caco-2细胞单层上皮屏障受损,细胞旁通透性增加[9]。本研究以500 μmol/L H2O2干预Caco-2细胞单层上皮6 h,氧化应激指标检测显示MDA水平显著升高,SOD活性显著降低,上皮屏障功能指标TEER显著降低,荧光素钠透过率显著增高,证实H2O2可致氧化应激和肠单层上皮屏障功能损伤,与既往研究结果一致。此外,经 H2O2干预的Caco-2细胞单层上皮紧密连接蛋白ZO-1、occludin表达显著降低,沿细胞膜分布断续不完整,透射电镜观察显示细胞刷状缘受损,排列紊乱,细胞间连接模糊,密度减低。上述发现提示经H2O2干预后,肠单层上皮屏障细胞间结构和功能均遭到破坏。
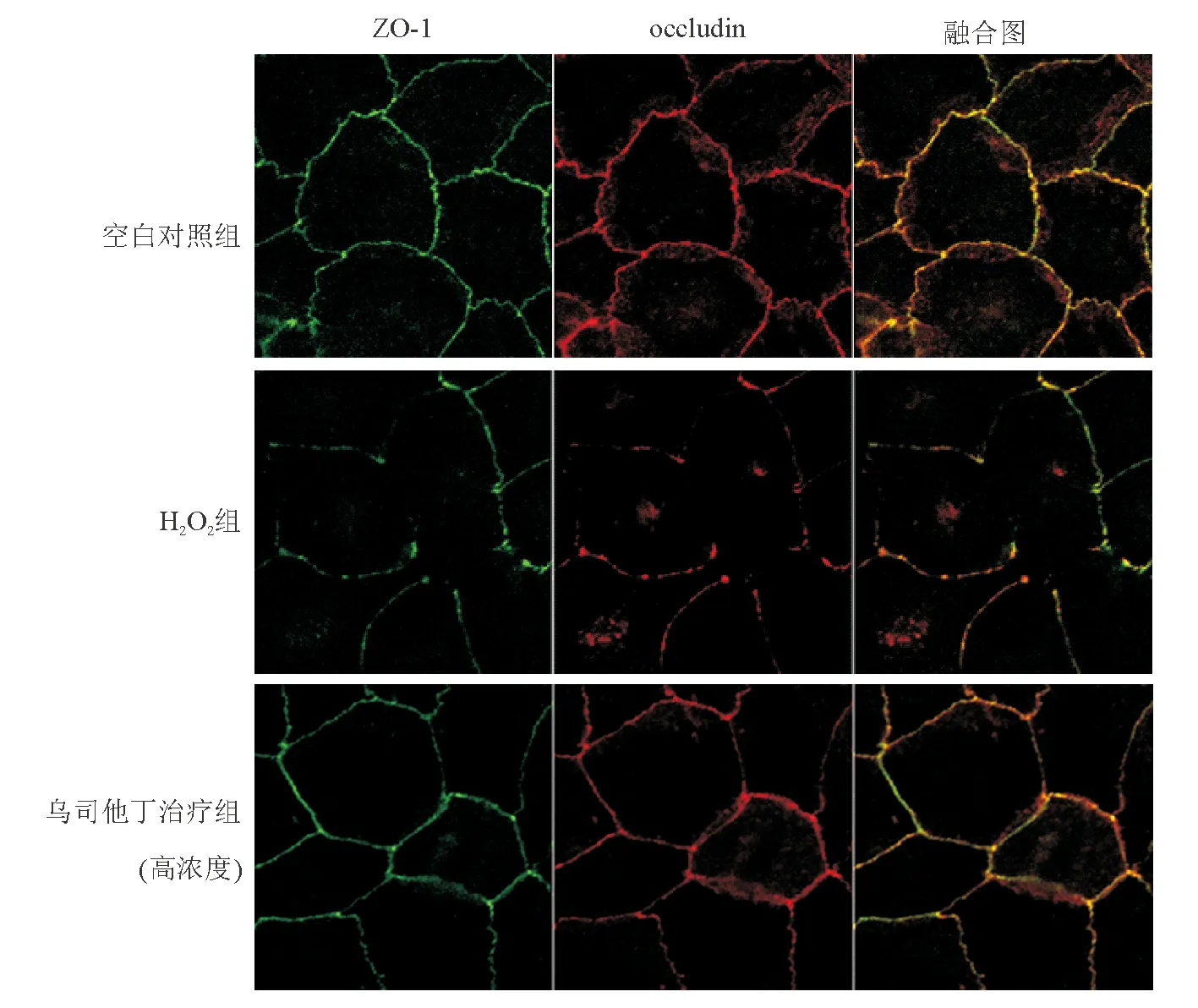
图3 各组Caco-2细胞单层上皮ZO-1、occludin蛋白表达和分布(免疫荧光法,×400)
乌司他丁是从尿液中分离纯化的广谱胰蛋白酶抑制剂,是人体内源性抗炎物质之一,临床上广泛应用于急性胰腺炎、慢性复发性胰腺炎的治疗[10],并可作为急性循环衰竭的抢救辅助用药。此外,乌司他丁还被尝试用于治疗急性肝衰竭、急性肺损伤等疾病[11-12]。一系列研究表明,乌司他丁具有抗氧化作用,可抑制氧自由基产生,增加SOD活性,亦可抑制多种蛋白水解酶活性,改善机体微循环状态,稳定溶酶体膜,改善Kupffer细胞功能,抑制多种细胞因子和炎症介质产生,保护肠黏膜屏障以及肝肾、心肺等重要脏器功能[11,13-15],但国内尚未见关于乌司他丁对紧密连接蛋白影响的报道。本研究结果显示,乌司他丁可显著改善H2O2干预所致的Caco-2细胞单层上皮MDA水平升高和SOD活性降低,发挥抗氧化应激作用,同时反映肠单层上皮屏障功能的TEER、荧光素钠透过率以及紧密连接蛋白ZO-1、occludin表达和分布亦明显改善,提示乌司他丁对H2O2诱导的肠单层上皮屏障损伤有一定保护作用,其机制可能与其抗氧化活性以及调节紧密连接蛋白ZO-1、occludin表达和分布有关。鉴于本实验为应用肠单层上皮屏障模型的体外研究,其结果尚需临床研究加以验证,以期对临床肠黏膜屏障保护的用药起到一定指导作用。
1 Tsukita S, Furuse M, Itoh M. Multifunctional strands in tight junctions[J]. Nat Rev Mol Cell Biol, 2001, 2 (4): 285-293.
2 Anderson JM, Van Itallie CM. Tight junctions and the molecular basis for regulation of paracellular permeability[J]. Am J Physiol, 1995, 269 (4 Pt 1): G467-G475.
3 Wang N, Yu H, Ma J, et al. Evidence for tight junction protein disruption in intestinal mucosa of malignant obstructive jaundice patients[J]. Scand J Gastroenterol, 2010, 45 (2): 191-199.
4 Besselink MG, van Santvoort HC, Renooij W, et al; Dutch Acute Pancreatitis Study Group. Intestinal barrier dysfunction in a randomized trial of a specific probiotic composition in acute pancreatitis[J]. Ann Surg, 2009, 250 (5): 712-719.
5 闫勇,尹致良,田伏洲,等. 肠黏膜屏障损害致肠源性内毒素血症[J]. 中华胃肠外科杂志, 1999, 2 (4): 246-247.
6 Wang N, Wang G, Hao J, et al. Curcumin ameliorates hydrogen peroxide-induced epithelial barrier disruption by upregulating heme oxygenase-1 expression in human intestinal epithelial cells[J]. Dig Dis Sci, 2012, 57 (7): 1792-1801.
7 Saitou M, Fujimoto K, Doi Y, et al. Occludin-deficient embryonic stem cells can differentiate into polarized epithelial cells bearing tight junctions[J]. J Cell Biol, 1998, 141 (2): 397-408.
8 Yee S.Invitropermeability across Caco-2 cells (colonic) can predictinvivo(small intestinal) absorption in man -- fact or myth[J]. Pharm Res, 1997, 14 (6): 763-766.
9 Rao RK, Li L, Baker RD, et al. Glutathione oxidation and PTPase inhibition by hydrogen peroxide in Caco-2 cell monolayer[J]. Am J Physiol Gastrointest Liver Physiol, 2000, 279 (2): G332-G340.
10 Liu R, Qi H, Wang J, et al. Ulinastatin activates the renin-angiotensin system to ameliorate the pathophysiology of severe acute pancreatitis[J]. J Gastroenterol Hepatol, 2014, 29 (6): 1328-1337.
11 Lu J, Chen YP, Wan R, et al. Protective effects of ulinastatin on acute liver failure induced by lipopoly-saccharide/D-galactosamine[J]. Dig Dis Sci, 2012, 57 (2): 399-404.
12 Shen J, Gan Z, Zhao J, et al. Ulinastatin reduces pathogenesis of phosgene-induced acute lung injury in rats[J]. Toxicol Ind Health, 2014, 30 (9): 785-793.
13 Li C, Ma D, Chen M, et al. Ulinastatin attenuates LPS-induced human endothelial cells oxidative damage through suppressing JNK/c-Jun signaling pathway[J]. Biochem Biophys Res Commun, 2016, 474 (3): 572-578.
14 赵加应,蔡元坤,程志俭,等. 乌司他丁在梗阻性黄疸时保护肠黏膜屏障功能的实验研究[J]. 中华普通外科杂志, 2007, 22 (4) : 300-301.
15 张福清. 乌司他丁对脓毒症大鼠肠粘膜屏障的影响[D]. 福州: 福建医科大学, 2008.
(2016-09-09收稿;2016-10-13修回)
Protective Effect of Ulinastatin on Hydrogen Peroxide-induced Intestinal Epithelial Barrier Disruption
WANGGai1,WANGZhihua1,DUANHongnian1,XUHuan1,MAJiangtao1,LIUXinhui1,LIUJiaqi1,LINing1,CHANGChunpeng1,HAOJingxia2.
1DepartmentofPICU,BaodingChildren’sHospital,Baoding,HeibeiProvince(071051);2DepartmentofPICU,Children’sHospitalofHebeiProvince,Shijiazhuang
Background: Disruption of tight junctions between intestinal epithelial cells followed by loss of barrier function is crucial for the pathogenesis and progression of a variety of gastrointestinal disorders. Aims: To investigate the protective effect of ulinastatin on hydrogen peroxide (H2O2)-induced intestinal epithelial barrier disruption. Methods: Model of intestinal epithelial monolayer barrier was established with Caco-2 cellsinvitro, and then divided into four groups: blank control group (without any intervention), H2O2group (500 μmol/L H2O2), low-dose (500 U/mL) and high-dose (3 000 U/mL) ulinastatin groups (ulinastatin + H2O2). Level of malondialdehyde (MDA) and activity of superoxide dismutase (SOD) were detected; transepithelial electrical resistance (TEER) and flux of sodium fluorescein were measured to assess the barrier function; expression and localization of two tight junction proteins, ZO-1 and occludin were evaluated by Western blotting and immunofluorescence; ultrastructure of tight junctions was observed by transmission electron microscopy (TEM). Results: Compared with the blank control group, treatment of Caco-2 cell monolayers with H2O2resulted in increase in level of MDA, flux of sodium fluorescein and decrease in activity of SOD, TEER and expressions of ZO-1 and occludin (Pall <0.05). TEM and immunofluorescence showed that the brusher border of Caco-2 cells in H2O2group was destroyed, the cell-cell junction was vague and the localization of ZO-1 and occludin was discontinuous and the fluorescence intensity was extremely low. While in ulinastatin groups, especially the high-dose group, all the indices above-mentioned were significantly improved (Pall <0.05). Conclusions: Ulinastatin protects intestinal epithelial monolayer barrier against H2O2-induced disruption at least partially by its antioxidant activity and modulating expression and localization of tight junction proteins.
Ulinastatin; Hydrogen Peroxide; Intestinal Mucosal Barrier; Epithelial Cells; Tight Junctions
10.3969/j.issn.1008-7125.2017.04.007
*Email: woshiwanggai@163.com

