炎症性肠病血清学抗体的临床意义
朱兰香 陈彦君 严 苏 金月红
苏州大学附属第一医院消化内科(215006)
炎症性肠病血清学抗体的临床意义
朱兰香*陈彦君#严 苏 金月红
苏州大学附属第一医院消化内科(215006)
背景:对于炎症性肠病(IBD),迄今尚无疾病诊断和监测的金标准。鉴于免疫系统在IBD发病中的重要作用,检测血清免疫特异性抗体水平对于IBD的诊断和鉴别诊断可能有一定价值。目的:探讨血清抗酿酒酵母抗体(ASCA)和核周型抗中性粒细胞胞质抗体(pANCA)在IBD中的临床意义。方法:连续纳入2015年2月—2016年5月苏州大学附属第一医院收治的IBD患者91例,其中克罗恩病(CD)52例,溃疡性结肠炎(UC)39例,36例排除IBD的胃肠道疾病患者作为对照组。分别采用ELISA法和间接免疫荧光法检测血清ASCA-IgG、IgA和pANCA。以临床诊断为金标准,采用四格表对ASCA、pANCA进行诊断试验评价;采用ROC曲线、Pearson χ2检验、Fisher精确检验分析两种血清学抗体与IBD、CD、UC以及病变部位的关系。结果:血清ASCA-IgG和IgA均与CD相关(AUC=0.626 和0.614),而UC仅与ASCA-IgA相关(AUC=0.486)。血清pANCA与IBD(r=0.342)、CD(r=-0.262)、UC(r=0.614)均相关,对IBD和UC的诊断敏感性和特异性优于CD(P<0.05)。CD患者的ASCA-IgG与病变累及回肠末端相关(P<0.05),pANCA与病变累及结肠相关(P<0.05);UC患者的ASCA-IgG、IgA均与病变累及回肠末端相关(P<0.05)。结论:血清ASCA、pANCA有助于在IBD诊断确立的基础上区分CD与UC,并可能对病变部位具有提示作用。ASCA可能与病变累及回肠末端相关,而pANCA则可能与病变累及结肠相关。
炎症性肠病; Crohn病; 结肠炎,溃疡性; 抗酿酒酵母抗体; 核周型抗中性粒细胞胞质抗体; 诊断,鉴别
近年来我国炎症性肠病(inflammatory bowel disease, IBD)的发病率呈上升趋势,关于其病因,目前普遍认为是肠道菌群在易感宿主中触发异常免疫反应,引起肠道慢性炎症。鉴于免疫系统在IBD发病中的重要作用,检测血清免疫特异性抗体水平对于IBD的诊断和鉴别诊断可能有一定价值。既往研究提出抗酿酒酵母抗体(anti-Saccharomycescerevisiae antibody, ASCA)和核周型抗中性粒细胞胞质抗体(perinuclear anti-neutrophil cytoplasmic anti-body, pANCA)分别对克罗恩病(Crohn’s disease, CD)和溃疡性结肠炎(ulcerative colitis, UC)有一定的诊断敏感性[1]。本研究旨在进一步探讨血清IgG型、IgA型ASCA和pANCA在IBD中的临床意义。
对象与方法
一、病例来源
连续纳入2015年2月—2016年5月苏州大学附属第一医院消化内科住院和门诊IBD患者91例,其中CD 52例,男性38例,女性14例,平均年龄(38.32±4.51)岁;UC 39例,男性12例,女性27例,平均年龄(36.83±4.52)岁。CD和UC的诊断符合2012年中华医学会消化病学分会IBD学组制订的诊断标准[2]。同期36例排除IBD的其他胃肠道 疾病(慢性非萎缩性胃炎、慢性结肠炎等)患者作 为对照组,男性12例,女性24例,平均年龄(39.75±6.75)岁。
二、方法
1. 标本采集:所有受检者采集晨起空腹静脉血2 mL,离心收集血清。
2. 血清抗体检测:ASCA-IgG、IgA的检测采用ELISA法,pANCA的检测采用间接免疫荧光法,试剂盒为德国欧蒙公司产品。
①ASCA-IgG、IgA:于微孔板各孔中分别加入标准血清(Cal1 200 U/mL、Cal2 20 U/mL、Cal3 2 U/mL)、阳性对照、阴性对照和1∶101稀释的待测血清各100 μL,室温孵育30 min,300 μL洗涤缓冲液洗涤4次;分别于ELISA微孔内加入100 μL HRP标记抗人IgG或IgA抗体,室温孵育30 min,300 μL洗涤缓冲液洗涤4次;加入100 μL底物,避光室温孵育15 min,加入100 μL终止液。以酶标仪(比色波长450 nm,参考波长620 nm)测定吸光度(A)值,以Cal2的A值为界值对结果进行定性分析。ASCA-IgG和(或)IgA阳性判定为ASCA阳性。
②pANCA:取11.1 μL待测血清样本,加入PBS 100 μL,旋涡混合器振荡25 s;取25 μL稀释血清加于反应板上,覆上包被抗原基质的基质片,室温孵育 30 min;基质片以PBS冲洗1 s后浸泡5 min;于清洁加样板的反应区滴加20 μL羊抗人IgG荧光抗体,从PBS中取出基质片,5 s内以吸水纸擦拭,将覆有基质的一面朝下盖在加样板凹槽内,避光孵育30 min;取出基质片,冲洗、浸泡;于盖玻片上滴加甘油/PBS 10 μL,从PBS中取出基质片、擦拭,将覆有基质的一面朝下盖在盖玻片上,荧光显微镜下定性观察,滴度>1∶10 判定为阳性。
三、统计学分析
应用SPSS 21.0统计学软件,以临床诊断为金标准,采用四格表进行诊断试验评价,分别计算ASCA、pANCA在IBD、CD、UC中的敏感性、特异性、阳性预测值(PPV)和阴性预测值(NPV)并作χ2检验。ASCA、pANCA与IBD、CD、UC关系的分析:计数资料ASCA绘制ROC曲线,分析曲线下面积(AUC);计量资料pANCA行Pearson χ2检验、Fisher精确检验。ASCA、pANCA与病变部位关系的分析采用Pearson χ2检验、Fisher精确检验。P<0.05为差异有统计学意义。
结 果
一、ASCA、pANCA诊断试验评价
IBD、CD、UC患者血清ASCA-IgG、ASCA-IgA、pANCA检测阳性例数见表1。四格表分析显示,ASCA在IBD、CD、UC中的敏感性均在40%左右,特异 性分别为88.89%、74.67%和71.59%,提示ASCA对排除非IBD患者有一定意义;而pANCA在UC中的敏感性和特异性相对较高,分别为61.54%和94.32%,提示其为辅助诊断UC的特异性指标(表2)。

表1 IBD、CD、UC患者血清ASCA、pANCA检测阳性例数(n)
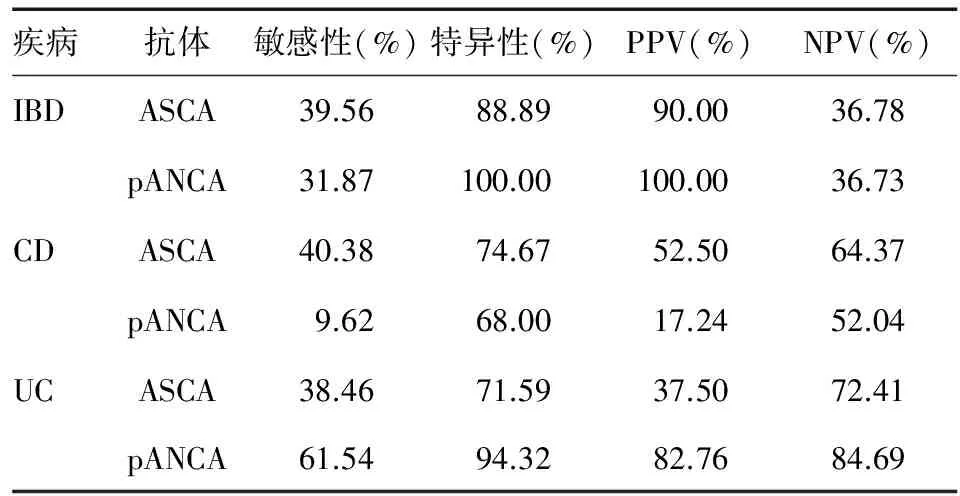
表2 血清ASCA、pANCA诊断试验评价
二、ASCA、pANCA对IBD、CD、UC的诊断意义
血清ASCA-IgG、ASCA-IgA分别诊断IBD、CD、UC的ROC曲线见图1。分析显示,IBD与ASCA-IgG相关(AUC=0.365,P=0.018),UC与ASCA-IgA相关(AUC=0.486,P=0.002),CD与ASCA-IgG(AUC=0.626,P=0.016)和ASCA-IgA(AUC=0.614,P=0.030)均相关。上述发现提示IBD分型与ASCA分型可能相关。
Pearson χ2检验/Fisher精确检验显示,血清pANCA与IBD(r=0.342,P=0.000 082)、CD(r=-0.262,P=0.003)、UC(r=0.614,P=0.000 1)均有一定相关性,其对IBD和UC的诊断敏感性和特异性优于CD(χ2=27.672,P=9.797×10-7)。
三、ASCA、pANCA对IBD病变部位的提示作用
结合蒙特利尔分型[2]对本组CD和UC患者的病变部位进行分类:CD分为较多累及回肠末端型(L1/L4)和较多累及结肠型(L2/L3),L1/L4和L2/L3型分别为23例和29例;UC分为仅累及远端结肠型(E1/E2)和较多累及结肠和回肠末端型(E3),E1/E2和E3型分别为24例和15例。
19例血清ASCA-IgG阳性CD患者中12例为累及回肠末端型(L1/L4),Pearson χ2检验/Fisher精确检验显示,CD患者的ASCA-IgG与病变累及回肠末端相关(χ2=4.348,P=0.036)。5例血清pANCA阳性CD患者均为累及结肠型(L2/L3),Pearson χ2检验/Fisher精确检验显示,CD患者的pANCA与病变累及结肠相关(χ2=4.387,P=0.046)(表3)。
12例血清ASCA-IgG阳性UC患者中9例为累及回肠末端型(E3),6例血清ASCA-IgA阳性UC患者 均为累及回肠末端型(E3),Pearson χ2检验/Fisher精确检验显示,UC患者的ASCA与病变累及回肠末端相关(ASCA-IgG: χ2=9.777,P=0.003; ASCA-IgA: χ2=11.345,P=0.002)(表3)。
讨 论
对于IBD,迄今尚无疾病诊断和监测的金标准。临床实践中,CD与UC的鉴别有一定难度,特别是在患者的临床表现、内镜和病理特征不典型或有疑惑时,而一些血清生物学标记物如免疫特异性抗体可能有助于部分解决这一问题[3]。
ASCA是针对酿酒酵母菌细胞壁磷肽甘露聚糖的抗体,在部分CD患者的血清中特异性升高[4],肠内细菌的胞壁成分与酿酒酵母菌胞壁甘露聚糖成分同源。ASCA有IgG和IgA两种免疫球蛋白亚型。
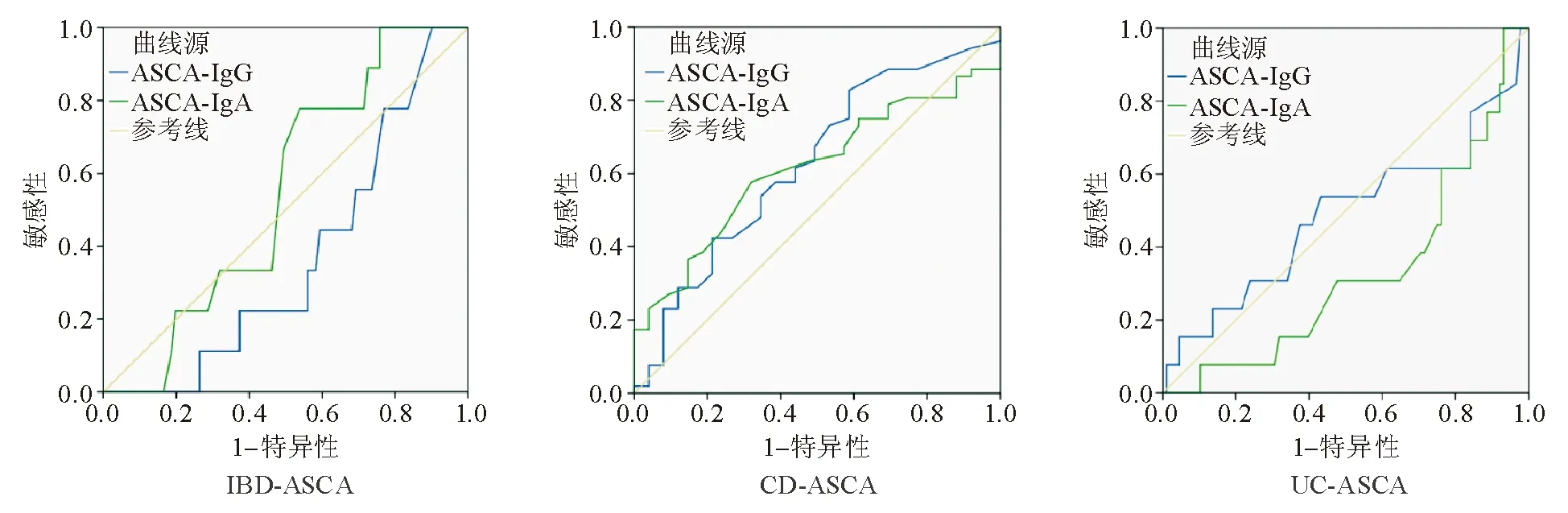
图1 血清ASCA诊断IBD、CD、UC的ROC曲线
表3 血清ASCA、pANCA对IBD病变部位的提示作用

抗体CD(n)L1/L4L2/L3Pearsonχ2Fisher单侧P值UC(n)E1/E2E3Pearsonχ2Fisher单侧P值ASCA⁃IgG1274.3480.036399.7770.003ASCA⁃IgA632.2210.1310611.3450.002pANCA054.3870.04612123.5100.061
本研究以临床诊断为金标准,对血清ASCA进行诊断试验评价,结果显示其在IBD、CD、UC中的敏感性均较低(约40%),特异性为71.59%~88.89%。ROC曲线分析显示ASCA与IBD、CD、UC均相关,具体表现为ASCA-IgG与IBD相关,ASCA-IgA与UC相关,两类抗体均与CD相关,提示IBD分型与ASCA分型可能相关。国内样本量较大的病例对照研究均显示ASCA对CD的敏感性较低,与本研究结果一致[5-7]。有研究显示CD患者的父母以及一级亲属血清ASCA水平升高,可能与CD相关NOD2基因突变有关[8],表明ASCA是有罹患CD倾向者免疫系统过度应答的血清学表现形式。
50%~80%的UC患者外周血中可检出ANCA,UC相关ANCA在乙醇固定的中性粒细胞中呈核周染色形式,即pANCA[9]。pANCA系由肠黏膜B细胞所产生,以中性粒细胞和单核细胞胞质成分为抗原,可作用于毛细血管中的中性粒细胞、单核细胞和肠上皮细胞,引起溶菌酶释放,导致大面积血管和肠组织损害[10-12]。本研究中血清pANCA对UC的敏感性和特异性分别为61.54%和94.32%,敏感性与国内同类研究接近(54.7%~56.7%[5-7])。国外研究中pANCA在UC中的阳性率/敏感性亦均在55%~60%[12-14],但也有超过65%者[15]。本研究结果显示pANCA在CD中的诊断价值显著低于UC和IBD,其与UC相关性最强(r=0.614),其次为IBD(r=0.342),与CD相关性最弱(r=-0.262),提示pANCA可在IBD诊断确立后UC与CD的鉴别中发挥作用,为UC特异性血清学标记物。
本研究相关性分析还显示,CD患者的ASCA-IgG与病变累及回肠末端相关,pANCA与病变累及结肠相关,而UC患者的ASCA-IgG、IgA均与病变累及回肠末端相关。既往研究亦表明累及回肠末端型CD(L1/L4)血清ASCA多为阳性,UC反向累及回肠(E3)时,ASCA亦可呈阳性,而累及结肠的CD(L2/L3)ASCA阳性率较低[3,8]。上述相关性可能与肠道局部免疫、食物抗原以及肠道菌群的变化有关。
IBD遗传易感个体的机体免疫机制缺乏规律性,先天免疫敏感性以及肠道共生细菌的再激活可能激活一系列炎症反应通路,导致大量炎症因子释放,炎症细胞激活,血液中的淋巴细胞、炎症性白细胞和单核细胞募集至肠道。回肠肠壁较薄,管径较小,肠系膜内血管弓多、直血管短,有大量孤立和集合淋巴滤泡,且多见于回肠下段,是肠道局部免疫应答的重要场所。而结肠内除与动静脉伴行的淋巴系统外,并无此种特殊的淋巴滤泡,免疫应答潜能较回肠弱。因此,累及回肠的病变可能释放更多炎症因子,共生细菌再激活程度加剧,细菌胞壁中与ASCA针对的酿酒酵母菌胞壁甘露聚糖同源的成分相应增多。ASCA可能是对菌体本身的抗原反应所致,也可能是由目前尚未被鉴定的交叉抗原所引起[16]。而ANCA是一组以中性粒细胞和单核细胞胞质成分为抗原的自身抗体,根据免疫荧光检测时的分布可分为胞质型(cANCA)、斑点型(sANCA)和核周型(pANCA)。目前观点认为ANCA只是免疫调节紊乱的标志,可能与感染相关[10-12]。与回肠相比,结肠更易暴露于外界病原体,引发局部炎症反应,故结肠病变pANCA表达增多。
肠道部位不同,抗原种类不同,相应抗体亦存在差异。小肠内以食物抗原为主,激活肠黏膜异常免疫应答,淋巴细胞聚集,ASCA表达增加。胃肠道内细菌数量从胃至结肠呈递增趋势,结肠内细菌数量达到最高水平[17],因此结肠内以细菌抗原为主。pANCA能识别结肠细菌表位和肥大细胞胞质抗原,对共生微生物产生异常免疫应答[10-12],因此在结肠炎症时表达增加。此外,不同肠道部位菌群构成的差异亦可能影响ASCA、pANCA表达水平。小肠菌群的构成介于胃与结肠之间,近端与胃相近,能分离出大肠杆菌和厌氧菌;远端则与结肠相近,大肠杆菌恒定存在,厌氧菌如类杆菌属、双歧杆菌属、梭状芽孢杆菌属亦有相当数量。不同菌群种类所含抗原成分的差异导致相应抗体表达水平的差异。确切机制有待进一步研究。
综上所述,本研究发现IBD分型与ASCA分型可能相关,而pANCA在UC中的诊断价值高于CD,因此这两个血清学抗体有助于在IBD诊断确立的基础上区分CD与UC。更为重要的是,本研究发现血清ASCA、pANCA可能对IBD病变部位具有提示作用。血清ASCA-IgG与CD病变累及回肠末端相关,UC反向累及回肠时,ASCA-IgG、IgA亦可呈阳性,提示ASCA可能与IBD病变累及回肠末端相关,而血清pANCA则可能与病变累及结肠相关。上述相关性有待进一步研究证实,目前仅依靠血清学抗体检测仍难以鉴别结肠型CD(L2/L3)与累及回肠末端的UC(E3)。
1 钱家鸣,杨红. 中国炎症性肠病研究现状和进展[J]. 中华消化杂志, 2016, 36 (7): 433-436.
2 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年·广州)[J]. 胃肠病学, 2012, 17 (12): 763-781.
3 Rogler G, Biedermann L. Clinical Utility of Biomarkers in IBD[J]. Curr Gastroenterol Rep, 2015, 17 (7): 26.
4 Sendid B, Colombel JF, Jacquinot PM, et al. Specific antibody response to oligomannosidic epitopes in Crohn’s disease[J]. Clin Diagn Lab Immunol, 1996, 3 (2): 219-226.
5 李慕然,刘艳迪,郑晓莉,等. 血清学抗体检测对炎症性肠病的诊断价值[J/CD]. 中华临床医师杂志(电子版), 2013, 7 (6): 97-100.
6 李骥,吕红,钱家鸣,等. 抗酿酒酵母抗体和抗中性粒细胞胞质抗体对炎症性肠病的诊断价值[J]. 中华消化杂志, 2008, 28 (10): 666-668.
7 张蜀澜,李永哲,李磊,等. 联合检测炎症性肠病患者抗酿酒酵母细胞抗体和抗中性粒细胞抗体的临床意义[J]. 中华检验医学杂志, 2008, 31 (10): 1142-1146.
8 Schoepfer AM, Schaffer T, Mueller S, et al. Phenotypic associations of Crohn’s disease with antibodies to flagellins A4-Fla2 and Fla-X, ASCA, p-ANCA, PAB, and NOD2 mutations in a Swiss Cohort[J]. Inflamm Bowel Dis, 2009, 15 (9): 1358-1367.
9 Vidrich A, Lee J, James E, et al. Segregation of pANCA antigenic recognition by DNase treatment of neutrophils: ulcerative colitis, type 1 autoimmune hepatitis, and primary sclerosing cholangitis[J]. J Clin Immunol, 1995, 15 (6): 293-299.
10 Collins CE, Rampton DS, Rogers J, et al. Platelet aggregation and neutrophil sequestration in the mesenteric circulation in inflammatory bowel disease[J]. Eur J Gastroenterol Hepatol, 1997, 9 (12): 1213-1217.
11 Israeli E, Grotto I, Gilburd B, et al. Anti-Saccharomycescerevisiaeand antineutrophil cytoplasmic antibodies as predictors of inflammatory bowel disease[J]. Gut, 2005, 54 (9): 1232-1236.
12 Reese GE, Constantinides VA, Simillis C, et al. Diagnostic precision of anti-Saccharomycescerevisiaeantibodies and perinuclear antineutrophil cytoplasmic antibodies in inflammatory bowel disease[J]. Am J Gastroenterol, 2006, 101 (10): 2410-2422.
13 Bernstein CN, El-Gabalawy H, Sargent M, et al. Assessing inflammatory bowel disease-associated antibodies in Caucasian and First Nations cohorts[J]. Can J Gastroenterol, 2011, 25 (5): 269-273.
14 Rump JA, Schölmerich J, Gross V, et al. A new type of perinuclear anti-neutrophil cytoplasmic antibody (p-ANCA) in active ulcerative colitis but not in Crohn’s disease[J]. Immunobiology, 1990, 181 (4-5): 406-413.
15 Koutroubakis IE, Petinaki E, Mouzas IA, et al. Anti-Saccharomycescerevisiaemannan antibodies and antineutrophil cytoplasmic autoantibodies in Greek patients with inflammatory bowel disease[J]. Am J Gastroenterol, 2001, 96 (2): 449-454.
16 郑家驹,皇甫照. 酿酒酵母菌抗体(ASCA)与克罗恩病[J]. 现代消化及介入诊疗, 2004, 9 (4): 189-191.
17 迟雁. 肠道微生态与炎症性肠病[J]. 临床荟萃, 2016, 31 (8): 857-860.
(2016-10-06收稿;2016-12-17修回)
Clinical Significance of Serum Antibodies in Inflammatory Bowel Disease
ZHULanxiang,CHENYanjun,YANSu,JINYuehong.
DepartmentofGastroenterology,theFirstAffiliatedHospitalofSoochowUniversity,Suzhou,JiangsuProvince(215006)
CHEN Yanjun, Email: 614695437@qq.com
Inflammatory Bowel Disease; Crohn Disease; Colitis, Ulcerative; Anti-SaccharomycescerevisiaeAntibody; Perinuclear Anti-Neutrophil Cytoplasmic Antibody; Diagnosis, Differential
10.3969/j.issn.1008-7125.2017.04.009
*Email: zhulanxiang0125@163.com
#本文通信作者,Email: 614695437@qq.com
Background: There is no gold standard for the diagnosis and monitoring of inflammatory bowel disease (IBD). As immune system plays crucial role in the pathogenesis of IBD, some immune-specific serum antibodies are considered to be useful tools for the diagnosis and differential diagnosis of the disease. Aims: To investigate the clinical significance of serum antibodies, including anti-Saccharomycescerevisiaeantibody (ASCA) and perinuclear anti-neutrophil cytoplasmic antibody (pANCA) in IBD. Methods: Serum samples were obtained from 91 consecutive IBD patients from Feb. 2015 to May 2016 at the First Affiliated Hospital of Soochow University. Of them, 52 were Crohn’s disease (CD) and 39 were ulcerative colitis (UC). Serum samples of 36 non-IBD patients were served as controls. ASCA-IgG and ASCA-IgA were detected by ELISA, and pANCA by indirect immunofluorescence assay. Using clinical diagnosis as gold standard, crosstabs statistics was performed to measure the diagnostic accuracy of ASCA and pANCA, and ROC curve, Pearson Chi-square test and Fisher’s exact test were employed for analyzing the correlations of these two serum antibodies with IBD, CD, UC, and the location of the disease. Results: Both serum ASCA-IgG and IgA were correlated with CD (AUC=0.626 and 0.614), while UC was correlated with ASCA-IgA only (AUC=0.486). Serum pANCA had relevance to IBD (r=0.342), CD (r=-0.262) and UC (r=0.614); its sensitivity and specificity for IBD and UC were superior to those for CD (P<0.05). In CD patients, ASCA-IgG was associated with terminal ileal disease (P<0.05), and pANCA was associated with colonic involvement (P<0.05). In UC patients, both ASCA-IgG and IgA were correlated with terminal ileal disease (P<0.05). Conclusions: Serum ASCA and pANCA may be helpful for discrimination between CD and UC when the diagnosis of IBD is established. Furthermore, they are closely associated with the disease location, ASCA is related with the terminal ileal disease and pANCA is related with colonic involvement.

