小檗碱对铜绿假单胞菌密度感应缺陷株及其分泌的致病因子的作用研究*
夏 飞, 肖红兵, 杜 鸣, 廖亚玲, 张明伟, 王 平
1湖北省第三人民医院药学部,武汉 4300332湖北省武汉市黄陂区蔡店街道卫生院,武汉 4303233湖北省武汉市第一医院汉西分院,武汉 430022
小檗碱对铜绿假单胞菌密度感应缺陷株及其分泌的致病因子的作用研究*
夏 飞1, 肖红兵2, 杜 鸣1, 廖亚玲1, 张明伟1, 王 平3△
1湖北省第三人民医院药学部,武汉 4300332湖北省武汉市黄陂区蔡店街道卫生院,武汉 4303233湖北省武汉市第一医院汉西分院,武汉 430022
目的 观察小檗碱对铜绿假单胞菌(Pseudomonasaeruginosa,PA)密度感应缺陷株的生长及其分泌的致病因子的影响,初步探索小檗碱对铜绿假单胞菌密度感应系统及调控致病因子表达的作用机制。方法 不同浓度小檗碱分别与铜绿假单胞菌野生株PAO1、密度感应系统(quorum sensing system,QS)基因缺陷株PAO JP2、临床分离QS缺陷株共培养,运用倍比稀释法测定最小抑菌浓度,紫外分光光度法测定绿脓菌素分泌量,苔黑酚法测定鼠李糖脂水平,结晶紫法测定生物被膜起始量,荧光定量PCR检测各株QS基因表达。结果 小檗碱对铜绿假单胞菌野生株PAO1 MIC值为12.50 mg/mL,临床分离株C84 MIC值为1.56 mg/mL,PAO JP2株与C39株MIC值均为3.12 mg/mL,C104和C117株MIC值均为6.25 mg/mL。在低于MIC浓度下,小檗碱对PAO1株、C104株、C117株绿脓菌素水平有显著抑制,且对各QS缺陷株鼠李糖脂有不同程度抑制作用。此外,PAO JP2株、C39株、C84株生物被膜可被小檗碱显著抑制。各株残留的LasR和rhI转录均受到小檗碱显著抑制。结论 小檗碱对临床分离QS缺陷株有良好的抑制作用,可能通过调节QS基因多种不同细菌毒力因子进行调控。
铜绿假单胞菌; 小檗碱; 密度感应缺陷; 致病因子
铜绿假单胞菌(Pseudomonasaeruginosa,PA)是临床常见人体定植菌,可在机体抵抗力低下时诱发感染[1]。该菌对多种抗生素具有天然耐药能力,使得临床抗感染治疗面临巨大风险,轻者病情迁延不愈,重者发生肺囊性纤维化直至死亡[2]。该菌还有多种致病因子,包括胞外蛋白酶、酯酶、毒素、鞭毛和菌毛等[3]。近年来研究发现,铜绿假单胞菌耐药与该菌密度感应系统(quorum sensing system,QS)调控相关[4]。这使对铜绿假单胞菌的防治有了新的可能,即通过干扰密度感应系统抑制细菌耐药与减弱细菌毒力和侵袭力[5-6],然而临床上仍然有一部分从铜绿假单胞菌感染病例中分离的菌株为QS缺陷株[7],这表明该菌致病力的调控方面还有很多未为人知。本课题组在前期研究中发现黄连有效成分小檗碱对野生铜绿假单胞菌PAO1株具有杀菌或抑制作用,且对致病因子具有负调控作用[7-8]。故在前期研究基础上,为进一步探讨小檗碱对QS系统的干预作用及机制,本研究以临床分离的QS功能缺陷菌株为对象,研究小檗碱对QS功能缺陷株的影响,以期丰富中药活性成分对细菌密度感应系统调控的干预机制。
1 材料与方法
1.1 实验材料
1.1.1 实验用菌株及药物 野生菌株PAO1和QS基因缺陷株PAO JP2为湖北省第三人民医院实验室保存。QS功能缺陷株C39、C84、C104、C117为前期研究分离与保存[7],菌株特性见表1。实验前3 d,取上述保存于-80℃菌株快速解冻,取菌液接种于琼脂平板,48 h后挑取生长良好的菌落于LB培养液37℃ 150 r/min培养过夜,取适量菌液用LB培养液稀释至A600 nm0.6备用。小檗碱(西安沃森生物科技有限公司,批号:20140619),纯度98%。

表1 实验用铜绿假单胞菌菌株QS基因与生物学特性
1.1.2 实验试剂 刚果红弹性蛋白(美国Sigma公司,批号:108K3575);0.2 mol/L盐酸溶液;10 mmol/L Na2HPO4溶液;酵母提取物(Oxoid LP0021,批号:1606468);胰蛋白胨(OxiA LP0042,批号:1658785);氯化钠(国药集团化学试剂有限公司,批号:20121022)。
1.1.3 实验仪器 紫外分光光度计(HITACH U-2900、Amersham Genequant pro);生物安全柜(苏州安泰,BHC-1300ⅡA/B3);小型台式高速离心机(Eppendorf,5415D);低温高速离心机(长沙湘仪离心机仪器有限公司,H2050R);台式恒温振荡器(太仓华美生化仪器厂,THZ-C);电热恒温培养箱(上海新苗医疗器械制造有限公司,DNP-9272BS-Ⅲ);荧光定量PCR仪(Life Technologies,ABI 7500 Fast)。
1.2 实验方法
1.2.1 最小抑菌浓度测定 根据前期研究结果采取微量倍比稀释法将小檗碱稀释为0.39~25 mg/mL浓度梯度。阴性对照组加入2 mL LB培养液。取新鲜菌液稀释至A600 nm0.6,每管加入0.1 mL。混匀后置恒温振荡摇床37℃、150 r/min培养18 h;观察每孔细菌生长情况,以最低无可见细菌生长浓度为最小抑菌浓度(minimum inhibitory concentrations,MIC)。随后10 000 r/min离心细菌悬液1 min,分离细菌沉淀与上清。向沉淀中加入2 mL 0.85% NaCl溶液(含0.1%吐温80),反复吹吸后,转移至振荡仪振荡2 min,测定菌液吸光度值A600 nm。设立PAO1阳性对照和不加小檗碱的各分离株平行对照。实验重复3次,取平均值。根据MIC值,选择最接近MIC的亚MICs浓度开展下列实验。
1.2.2 绿脓菌素测定 收集实验组、对照组培养上清,加入2 mL氯仿充分振荡,静置分层后分离下层溶液。取下层液体加入0.2 mol /L HCl 0.8 mL并充分振荡后静置,分离上层液体以16 000 g离心2 min,取上清测定A520 nm值[9]。实验重复3次,取平均值。
1.2.3 鼠李糖脂测定 采用苔黑酚法Ⅲ测定鼠李糖脂水平[10],取上述各组培养上清1 mL加入乙醚振荡后冻干抽提。抽提物加入0.5 mL双蒸水定容,取100 μL溶液加入900 μL苔黑酚中(含53% H2SO4,V/V),置80℃加热30 min后,冷却至室温,并测量A421 nm值,所得值代入函数关系式中计算鼠李糖含量,并以1 g鼠李糖=2.5 g鼠李糖脂计算。实验重复3次,取平均值。
1.2.4 生物被膜起始量测定 准备1.5 cm长硅胶管高压灭菌后置玻管内,加入A600 nm值为0.6的新鲜菌液3 mL,分别加入上述浓度药液1 mL,37℃静置培养。培养到期后取出硅胶管转移至空白玻管内用蒸馏水清洗残留浮游菌3次,用1%结晶紫室温孵育15 min,用蒸馏水清洗3次后加入3 mL 95%乙醇洗涤,测定洗涤液A540 nm值。实验重复3次,取平均值。
1.2.5 实时荧光定量PCR 根据细菌生长实验和弹性蛋白酶实验,选取适宜浓度进行实时荧光定量PCR检测QS基因表达。结果以2-ΔΔCt计算相对表达量,每个实验组重复3次计算统计量。Primer 5.0软件设计引物并委托上海英骏生物技术有限公司合成,见表2。
1.3 统计学方法
2 结果
2.1 小檗碱对临床分离株的最小抑菌浓度的检测结果
本实验测定了小檗碱对临床分离铜绿假单胞菌
QS功能缺陷株的最小抑菌浓度(MIC),结果见表3。小檗碱对野生株PAO1最低抑菌浓度为12.50 mg/mL,PAO JP2和C39株MIC值均为3.12 mg/mL,C104和C117株MIC值均为6.25 mg/mL。C84株MIC值为1.56 mg/mL,在各QS功能缺陷株中为最低。

表2 RT-PCR引物设计

表3 临床分离铜绿假单胞菌QS缺陷株对小檗碱最小抑菌浓度±s,n=3)
2.2 小檗碱对临床分离QS缺陷株绿脓菌素分泌水平的影响
选取各菌株的首个亚MICs梯度观察其受QS调控的致病因子表达水平的变化。结果如图1所示,C104和C117株的对照组绿脓菌素水平较PAO1株对照无明显变化,而实验组PAO1株、C104株、C117株绿脓菌素水平较对照均有显著降低(均P<0.05)。PAO JP2株、C39株、C84株几乎不表达绿脓菌素(图1B~D),这与我们前期研究结果一致[8]。
2.3 小檗碱对临床分离QS缺陷株鼠李糖脂的影响
继续观察上述条件下铜绿假单胞菌分泌鼠李糖脂的水平变化。结果如图2所示,PAO1 JP2菌株几乎不产生鼠李糖脂(图2B),各QS功能缺陷株对照组分泌鼠李糖脂的水平介于PAO1和PAO JP2之间(图2C~F)。小檗碱实验组中,PAO1、C39、C84、C104、C107株分泌鼠李糖脂水平分别较对照组有显著降低(均P<0.05)。
2.4 小檗碱对临床分离QS缺陷株生物被膜起始量的影响
结果如图3A所示,PAO1菌株在6.25 mg/mL小檗碱作用下,生物被膜起始量受到显著抑制(P<0.05)。PAO JP2菌株生物被膜起始量亦明显低于野生株PAO1株(图3A~B);其余临床分离株生物被膜起始量同样明显低于野生株PAO1株(图3A,3C~F)。在低于MICs浓度条件下,小檗碱作用于临床分离菌株C39和C84的生物被膜起始量较对照组有显著降低(P<0.05),而C104和C117无显著下降。

A:PAO1组;B:PAO JP2组;C:C39组;D:C84组;E:C104组;F:C117组;与同组对照比较,*P<0.05图1 小檗碱对铜绿假单胞菌QS缺陷株分泌绿脓菌素的影响(n=3)Fig.1 Effects of berberine on the pyocyanin levels of clinically isolated QS-deficient P.aeruginosa strains(n=3)
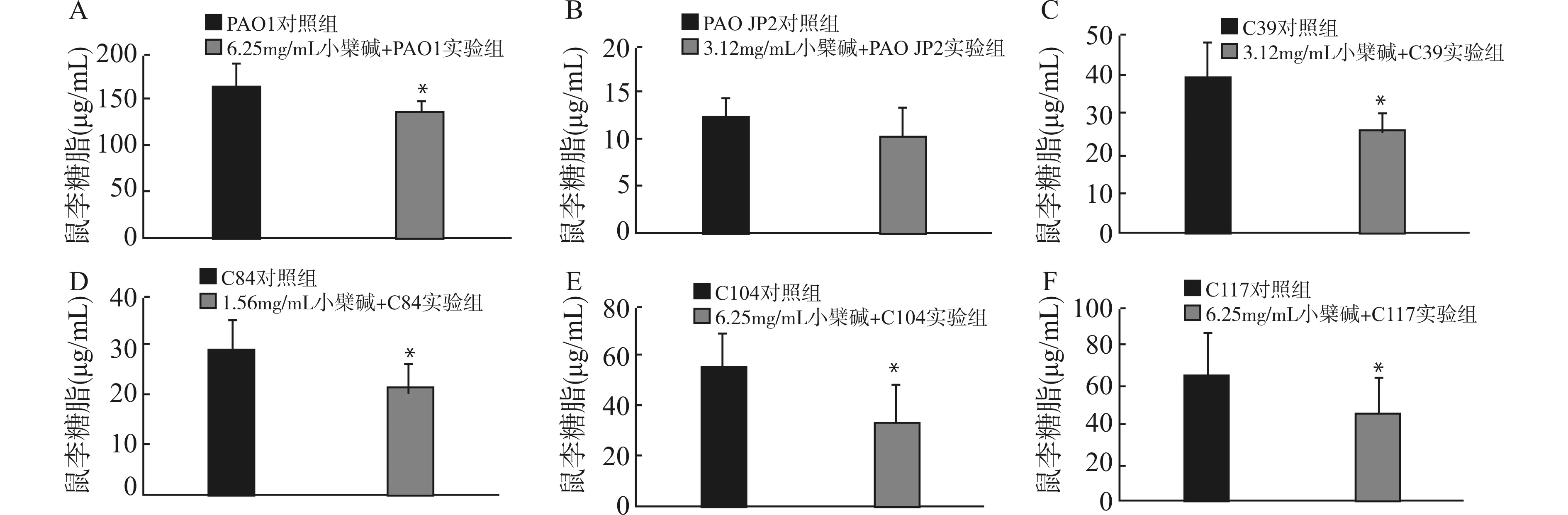
A:PAO1组;B:PAO JP2组;C:C39组;D:C84组;E:C104组;F:C117组;与同组对照比较,*P<0.05图2 小檗碱对铜绿假单胞菌QS缺陷株分泌鼠李糖脂的影响(n=3)Fig.2 Effects of berberine on rhamnolipid secretion by the clinically isolated QS-deficient P.aeruginosa strains(n=3)

A:PAO1组;B:PAO JP2组;C:C39组;D:C84组;E:C104组;F:C117组;与同组对照比较,*P<0.05图3 小檗碱对铜绿假单胞菌生物被膜形成的影响(n=3)Fig.3 Effect of berberine on the biofilm forming ability of P.aeruginosa strains(n=3)
2.5 小檗碱对临床分离QS缺陷株密度感应系统表达的影响
在6株QS缺陷株中,各株实验组QS基因的相对表达量较各株对照均有不同程度降低。其中,LasR基因,即编码Las系统信号分子受体的基因在所有保留有LasR的菌株中均有显著抑制(均P<0.05),包括JP2、C39、C104、C117(图4A~C、E)。与之对应的是,在仅有rh1I保留的C84株中,rh1I相对表达量有显著下降(图4D)(P<0.05)。其余各菌株LasI、rh1R相对表达量虽没有明显统计学差异,但均呈下降趋势。

A:PAO JP2组;B:C39组;C:C104组;D:C84组;E:C117组图4 小檗碱对铜绿假单胞菌QS基因相对表达量的影响(n=3)Fig.4 Effect of berberine on the mRNA level of QS gene in P.aeruginosa strains(n=3)
3 讨论
截止目前,已发现铜绿假单胞菌密度感应系统是由3个不同的子系统组成,包括Las系统、rhl系统、PQS系统。研究认为这3个子系统参与调控的基因约占铜绿假单胞菌全基因的4% ~12%[4,11]。其中,Las系统和rhl系统是以N-乙酰高丝氨酸内酯(N-acyl homoserine lactones,AHLs)作为信号分子,分别为3-O-C12-HSL和C4-HSL[12];PQS系统则利用喹诺酮信号(Pseudomonas quinolone signal,PQS)完成密度感应调控[13]。QS系统编码并表达相应的信号分子和受体,并以信号分子-受体复合物调控下游致病基因表达,此外各子系统间还呈现级联调控和越级调控特征[1,14]。故铜绿假单胞菌的QS信号通路被认为是一套有效而复杂的调控机制。
本研究首先发现QS系统缺失或突变会降低小檗碱环境下的细菌MICs,即有助于提高小檗碱对临床分离株的体外抑菌效果。然而在小檗碱环境中,PAO JP2、C39、C84株绿脓菌素的表达水平无显著变化,这进一步表明该致病因子主要是受LasI和rhlI调控。故此二种基因发生缺失或缺陷后,绿脓菌素便无法表达,使得小檗碱未能对此3种菌株绿脓菌素产生抑制作用;而在C104和C117株中,仅有rhlI缺陷,故绿脓菌素水平的降低可能是受小檗碱对其余QS基因负调控的影响,特别是抑制LasI。对于鼠李糖脂,小檗碱未显示出对PAO JP2株鼠李糖脂的负调控作用,提示鼠李糖脂的合成受LasI和rhlI的共同调控,即LasI和rhlI同时发生缺失或缺陷后,细菌便失去生成鼠李糖脂的能力。各临床分离株鼠李糖脂水平均高于PAO JP2株,一方面符合各临床分离株均未同时发生LasI和rhlI缺失或突变的特征;另一方面表明小檗碱可对QS缺陷株保留的多个QS基因产生负调控作用,如LasI和rhlI。与以上结果相异的是,小檗碱对各菌株生物被膜形成能力均有抑制作用,提示生物被膜的形成除有多种QS基因调控外,还有其他受小檗碱负调控的基因参与此过程。值得注意的是,在小檗碱环境中,4种QS基因的相对表达量均有不同程度降低,其中LasR和rhlI呈现显著性降低,提示小檗碱对此2种基因转录的干预程度较LasI和rhl R显著。但并不排除小檗碱对其余基因的潜在抑制作用,相关机制有待我们进一步研究。
综上所述,将小檗碱作为干预因素,利用铜绿假单胞菌野生株PAO1、双缺陷株PAO JP2及4种临床QS缺陷株为对象初步探索了QS基因对不同致病因子的干预作用。初步发现小檗碱对QS功能缺陷株不同致病因子的调控模式不尽相同。这为深入开展铜绿假单胞菌QS系统调控模式的基础研究与中药抗感染的临床研究提供了新的研究方向与模式。
[1] Lee J,Zhang L.The hierarchy quorum sensing network in Pseudomonas aeruginosa[J].Protein Cell,2015,6(1):26-41.
[2] Luo J,Kong J L,Dong B Y,et al.Baicalein attenuates the quorum sensing-controlled virulence factors of Pseudomonas aeruginosa and relieves the inflammatory response in P.aeruginosa-infected macrophages by downregulating the MAPK and NFkappaB signal-transduction pathways[J].Drug Des Devel Ther,2016,10:183-203.
[3] Smith R S,Iglewski B H.P.aeruginosa quorum-sensing systems and virulence[J].Curr Opin Microbiol,2003,6(1):56-60.
[4] Wagner V E,Bushnell D,Passador L,et al.Microarray analysis of Pseudomonas aeruginosa quorum-sensing regulons:effects of growth phase and environment[J].J Bacteriol,2003,185(7):2080-2095.
[5] Scutera S,Zucca M,Savoia D.Novel approaches for the design and discovery of quorum-sensing inhibitors[J].Expert Opin Drug Discov,2014,9(4):353-366.
[6] Clatworthy A E,Pierson E,Hung D T.Targeting virulence:a new paradigm for antimicrobial therapy[J].Nat Chem Biol,2007,3(9):541-548.
[7] 王平,程彪,吴立明,等.临床分离铜绿假单胞菌密度感应缺陷株致病性分析[J].华中科技大学学报:医学版,2011,40(1):104-108.
[8] 王平,夏飞,贺立群,等.黄连提取物及小檗碱对铜绿假单胞菌密度感应系统的影响[J].华中科技大学学报:医学版,2015(6):686-690.
[9] 王平,夏飞,叶丽华,等.三七对铜绿假单胞菌密度感应相关毒力因子表达的影响[J].中国中医药科技,2013,20(5):479-481.
[10] Pearson J P,Pesci E C,Iglewski B H.Roles of Pseudomonas aeruginosa las and rhl quorum-sensing systems in control of elastase and rhamnolipid biosynthesis genes[J].J Bacteriol,1997,179(18):5756-5767.
[11] Schuster M,Lostroh C P,Ogi T,et al.Identification,timing,and signal specificity of Pseudomonas aeruginosa quorum-controlled genes:a transcriptome analysis[J].J Bacteriol,2003,185(7):2066-2079.
[12] Fuqua W C,Winans S C,Greenberg E P.Quorum sensing in bacteria:the LuxR-LuxI family of cell density-responsive transcriptional regulators[J].J Bacteriol,1994,176(2):269-275.
[13] Mcgrath S,Wade D S,Pesci E C.Dueling quorum sensing systems in Pseudomonas aeruginosa control the production of the Pseudomonas quinolone signal(PQS)[J].FEMS Microbiol Lett,2004,230(1):27-34.
[14] Diggle S P,Winzer K,Chhabra S R,et al.The Pseudomonas aeruginosa quinolone signal molecule overcomes the cell density-dependency of the quorum sensing hierarchy,regulates rhl-dependent genes at the onset of stationary phase and can be produced in the absence of LasR[J].Mol Microbiol,2003,50(1):29-43.
(2016-12-15 收稿)
Inhibitory Effect of Berberine on the Growth and Virulence of Clinical Isolatesof Quorum Sensing-deficientPseudomonasaeruginosa
Xia Fei1,Xiao Hongbing2,Du Ming1etal
1DepartmentofPharmacy,TheThirdPeople’sHospitalofHubeiProvince,Wuhan430033,China2HealthCenterofCaidianStreetofHuangpiDistrict,Wuhan430323,China
Objective To investigate the effects of berberine on the growth and virulence of clinical isolates ofPseudomonasaeruginosa(P.aeruginosa)with quorum sensing(QS)deficiency and the underlying mechanism.MethodsP.aeruginosaPAO1,QS-deficient PAO JP2 and clinically isolated QS-deficient strains were cultured with berberine at difference concentrations.The minimum inhibitory concentrations(MICs)of berberine against different isolates were determined by double-dilution analysis.The secretion of pyocyanin was measured by ultraviolet spectroscopy,the amount of rhamnolipid by oricinol assay,the biofilm formation by crystal violet staining,and the transcription levels of QS gene by real-time PCR.Results The MICs of berberine againstP.aeruginosawere 12.50 mg/mL in the PAO1 strain,1.56 mg/mL in the C84 strain,3.12 mg/mL in both JP2 and C39 strains,and 6.25 mg/mL in both C104 and C117 stains.Berberine at sub-MIC could significantly decrease the pyocyanin levels in strains PAO1,C104,and C117,and suppress the rhamnolipid levels in QS-deficient stains to varying degrees.Additionally,the biofilm formation was profoundly inhibited by berberine in strains JP2,C39,and C84.The transcription of remaining LasR and rhI was significantly down-regulated by berberine at sub-MIC.Conclusion Berberine can significantly inhibit the growth of clinically isolated QS-deficientP.aeruginosastains and down-regulate the QS-dependent virulence by reducing the transcription levels of QS gene.
Pseudomonasaeruginosa; berberine; quorum-sensing deficiency; pathogenic factors
*湖北省自然科学基金资助项目(No.2011CDB302)
R378.991
10.3870/j.issn.1672-0741.2017.02.008
夏 飞,男,1978年生,助理研究员,E-mail:53042940@qq.com
△通讯作者,Corresponding author,E-mail:WP0166@139.com

