血清miR-4762-5p在鉴别Ⅳ型和Ⅳ+Ⅴ型狼疮性肾炎中的临床意义*
苏美玲, 肖红波, 葛雅婷, 王 艳, 黄莉敏, 熊祖应
北京大学深圳医院肾内科,深圳 518036
血清miR-4762-5p在鉴别Ⅳ型和Ⅳ+Ⅴ型狼疮性肾炎中的临床意义*
苏美玲, 肖红波△, 葛雅婷, 王 艳, 黄莉敏, 熊祖应
北京大学深圳医院肾内科,深圳 518036
目的 探讨血清miRNA是否能够作为鉴别Ⅳ型和Ⅳ+Ⅴ型狼疮性肾炎(lupus nephritis,LN)病理类型的指标及其临床意义。方法 选取60例血清标本,其中Ⅳ型LN组、Ⅳ+Ⅴ型LN组、对照组各20例。利用既往miRNA array芯片结果筛选出7个在Ⅳ型和Ⅳ+Ⅴ型LN组间有差异表达的血清miRNA,采用qRT-PCR技术初步验证芯片结果,并分析血清miRNA与LN病理类型的关系及其与临床参数的相关性。结果 血清miR-4762-5p和miR-151a-3p在不同组间表达量存在差异性。与Ⅳ型LN组、对照组比较,Ⅳ+Ⅴ型LN组血清miR-4762-5p表达量升高(均P<0.05);与对照组比较,Ⅳ型LN组和Ⅳ+Ⅴ型LN组血清miR-151a-3p表达量均下降(均P<0.05)。Ⅳ型LN组血清miR-4762-5p表达量与24 h尿蛋白量、肾小球滤过率呈负相关。结论 血清miR-4762-5p将有可能作为鉴别Ⅳ和Ⅳ+Ⅴ型LN病理类型的生物学标记。
狼疮性肾炎; 微小RNA; 病理类型; 血清; 生物学标记
狼疮性肾炎(lupus nephritis,LN)是系统性红斑狼疮(systemic lupus erythematosus,SLE)最常见的脏器损害,约10%~30%的LN会发展为终末期肾衰竭[1],防治LN对改善SLE预后具有重要意义。肾组织病理类型是LN患者制定治疗方案的重要依据,LN肾脏病理类型分为Ⅰ型、Ⅱ型、Ⅲ型、Ⅳ型、Ⅴ型(包括单纯Ⅴ型、Ⅲ+Ⅴ型、Ⅳ+Ⅴ型)、Ⅵ型。临床上Ⅳ型和Ⅳ+Ⅴ型发病率高,病情相对较重,单纯Ⅴ型较少见,准确诊断Ⅳ型和Ⅳ+Ⅴ型对指导治疗和发病机制研究具有重要意义。肾脏穿刺活检病理检查是诊断LN病理分型的金标准,然而肾活检是有创性操作,有一定风险性,不易被患者接受且不适合多次重复,寻找可替代LN肾活检的生物标志物是临床工作的迫切要求。
miRNA是一类非编码的RNA,能够与靶mRNA的3′-UTR及5′-UTR区碱基互补配对,使其降解或抑制其翻译,从而参与各种生理和病理过程[2],被认为是理想的生物标志物[3-4]。为此,我们研究血清miRNA是否可鉴别LN病理类型。前期我们利用miRNA芯片技术初步发现Ⅳ型和Ⅳ+Ⅴ型LN血清miRNA表达谱存在差异[5]。本研究在前期研究基础上通过对芯片发现的差异性miRNA进行验证,探讨血清miRNA是否具有鉴别Ⅳ和Ⅳ+Ⅴ型LN病理类型的潜能。
1 材料与方法
1.1 实验对象及标本收集
共收集60份血清,包括40例LN患者血清标本和20例健康人血清标本。其中LN血清标本取自2010年1月至2015年8月在北京大学深圳医院经肾活检确诊为Ⅳ型和Ⅳ+Ⅴ型的LN患者。LN组血液用无肝素真空管采集,2 500 r/min离心15 min分离血清,-80℃冰箱保存,健康对照组血清标本来源于体检中心,其性别、年龄与LN组相匹配。健康对照组和LN组入组标准:①排除慢性疾病,如乙型病毒性肝炎、肿瘤、糖尿病等;②排除其它自身免疫疾病以及妊娠、哺乳期女性;③取标本前近1月无活动性细菌、病毒等感染;④LN患者留取样本前3个月内未经过免疫抑制剂及大剂量激素冲击治疗。LN分型依据2003年国际肾脏病学会/肾脏病理学会(ISN/RPS)LN分类标准。研究对象一般临床资料见表1。其中Ⅳ型和Ⅳ+Ⅴ型LN每组包括男性2例,女性18例,年龄17~54岁;健康对照组男性2例,女性18例,年龄22~46岁。3组性别、年龄两两比较差异均无统计学意义(均P>0.05)。本研究经医院伦理委员会审核同意,所有入组者均签订知情同意书。

表1 研究对象一般临床资料±s)
与Ⅳ+Ⅴ型LN组比较,aP<0.05;与对照组比较,bP<0.05;“-”代表无数据;SLEDAI:系统性红斑狼疮疾病活动性评分;eGFR:肾小球滤过率
1.2 LN肾组织活动性评分标准
参考Austin评分系统[6],对肾组织形态学进行半定量计分。肾脏急性活动指数(active index,AI)包括毛细血管内皮增生、白细胞浸润、细胞性新月体、纤维素样坏死和(或)细胞核碎裂、白金耳和(或)透明血栓、间质炎性细胞浸润;慢性活动指数(chronic index,CI)包括肾小球硬化、纤维性新月体、间质纤维化、肾小管萎缩。评分标准:按照无病变、病变小于25%、病变在25%~50%、病变大于50%,分别记0、1、2、3分。AI中细胞性新月体、纤维素样坏死和(或)细胞核碎裂对预后影响大,双倍计分。AI最高24分,CI最高12分。
1.3 miRNA芯片确定差异表达miRNA
根据我们既往miRNA芯片[5]结果显示Ⅳ和Ⅳ+Ⅴ型LN存在差异性表达的miRNA。在差异倍数>3(或<1/3)、P<0.05,同时miRNA芯片原始值>100基础上,从Ⅳ和Ⅳ+Ⅴ型LN差异性表达的miRNA中优先选取差异倍数大,同时miRNA芯片的原始值大者。本研究最终确定以下7种miRNA,分别是miR-664a-5p,miR-4762-5p,miR-151a-3p,miR-146a-5p,miR-21-5p,miR-130b-5p和miR-3165。
1.4 实验方法
采用Real-time PCR技术对miRNA芯片谱结果进行验证,具体方法如下。
1.4.1 总RNA提取 采用miR-Neasy Serum/Plasma Kit(购自美国Qiagen公司)从200 μL血清中提取总RNA,加入5倍体积的QIAzol Lysis Reagent,混匀,室温静置5 min。再加入3.5 μL miRNeasy Serum/Plasma Spike-In Control(cel-miR-39),作为外源性内参[7-8],余步骤严格按照说明书进行。最终获得12 μL总RNA,利用紫外分光光度计测定各样本RNA浓度。
1.4.2 反转录和荧光定量PCR 根据美国Qiagen公司miScript Ⅱ RT Kit操作说明进行加尾及反转录,反应条件:37℃ 60 min,95℃ 5 min。荧光定量PCR反应体系如下:2×SYBR Green PCR Master Mix 10 μL,通用引物和上游引物各2 μL,cDNA 2 μL,不足用水补齐20 μL。7条上游引物序列由美国Qiagen公司设计合成。反应条件:95℃预变性15 min,以94℃ 15 s、55℃ 30 s和70℃ 30 s条件扩增45个循环。miRNA序列在如下网址查询http://www.mirbase.org。反应在Light Cycler 480 Ⅱ荧光定量PCR仪(Roche公司)上进行。
1.5 数据处理及统计学分析
2 结果
2.1 血清miRNA的验证结果及诊断价值
对LN组和对照组血清7个miRNA表达量统计分析发现,2个miRNA(miR-4762-5p、miR-151a-3p)有差异性,其余5个miRNA无差异性。
Ⅳ+Ⅴ型LN组血清miR-4762-5p表达量显著高于对照组(P<0.01);Ⅳ+Ⅴ型LN组miR-4762-5p表达量显著高于Ⅳ型LN组(P=0.005);虽然Ⅳ型LN组表达量比对照组高,但差异无统计学意义(P=0.414),见图1A。Ⅳ型、Ⅳ+Ⅴ型LN组miR-4762-5p的ROC曲线结果示,以相对定量值为1.909,其最优敏感度及特异度分别为75%和70%,AUC=0.755(95%CI:0.604~0.906,P=0.006),对照组、Ⅳ+Ⅴ型LN的ROC曲线AUC为0.822,见图1B。
Ⅳ型LN组和Ⅳ+Ⅴ型LN组血清miR-151a-3p表达量均显著低于对照组(均P<0.01);Ⅳ型LN组表达量与Ⅳ+Ⅴ型LN组相比,差异无统计学意义(P>0.05)(图2A)。miR-151a-3p不能用于鉴别Ⅳ型和Ⅳ+Ⅴ型LN(P=0.245),但其可用于鉴别LN组与对照组。Ⅳ型LN组和Ⅳ+Ⅴ型LN组分别与对照组比较,ROC曲线下面积分别是0.888和0.868,且均有统计学意义(P<0.01),见图2B。

A:血清miR-4762-5p在各组中表达散点图,*P<0.01;B:受试者工作特征曲线和曲线下面积图,a与b分别表示血清miR-4762-5p鉴别Ⅳ+Ⅴ型和Ⅳ型LN患者以及Ⅳ+Ⅴ型LN患者和对照组的能力图1 血清miR-4762-5p在Ⅳ+Ⅴ型LN组、Ⅳ型LN组和对照组的表达比较Fig.1 Comparison of the expression levels of serum miR-4762-5p among groups of class Ⅳ LN,class Ⅳ+Ⅴ LN and control

A:血清miR-151a-3p在各组中表达散点图,*P<0.01;B:受试者工作特征曲线和曲线下面积图,a与b曲线分别表示血清miR-151a-3p鉴别Ⅳ型LN患者和对照组以及Ⅳ+Ⅴ型LN患者与对照组的能力图2 血清miR-151a-3p在Ⅳ+Ⅴ型LN组、Ⅳ型LN组和对照组的表达比较Fig.2 Comparison of the expression levels of serum miR-151a-3p among groups of class Ⅳ LN,class Ⅳ+Ⅴ LN and control
2.2 血清miR-4762-5p表达量与临床指标的关系
Ⅳ型LN组血清miR-4762-5p表达量与24 h尿蛋白量(r=-0.556,P=0.011)、肾小球滤过率(r=-0.466,P=0.038)呈负相关;与总胆红素(r=0.469,P=0.037)呈正相关。Ⅳ+Ⅴ型LN组血清miR-4762-5p表达量与平均动脉压(r=-0.511,P=0.021)、血白细胞(r=-0.515,P=0.020)、血尿素氮(r=-0.510,P=0.022)呈负相关,与血清总蛋白(r=0.455,P=0.044)呈正相关。Ⅳ型LN组和Ⅳ+Ⅴ型LN组血清miR-4762-5p表达量与疾病活动性指标,如肾脏急性活动指数、肾脏慢性活动指数、系统性红斑狼疮疾病活动性评分(SLEDAI)及C3、C4、抗双链-DNA等均不相关(均P>0.05);亦与C反应蛋白、红细胞沉降率、丙氨酸氨基转移酶、尿酸、血肌酐、血小板、血红蛋白等不相关(均P>0.05),见表2。
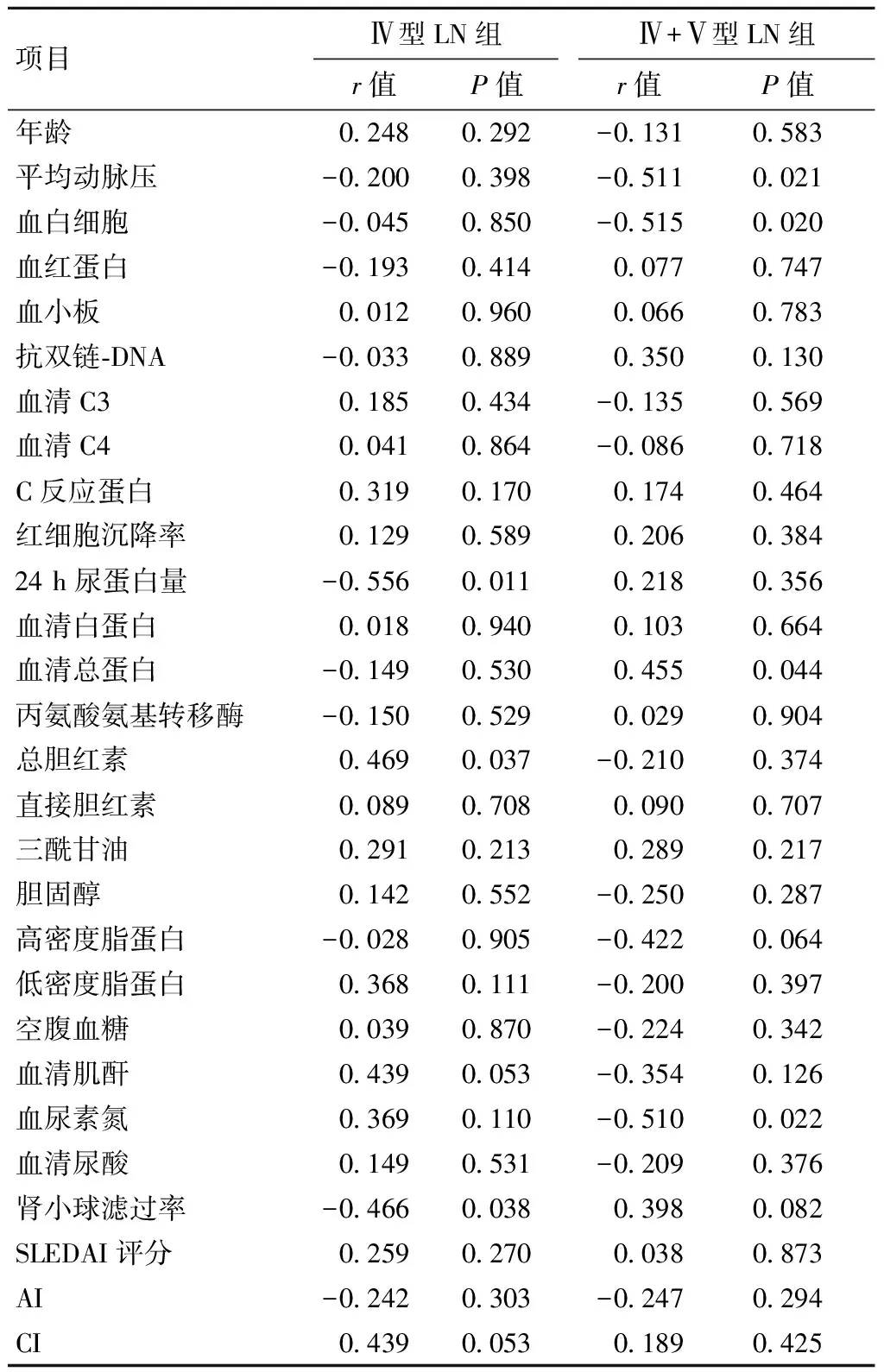
表2 血清miR-4762-5p与Ⅳ型和
SLEDAI:系统性红斑狼疮疾病活动性评分;AI:肾脏急性活动指数;CI:肾脏慢性活动指数
2.3 血清miR-151a-3p表达量与临床指标间的关系
血清miR-151a-3p表达量在Ⅳ型LN组中仅与肾组织急性活动指数(r=-0.526,P=0.017)呈负相关;在Ⅳ+Ⅴ型LN组中与C反应蛋白(r=-0.486,P=0.030)、空腹血糖(r=-0.499,P=0.025)呈负相关,与血红蛋白(r=0.481,P=0.032)呈正相关。余均无相关性(均P>0.05)。
3 讨论
LN病理类型相关生物标志物的探索始终是临床诊断和发病机制研究中的重要方向。有研究采用血清抗C1q抗体来评价LN病理类型[10],但其敏感度和特异度不高,难以满足临床要求,目前仍无理想的诊断LN病理类型的生物标记物。miRNA在血清中的稳定性以及在疾病状态下表达量会发生显著改变的特性,使得miRNA可能作为多种疾病的新型生物标记物[3-4]。也有研究发现miRNA参与LN发病[11-12]。本研究探讨了血清miRNA成为鉴别LN病理类型生物标记物的可能性及其临床意义。
本研究结果显示,血清miR-4762-5p表达量在Ⅳ+Ⅴ型LN组升高且与Ⅳ型LN组有差异。为进一步探索miR-4762-5p是否具备鉴别Ⅳ型和Ⅳ+Ⅴ型LN的潜能,通过ROC曲线分析发现AUC为0.755,且当临界值为1.909时,其最优敏感度及特异度分别为75%和70%,提示miR-4762-5p能较好区分Ⅳ型和Ⅳ+Ⅴ型LN。Ⅳ型LN组血清miR-4762-5p表达量与24 h尿蛋白量、肾小球滤过率呈负相关,初步提示尿蛋白量、肾功能受损程度影响miR-4762-5p表达量。
本研究还发现,LN组患者血清miR-151a-3p表达量均较对照组下调,且根据LN组与对照组ROC曲线下面积(AUC>0.8,P<0.01)提示其有可能具有诊断LN潜能。已有关于miR-151a-3p的研究主要集中在肿瘤领域,研究发现它可促进肿瘤生长与进展[13-14]。如miR-151a-3p在肝癌中高表达增加了肝癌细胞迁移、侵袭能力[14]。近年来研究发现,miR-151a-3p在肾脏病患者肾组织和血清中也有表达。如miR-151a-3p在肾病综合征患儿肾组织中呈现低表达[15],但在血清中呈现高表达,血清miR-151a-3p表达水平与血清胆固醇和24 h尿蛋白量呈正相关,且在临床缓解期间表达量下降[16]。本研究中miR-151a-3p表达水平与上述结果不一致,可能与入组疾病种类不同有关;且其在LN组中与肾组织急性活动指数、C反应蛋白相关,提示miR-151a-3p可能参与LN活动,但miR-151a-3p在LN中确切意义仍需进一步研究。
综上所述,本研究发现Ⅳ和Ⅳ+Ⅴ型LN病理类型之间及与健康人之间均存在显著差异的血清miRNA,血清miR-4762-5p可能具有鉴别Ⅳ和Ⅳ+Ⅴ型LN病理类型的潜能,血清miR-151a-3p可能具有鉴别诊断LN和健康人的潜能。但本研究仍存在诸多不足,如样本量较小、病理类型不全,用于验证实验的miRNA较少等,未来将在本研究基础上进一步探索。
[1] Cervera R,Khamashta M A,Font J,et al.Morbidity and mortality in systemic lupus erythematosus during a 10-year period:a comparison of early and late manifestations in a cohort of 1,000 patients[J].Medicine(Baltimore),2003,82(5):299-308.
[2] Chua J H,Armugam A,Jeyaseelan K.MicroRNAs:biogenesis,function and applications[J].Curr Opin Mol Ther,2009,11(2):189-199.
[3] Gilad S,Meiri E,Yogev Y,et al.Serum microRNAs are promising novel biomarkers[J].PLoS One,2008,3(9):e3148.
[4] Brase J C,Wuttig D,Kuner R,et al.Serum microRNAs as non-invasive biomarkers for cancer[J].Mol Cancer,2010,9:306.
[5] 张志恒,肖红波,王琪,等.Ⅳ和Ⅳ+Ⅴ型狼疮性肾炎患者血清microRNA标志物的芯片初筛[J].重庆医学,2015,44(27):3745-3747,3751.
[6] Austin H A,Muenz L R,Joyce K M,et al.Diffuse proliferative lupus nephritis:identification of specific pathologic features affecting renal outcome[J].Kidney Int,1984,25(4):689-695.
[7] Roberts T C,Coenen-Stass A M,Wood M J.Assessment of RT-qPCR normalization strategies for accurate quantification of extracellular microRNAs in murine serum[J].PLoS One,2014,9(2):e89237.
[8] 李雅楠,郝玉宾,张志,等.实时荧光定量PCR相对定量法检测循环miRNA的内参选择[J].生物技术通讯,2015,26(1):146-148.
[9] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[10] Gargiulo M L,Gómez G,Khoury M,et al.Association between the presence of anti-C1q antibodies and active nephritis in patients with systemic lupus erythematosus[J].Medicina(B Aires),2015,75(1):23-28.
[11] Zhou H,Hasni S A,Perez P,et al.miR-150 promotes renal fibrosis in lupus nephritis by downregulating SOCS1[J].J Am Soc Nephrol,2013,24(7):1073-1087.
[12] Miao C G,Yang Y Y,He X,et al.The emerging role of microRNAs in the pathogenesis of systemic lupus erythematosus[J].Cell Signal,2013,25(9):1828-1836.
[13] Visone R,Rassenti L Z,Veronese A,et al.Karyotype-specific microRNA signature in chronic lymphocytic leukemia[J].Blood,2009,114(18):3872-3879.
[14] Ding J,Huang S,Wu S,et al.Gain of miR-151 on chromosome 8 q24.3 facilitates tumour cell migration and spreading through downregulating RhoGDIA[J].Nat Cell Biol,2010,12(4):390-399.
[15] Lu M,Wang C,Yuan Y,et al.Differentially expressed microRNAs in kidney biopsies from various subtypes of nephrotic children[J].Exp Mol Pathol,2015,99(3):590-595.
[16] Luo Y,Wang C,Chen X,et al.Increased serum and urinary microRNAs in children with idiopathic nephrotic syndrome[J].Clin Chem,2013,59(4):658-666.
(2016-10-09 收稿)
本刊声明
鉴于本刊已整体进入中国知网及其系列数据库、万方数据——数字化期刊群、中文科技期刊数据库(维普资讯)等电子数据库,若无特别声明,本刊所有投稿视为同意在本刊出版印刷版的同时授权出版光盘版及网络版,本刊所付作者稿酬已包含此项收益。本刊未与任何个人、企业签订稿件代理业务,也不出增刊,任何代理本刊稿件行为均为非法活动。投稿请直接投至本刊网站、电子邮箱或致电编辑部。
本刊网址:http://tjxb.hust.edu.cn E-mail:tjxb@mails.tjmu.edu.cn 电话:027-83692530
Clinical Significance of Serum miR-4762-5p in Differentiating betweenClass Ⅳ and Class Ⅳ+Ⅴ Lupus Nephritis
Su Meiling,Xiao Hongbo△,Ge Yatingetal
DepartmentofNephrology,PekingUniversityShenzhenHospital,Shenzhen518036,China
Objective To explore the clinical value of serum miRNA in differentiating between class Ⅳ and class Ⅳ+Ⅴ lupus nephritis(LN).Methods The serum samples were harvested from 20 class Ⅳ LN patients,20 class Ⅳ+Ⅴ LN patients and 20 healthy individuals.According to the previous miRNA array results obtained by our team,7 serum miRNAs(miR-664a-5p,miR-4762-5p,miR-151a-3p,miR-146a-5p,miR-21-5p,miR-130b-5p,miR-3165)which were significantly different between class Ⅳ and Ⅳ+Ⅴ LN were screened out.By real-time quantitative PCR,the results of 7 miRNAs were verified.The relationship between serum miRNAs and LN pathological types or clinical indicators was analyzed.Results There were significant differences in serum miR-4762-5p and miR-151a-3p between different groups.miR-4762-5p was significantly up-regulated in class Ⅳ+Ⅴ LN group compared with the class Ⅳ LN group and the control group(P<0.05).miR-151a-3p was significantly down-regulated in both the class Ⅳ LN group and class Ⅳ+Ⅴ LN group compared with the control group(P<0.05).The expression of miR-4762-5p was negatively related to the 24-h proteinuria and glomerular filtration rate in class Ⅳ LN group.Conclusion Serum miR-4762-5p may become one of the biomarkers that can differentiate between class Ⅳ and class Ⅳ+Ⅴ LN.
lupus nephritis; microRNA; pathological type; serum; biomarker
*广东省自然科学基金博士启动项目(No.S2013040015040)
R593.242
10.3870/j.issn.1672-0741.2017.02.018
苏美玲,女,1989年生,在读硕士,E-mail:Suml2014@163.com
△通讯作者,Corresponding author,E-mail:luckyxiaohb@163.com

