毛囊源性黑色素细胞的生物学特性及其体外培养技术研究进展
樊蕊蕊刘菲琳郝德顺张琪张莹瑶郑彤李士伦王鸿艳戚良晨 刘晋宇
毛囊源性黑色素细胞的生物学特性及其体外培养技术研究进展
樊蕊蕊1,2刘菲琳3郝德顺4张琪1张莹瑶1郑彤1李士伦5王鸿艳6戚良晨7刘晋宇1
黑色素细胞(MC),是脊椎动物皮肤、毛发着色的主要细胞,主要存在于表皮基底层,这部分细胞约占基底细胞的10﹪;另外还有少量存在于毛囊、内耳血管纹、眼睛脉络膜等,它的功能或者数量的突变,会导致一系列难治性脱色素性疾病。目前针对表皮来源的MC研究已经很多,体外培养技术也比较成熟,但表皮MC不能为毛发着色,毛囊源性MC能够合成黑色素,且移植后能够归巢到皮肤,从而为色素障碍性疾病的治疗提供理论基础和实验依据。本文就毛囊源性MC的生物学特性,鉴定方法,以及体外培养技术的研究进展进行了综述。
毛囊; 黑素细胞; 生物学; 细胞培养技术
自Sangiovanni在1819年首次描述了黑色素细胞(melanocyte,MC)形态结构及其与皮肤色素沉着的关系以来,人们对MC的研究日益增多;1837年,Henle证实了MC与皮肤色素沉着的关系;1917年有研究学者首次将3,4-二羟本丙氨酸(DOPA),即多巴,引入了MC的研究,并证明多巴是MC内酶的特异性作用底物,多巴染色方法为研究MC一个重要的手段[1];1954年研究发现受损皮肤组织中有色素细胞存在,但由于缺乏对MC的标记方法,未能区分是临近正常皮肤MC迁移而来,还是原本存在的非色素化的前体细胞的分裂、分化产生新的色素细胞所致[2]。随着人们对MC认识的逐步深入,一些由MC的功能或数量改变引起的色素障碍性疾病逐渐找到了良好的治疗手段,这也促使人们对MC的研究更为深入。
一、MC生物学特性
(一)胚胎发育过程
MC来源于神经嵴干细胞,沿着神经管通过体节逐步迁移至神经节,不断分化成黑素干细胞[3-4]。黑素干细胞在体节与真皮之间沿背外侧途径迁移到外胚层:皮肤、毛囊,并最终在外胚层分化为MC[5],胚胎发育过程见图1;另外,在形态上,每一个MC与其毗邻的约36个角朊细胞密切关联,形成一个相互作用的单位,MC的形态和功能是被角朊细胞以旁分泌的形式分泌生物因子来调节的。
(二)MC的形态
成熟的MC细胞体积较大,具有树突状结构;不成熟的MC细胞体积较小,树突结构较为少见[7]。各个部位的MC形态也不同,首先在毛囊中,毛母质区域的细胞不仅细胞的树突较长而且体积也是最大的;其次在隆突部位MC的形态见图2:细胞成两极状或三极状,细胞的树突相对较小,且胞体积大小也不如前者,细胞核折光性较强,比毛囊间充质干细胞形态要窄细一些;最后在皮肤的表皮层基底膜中的MC体积则介于前两者之间[8-9]。
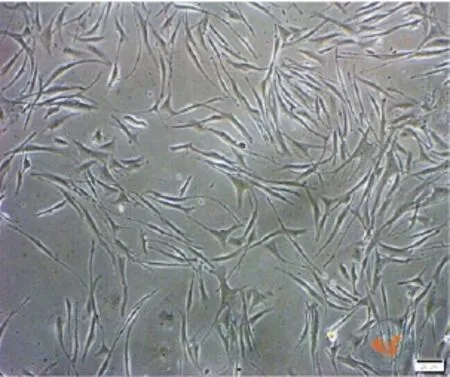
图2 相差显微镜下观察到的隆突部位毛囊中毛囊源性黑色素细胞(×100)
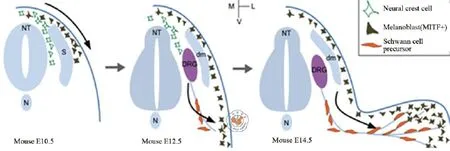
图1 黑色素细胞的胚胎发育过程示意图[6]
(三)MC的功能
毛囊中MC有生长期、退行期和静止期,MC在周期循环中不同时期具有不同的功能。处于生长期的MC可以合成黑色素,不仅能够使皮肤、毛发着色,而且可以有效抵抗自由基和活性氧对皮肤DNA的损伤[10];而退行期和静止期的MC不能合成黑色素颗粒,不能为皮肤和毛发着色,随着生长周期的循环进入生长期,作为MC的储存库,可以为生长期毛囊提供黑色素干细胞,进而分化为成熟的MC,当白癜风色素再生时,能被激活,从隆突部位向表皮移动,至色素脱失处,使皮肤着色[11-12]。
(四)MC参与毛囊周期循环
脊椎动物毛发的生长包括两部分:(1)毛干的生长;(2)色素合成,这个过程需要毛囊干细胞与黑色素干细胞协同作用[13]。毛囊隆突区内黑色素干细胞是毛发着色的来源细胞[6]。毛囊中的MC是随着毛囊的生长周期的循环不断发生增殖和分化的,参与到整个毛囊周期性循环过程:即在毛囊生长的休止期间,隆突部位存在着未成熟的MC,但是随着毛囊生长期的进入,该部位的大部分MC向下迁移,增殖并且逐渐成熟,最终定位于真皮毛乳头上方;隆突部位一小部分MC仍处于未成熟的状态[14-15],过程如图3所示,这部分MC的酪氨酸酶表达受阻,长期处于未激活的状态[16],不合成黑色素。这类MC即为黑色素干细胞,其主要功能是为表皮和毛囊提供种子细胞来源,黑色素干细胞功能缺失,使得色素合成不足,将会导致灰、白色毛发的产生。
(五)MC迁移过程
毛囊隆突区细胞具有多向分化潜能,不仅能向下迁移形成毛球部,而且能向上迁移参与表皮的维持和毛囊的形成。有研究认为该类细胞可能经过两个独立的迁移分化途径,即隆突区-表皮途径和隆突区-毛发途径[17-18],如图4所示,这一观点也解释了毛囊中的MC如何使得皮肤和毛发着色的。
(六)MC分布以及各部位的特性
毛囊源性MC在生长期的分布可以分成以下几个部分:(1)漏斗区MC,该区细胞与表皮中MC相似,有树突状结构形成;(2)隆突区MC,该部分细胞具有较强的增殖能力,树突相对较小,无黑色素合成,表达gp100。未活化的无色素性黑素细胞(amelanotic melanocytes,AMMC)不仅数量多,且胞体小,多数程两极状结构,不能合成黑色素颗粒,但其体外培养贴壁率高,增殖活跃,AMMC主要存在于生长期毛发外毛根鞘(ORS)中,多巴反应阴性的AMMC在一定条件下可以转化为多巴反应阳性的细胞[19];(3)毛乳头上方的MC有较弱的增殖能力,是唯一将合成的黑色素颗粒转移至毛干的一类细胞;(4)毛球外侧的MC具有较强的增殖能力,但无黑色素合成[20]。也有研究发现毛囊漏斗部和毛球部位MC比毛囊中部皮脂腺以下的MC体积大,NK1/β抗体反应更强,毛囊中部MC的树突很少,推测可能是黑素前体细胞[21]。
(七)黑色素颗粒的合成
MC的一个重要特点是合成黑色素小体,黑色素颗粒主要是在黑色素小体生产和存储的,这也是MC重要的生理功能[22]。在MC内的黑色素是以酪氨酸为原料,经酪氨酸酶催化作用后形成,酪氨酸酶是该过程的关键限速酶。再者,多巴(DOPA)、TYRP-1、TYRP-2、MITF 等多种蛋白均与酪氨酸酶活性功能息息相关,且相互之间是相辅相成的关系,例如:L-DOPA可以增强酪氨酸酶的活性,而TYRP-1又可以稳定酪氨酸酶,黑色素小体具有吞嗟和分泌功能,称之为溶酶体相关细胞器[23-24]。依据黑色素小体结构特征,可以将黑色素小体的分化过程分为四个主要的阶段:(1)第1期,黑色素小体生长基质的形成阶段,无黑色素颗粒合成、分泌[25][36];(2)第2期,基本完全形成了黑色素小体基质,褐黑素小体表面开始有和色素颗粒沉积,真黑素小体上还没有[25][36];(3)第3期,真黑素小体和褐黑素小体的表面基本均有黑色素颗粒沉积[25][36];(4)第4期,黑色素小体趋于成熟化,并且有大量黑色素颗粒合成[25][36]。
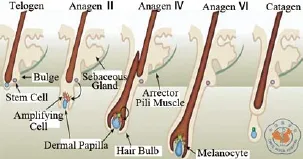
图3 毛囊源性黑色素细胞的周期循环示意图[14]
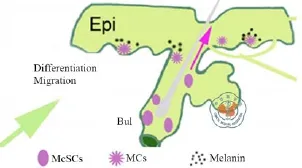
图4 黑色素细胞分化迁移路径[17]
(八)黑色素颗粒的转运
黑色素在MC内合成后,通过MC的树突结构以黑色素颗粒的形式转运至周围表皮和生长期毛基质角朊细胞中去,黑色素转运过程需要MC中微管驱动蛋白、动力蛋白和肌球蛋白c5a等的参与[25]。最近也有新的研究表明:黑色素的转运受多种内外性因素的影响,内源性的例如:Manassantin B、Rab36、Mregdsu基因的产物-Melanoregulin;外源性因素如:氧化应激以及紫外线的照射等因素均会影响该过程[27-28][30]。
(九)MC标志物的阐述
1.MITF(microphthalmiaassocitate transcription factor)[28]:又称小眼畸形关联转录调控因子,该基因MTIF是神经嵴细胞定向分化发育成黑素细胞过程中最早发生的标志之一,能够调控酪氨酸基因家族的表达,从而参与黑素生成的调控。Mitf蛋白有多种变体,其中MITF-M特异性地表达在MC以及黑素瘤细胞中,对于MC的存活、增殖、分化以及色素合成均有重要意义[31]。
2.c-Kit:在维持MC的存活中起关键作用,但并不具有特异性表达于MC的能力;MC的迁移依赖于细胞表面的c-Kit与Kit-R的结合完成[32]。
3.TYR:是催化黑色素合成过程的核心限速酶,能够作用于多巴,促进合成黑色素颗粒[31][33]。
4.TRP-1、TRP-2:这两种蛋白主要参与优黑素生成,为优黑素生成的速度调节器,合成黑色素的下游酶[34]。
5.S-100:有多种亚型,其中s100-A4型特异性表达于MC以及朗格汉斯细胞中,提示S-100一定程度上可以作为MC的标志蛋白。
6.PAX3:PAX3蛋白是转录因子,是PAX家族的一员,该基因最早在胚胎期的神经嵴前体细胞中表达,参与黑色素母细胞分化迁移以及发育过程,而且均起到了较重要的作用,因此又被认为是特异性较强的因子。另外又因PAX3蛋白在MC瘤和痣中的表达量较正常皮肤MC明显多,因此,PAX3已经作为MC瘤鉴别的一种标记蛋白[34]。
7.g-100:g-100蛋白是前体黑素小体和成熟黑素小体上的膜分子蛋白,能够被NKI-β抗体、HMB-45抗体识别,为以后做免疫组织化学、免疫荧光提供依据。
上述这些标志物是MC存在的标志,但是没有哪一种标志物是毛囊源性MC绝对特异性标志物,所以结合以上几种标志物才更具说服力,也可以为以后的鉴定工作提供依据。
二、毛囊源性MC体外培养方法
毛囊源性的MC获取不易,增殖能力不强,且极易分化,基于这些生物学特性,进一步证实了其体外培养的难度,故在分离、体外培养技术方面仍需进一步探索和优化。下面就目前常用的体外培养方法进行介绍,并对其中的方法和细节提出了改进优化方案。
(一)细胞的分离
毛囊源性的MC体外培养的组织来源主要是人和小鼠的皮肤。人的皮肤可取自人类面部皮肤及包皮,其中包皮含有较多的MC;对于小鼠而言,一般取生长期小鼠的背部皮肤,2 cm2的皮肤即可满足培养要求。依据前人研究成果发现,鼠MC比人的更容易分化,培养要求更高。目前,毛囊中MC的分离方法主要有:酶消化法以及组织块贴壁法。对于酶消化法而言,依据温度的不同,又有冷消化法和温消化法之分[33]。
组织块贴壁法,即是先在解剖显微镜下分离出单根毛囊置于孔板中,用解剖刀片划开外毛根鞘,放上培养液培养,可有MC从毛囊中爬出。这类方法获得的细胞纯度相对较高,状态较好,但由于毛囊中MC比例较少,故爬出的细胞较少,细胞密度不够,不易存活,成功率较低。
酶消化法,所用的酶主要有胰蛋白酶、中性蛋白酶(dispase Ⅱ)、Ⅰ型胶原酶、Ⅳ型胶原酶几种。取下组织块,剪成小块,用酶进行消化,若是37 ℃下消化即为温消化法;若是4 ℃过夜消化即为冷消化法,轻轻吹打酶消化后的组织块,经过滤网过滤后,收集毛囊,再用胰蛋白酶消化毛囊,获得毛囊细胞,用选择培养基培养即可获得较纯的MC。这类方法相对简单,成功率较高,但是获得的细胞较杂,纯度不够,其中的角朊细胞以及成纤维细胞不易去除,影响MC的存活以及增殖。已有研究成果显示:先用中性蛋白酶消化皮肤,将表皮与真皮分离开来,再用Ⅰ型胶原酶,37 ℃下消化表皮,获取MC。据研究表明:这种方法获得的MC产量好和活力高,培养至第三代时纯度已经达到要求,可用于后期研究[35]。
(二)培养液的选择
依据文献报道MC细胞的培养液多种多样,较常用的基本培养液有DMEM、RPMI1640、Ham、M254等。
1.Eagle培养液:Eagle研制成了细胞生长最低必需培养液MEM,是MC培养中较常用的培养液[33]。DMEM是在MEM基础上经修改而成的,适用于多种细胞系和组织的生长,也比较适合于MC的培养,但是需要再向其中加入多种生长因子以及高浓度的血清,因为MC细胞相比于毛囊间充质干细胞而言,增殖能力不够强,且比较容易分化,所以培养条件要求更高。而研究者多用其来培养皮肤表皮中的MC,因为表皮中的MC来源丰富,更容易培养,而对于原本研究就比较少的毛囊MC而言,培养条件远远不够,在MC扩增上难以实现。
2.RPMI-1640培养液:该培养基能适应包括MC在内的多种细胞的生长,无论是原代和传代培养效果都不错,是目前细胞培养应用最多的培养基之一[36]。但是,问题同样存在,究其原因大同小异,毛囊中MC相比于毛囊中的其他类型细胞,例如:间充质干细胞以及角朊细胞,是比较难以培养的,若是想获得扩增后的毛囊MC用于皮肤、毛发色素障碍性疾病的移植治疗更是困难重重,所以也注定了毛囊MC培养条件的苛刻,虽然有研究者使用该培养基培养出了MC,但是一般都是人表皮的MC,相比于人类,鼠的MC更容易分化,该培养基在MC的扩增和纯化上还是难以达到要求。
3.Ham培养液:培养基的特点是在配方中加入了一定量的微量元素,可以在血清含量较少(2﹪ ~ 10﹪)的情况下培养细胞[37]。而MC的培养条件正是需要低血清培养,因为较高的血清浓度会促进成纤维细胞的增殖而抑制MC的增殖,不利于扩增,所以有研究者使用Ham培养液来获取MC,但是效果也不理想,因为该培养基无促进MC增殖以及抑制其分化的细胞因子,所以扩增和纯化MC是比较困难的。
4.M254培养液:是一种专门用来培养MC的培养基,可以直接作为选择培养基使用[38],一方面,其血清含量较低,避免了高血清浓度对于MC分化的影响;另一方面,众所周知,在从毛囊中获取MC的过程因为选择的是酶消化法,所以获得细胞还不够纯,混有大量的成纤维细胞,成纤维细胞的大量增殖会抑制MC的生长,而M254培养基中补充物HMGS内含有TPA等抑制成纤维细胞增殖的细胞因子,从而有效地避免了此问题的出现;再者,M254培养基中还有很多能够促进MC增殖的细胞因子,从而大大提高了细胞培养效率,这也是本实验室在研究MC中使用M254培养基的重要原因。
皮肤组织中MC的数量较少,且细胞分裂能力弱,因此在体外培养时常须添加MC有丝分裂剂。1982年Eisinger利用在培养基中添加促癌剂十四烷酰佛波醇已酯(yetradecanoyl-phorbol-acetate,TPA),霍乱毒素(cholera toxin,CT)的方法,首次成功地在体外获得了MC的分化培养,为研究色素代谢性疾病提供了实验依据。目前常用的添加剂:有TPA、bFGF(basic fibroblast growth factor)、IBMX(3-isobutyl-1-methylxanthine)、CT(cholera toxin)、ET-3(内皮素-3)[39]、基因素、干细胞因子还有2015年最新发现的雌激素、肾上腺髓质激素(adrenal medulla,ADM)等在MC增殖方面有重要作用等。众所周知,TPA是一种促癌因子,在MC培养中适当浓度TPA能促进MC贴附和增殖,抑制角质形成细胞及成纤维细胞的贴附和生长;CT可促MC生长而抑制成纤维细胞的生长;IBMX是一种磷酸二酯酶抑制剂,抑制细胞内环磷酸腺苷(cAMP)分解[40],而CT可提高cAMP水平,是蛋白激酶A(protein kinase A,PKA)的激动剂,故通过cAMP/PKA信号途径刺激MC增殖,IBMX和CT可加强TPA的作用[40-41];bFGF是MC重要的促生长因子,它可促进MC增殖;粒细胞巨噬细胞集落刺激因子(GMCSF),是由角朊细胞分泌的,据文献报道其可以抑制角质形成细胞,促进MC的生长[41];基因素(Geneticin),可选择性杀死快速增殖的成纤维细胞[42];外源性雌激素乙烯雌酚(DES),在10-8~ 10-6mol/L的浓度会增强酪氨酸酶的活性,继而促进黑色素颗粒的合成,最终提高MC的增殖能力[43];肾上腺髓质激素,可以促进MC树突的形成以及黑色素的合成以及积累,进而促进其增殖[44]。
上述几种添加剂是一把双刃剑,其在促进MC分裂的同时,也使得培养的细胞存在一定毒性,例如:CT仍是一种有毒素的生物制剂,不安全隐患依然存在;最近有研究者发现一些组合后的生长因子,如碱性成纤维细胞生长因子与肝细胞生长因子的组合使用以及内皮素-1与扩散因子的组合使用等在不添加其他物质的情况下,也能引起MC的大量增殖[44],具有更广阔的应用前景。以下介绍几种组合以及培养的细胞形态:
1.铺角朊细胞为滋养层,用丝裂霉素C处理之后将原代MC种植于其上,用RPMI培养基加入TPA、CT,因为角朊细胞会分泌一些可溶性因子以及外泌体,促进MC的生长以及增殖[10][37],所以这种方法培养的MC胞核遮光性更强,增殖能力也会更强。
2.MCD153培养基+CT+SCF+ ET+bFGF:该条件下的细胞多具有2 ~ 3个树突,胞体较大,细胞形态呈三角形或两极状,少量具有多树突[39]。
3.Hamf-12-DMEM培养基+CT+bFGF+双抗+胎牛血清+基因素:该条件下的MC形态上呈梭型,胞体较小,边缘不很清晰,黑素颗粒少,胞体色淡,但生长的速度较快,多数细胞处于分裂期[35-36]。
4.HamF-12-DMEM培养基+TPA+IBMX+CT+双抗+胎牛血清+基因素:该系统下的MC呈多极性,细胞树突多在3个以上,胞体较大,色深,黑素颗粒多,边界清晰,生长速度较慢,多数呈现其功能性[36][38]。
5.M254完全培养基:内含有TPA,bFGF,ITS可以消除成纤维细胞以及角朊细胞,培养的细胞多数为两极状,内有黑色素颗粒的合成。在M254完全培养基条件下的细胞,不仅增殖能力较强而且具有合成黑色素颗粒的功能,符合移植要求,应用潜能较大,目前应用也较多,但是价格昂贵,一定程度上限制了其应用。
(三)鉴定方法
由于MC本身缺乏特异性较强的标志物,并且就目前研究水平而言,对于MC和其前体细胞—黑色素干细胞很难鉴别开来,所以在鉴定方法上学者们并不统一,且国内外研究者们鉴定侧重点也有所不同。下面就几种常用的鉴定方法进行总结:
1.从形态上:首先,在相差显微镜下观察到的MC应该是两极或者三极状的,胞核折光性较强,比毛囊间充质干细胞形态要窄细一些。其次,经典的染色即L-DOPA染色,这种方法的原理是利用酪氨酸酶跟其反应底物多巴进行反应,会有棕色或者黑色颗粒呈现。再者,可以利用透射电镜来观察MC胞浆里的黑色素颗粒,可以观察到不同阶段的黑色素颗粒[45-46]。
2.在mRNA水平上:首先是RT-PCR,MC内有特异性基因,如:MITF、TRP1、TYR、TRP2、Kit等,如果能够PCR出目的条带,一定程度上也能说明问题。再者,实时定量PCR,该方法比RT-PCR更灵敏,且能反映趋势,更能说明这一点。
3.在蛋白水平上:首先,最精确、最重要的就是Western Blot方法,它是一种既能定性又能半定量的研究方法[47]。如果细胞中能够表达MC的标志蛋白,如:MITF蛋白,TYR,TRP1,TRP2,S-100蛋白,g-100蛋白,再结合细胞的形态,基本确定MC。其次,免疫荧光染色,是利用荧光标记的抗体检测MC抗原:MITF蛋白,TYR,TRP1,TRP2,S-100蛋白,g-100蛋白的表达。再者,还有免疫细胞化学染色,利用的也是抗原-抗体特异性结合的原理,采用生物素与底物反应呈现颜色来显示抗原的存在。最后,还有细胞流式术来定量检测MITF蛋白,TYR,TRP1,TRP2,S-100蛋白,g-100蛋白表达比例和强度。虽然MC鉴定方法很多,但是没有哪一种方法能独立确定MC,采用多种方法联合鉴定MC的方法更具有说服力。
(四)影响MC分离获取成功的因素分析
通过查阅大量的文献以及本实验室研究经验,总结了如下影响MC分离获取成功的因素:
首先,取材方面,若是取人毛囊中的MC,最好是头皮,毛囊丰富;若是鼠,最好是处于生长期的乳鼠背部皮肤,因为生长期毛囊较活跃,MC处于分裂期,更易培养[48]。
其次,取下皮肤后最好选用酶消化法,对所用酶的种类、浓度以及消化的时间、温度的控制也很重要,要避免消化不够以及消化过分,损害MC。再者,接种细胞的密度也尤为重要,密度太小或者太密,MC均不易存活,需要仔细摸索。
再次,培养基以及因子组合的选择也应该引起重视。以上介绍了多种基础培养基以及因子,各有利弊,也需仔细考虑。还有,血清的浓度也会影响细胞的生长,血清浓度太高,MC很容易分化,生长旺盛的成纤维细胞会慢慢地挤掉MC,最终导致MC越来越少。
最后,传代培养过程中,胰酶是否需要加EDTA以及消化时间的长短也会严重影响MC的状态,因为MC相比成纤维细胞对胰酶更为敏感,所以建议消化时间缩短,以提高MC的存活率,减少细胞毒性。
三、问题与展望
目前,色素障碍性疾病尤其是白癜风,白化病以及人在衰老过程中的白发症不仅影响美观使得人们自信心不足,而且已经严重影响到人们的身心健康,这类疾病一定程度上已经被归类于难治性疾病,传统上的治疗方法例如:激素治疗、放射治疗,以及免疫调节治疗甚至于皮肤移植,这些方法不仅存在着免疫排斥等的风险,而且治疗效果也不佳。所以,细胞移植法应运而生,极大程度上弥补了传统疗法的不足,还有着自身无可替代的自体来源的优势,大量的实验研究已证明自体MC移植一定程度上对于色素障碍难治性疾病的治疗有促进作用,所以这个领域已成为再生医学研究的热点。HF作为一种重要、丰富且容易获取的组织,目前研究的也越来越热,HF-MCs与皮肤表皮来源的MC相比有很大的优势,因为表皮内MC也是由毛囊内迁移分化而来的,比表皮内的MC增殖活性以及合成黑色能力更强;再者HF具有周期性,故其内MC也会随着HF周期循环而不断更新,MC的周期性循环过程解释了人类从青年到衰老过程中皮肤和毛颜色变化的原因,这一点在表皮MC内是不具备的。
目前体外培养表皮中MC的技术已经相对成熟,而毛囊源性MC的技术目前仍存在着困难,因为这是由毛囊源性MC本身的生物学特性决定的,其不仅在毛囊中含量极少,增殖能力较弱,且比较容易分化,所以对培养条件要求较高。研究表明,在毛囊源性MC的培养过程中,首先是纯化问题,在大多数的毛囊源性MC培养过程中都混杂有成纤维细胞或者角朊细胞,而这两种细胞增殖能力较MC强,所以更增加了MC的培养难度;其次,是毛囊源性MC的增殖问题,其增殖够不够强,杂细胞的生长过旺,直接抑制MC的增殖;最后,是毛囊源性MC的易分化问题,相比于人类表皮MC,毛囊源性MC更容易老化,这一点对于细胞移植治疗色素障碍性疾病是致命的,所以以上三点亟待解决。
体外培养毛囊源性MC有助于更深入的了解其生物学特性,开阔了MC的应用前景,在后期的研究工作中也具有一定指导价值,为MC的增殖和色素代谢以及色素性疾病研究等提供了重要的细胞模型,也为白癜风、灰发症等色素障碍性疾病的治疗提供新思路。
1 姜俊兵, 董常生, 贺俊平.不同被毛颜色羊驼皮肤组织中成熟黑色素细胞的组织学分析[J].畜牧兽医学报, 2010, 41(2):229-233.
2 Tu S, Johnson SL.Clonal analyses reveal roles of organ founding stem cells, melanocyte stem cells and melanoblasts in establishment, growth and regeneration of the adult zebrafish fin[J].Development, 2010, 137(23):3931-3939.
3 Adameyko I, Lallemend F, Aquino JB, et al.Schwann cell precursors from nerve innervation are a cellular origin of melanocytes in skin[J].Cell, 2009, 139(2):366-379.
4 Dupin E, Sommer L.Neural crest progenitors and stem cells: From early development to adulthood[J].DevBiol, 2012, 366(1, SI):83-95.
5 Mort RL, Jackson IJ, Patton EE.The melanocyte lineage in development and disease[J].Development, 2015, 142(4):620-632.
6 Botchkareva NV, Khlgatian M, Longley BJ, et al.SCF/c-kit signaling is required for cyclic regeneration of the hair pigmentation unit[J].FASEB J, 2001, 15(3):645-658.
7 Nishimura EK, Suzuki M, Igras V, et al.Key roles for transforming growth factor beta in melanocyte stem cell maintenance[J].Cell Stem Cell, 2010, 6(2):130-140.
8 Nishimura EK.Melanocyte stem cells: a melanocyte reservoir in hair follicles for hair and skin pigmentation[J].Pigment Cell Melanoma Res, 2011, 24(3):401-410.
9 Wang J, Wang Y, Luo C, et al.Accumulation of melanin in the peritoneum causes black abdomens in broilers[J].Poult Sci, 2014, 93(3):742-746.
10 Lo Cicero A, Delevoye C, Gilles-Marsens F, et al.Exosomes released by keratinocytes modulate melanocyte pigmentation[J].Nat Commun, 2015, 6:7506.
11 Alonso L, Fuchs E.The hair cycle[J].J Cell Sci, 2006, 119(Pt 3):391-393.
12 Barsh G, Cotsarelis G.How hair gets its pigmet[J].Cell, 2007, 130(5):779-781.
13 邓芳, 郭海英, 连小华, 等.毛囊黑素谱系细胞中β-catenin在毛囊周期中的表达[J].第三军医大学学报, 2011, 33(8):793-796.
14 Steingrimsson E, Copeland NG, Jenkins NA.Melanocyte stem cell maintenance and hair graying[J].Cell, 2005, 121(1):9-12.
15 Aoki H, Hara A, Motohashi T, et al.Functionally distinct melanocyte populations revealed by reconstitution of hair follicles in mice[J].Pigment Cell Melanoma Res, 2011, 24(1):125-135.
16 Fuchs E.Scrathing the surface of skin development[J].Nature, 2007, 445(7130):834-842.
17 Qiu WM, Yang K, Lei MX, et al.SCF/c-kit signaling is required in12-O-tetradecanoylphorbol-13-acetate-induced migration and differentiation of hair follicle melanocytes for epidermal pigmentation [J].Cell TissueRes, 2015, 360(2):333-346.
18 Huelsken J, Vogel R, Erdmann B, et al.beta-Catenin controls hair follicle morphogenesis and stem cell differentiation in the skin[J].Cell, 2001
19 Tobin DJ, Bystryn JC.Different populations of melanocytes are present in hair follicles and epidermis[J].Pigment Cell Res, 1996, 9(6):304-310.
20 Van Neste D, Tobin DJ.Hair cycle and hair pigmentation: dynamic interactions and changes associated with aging[J].Micron, 2004, 35(3):193-200.
21 Narisawa Y, Kohda H, Tanaka T.Three-dimensional demonstration of melanocyte distribution of human hair follicles: Special reference to the Bulge area[J].ActaDermVenereol, 1997, 77(2):97-101.
22 谢光跃.黑素细胞分布规律及基因差异表达[D].武汉: 华中农业大学, 2014 .
23 Schiaffino MV.Signaling pathways in melanosome biogenesis and pathology[J].Int J Biochem Cell Biol, 2010, 42(7):1094-1104.
24 HurbainI, Geerts WJ, Boudier T, et al.Electron tomography of early melanosomes: implications for elanogenesis and the generation of fibrillar amyloid sheets[J].ProcNatlAcadSci U S A, 2008, 105(50):19726-19731.
25 Slominski A, Tobin DJ, Shibahara S, et al.Melanin pigmentation inmammalian skin and its hormonal regulation[J].Physiol Rev, 2004, 84(4):1155-1228.
26 Guo HY, Yang K, Deng F, et al.Wnt3a promotes melanin synthesis of mouse hair follicle melanocytes[J].Biochem Biophys Res Commun, 2012, 420(4):799-804.
27 Chang H, Choi H, Joo KM, et al.Manassantin B inhibits melanosome transport in melanocytes by disrupting the melanophilin-myosin Va interaction[J].Pigment Cell Melanoma Res, 2012, 25(6):765-772.
28 Thomas AJ, Erickson CA.The making of a melanocyte: the specification of melanoblasts from the neural crest[J].Pigment Cell Melanoma Res, 2008, 21(6):598-610.
29 Matsui T, Ohbayashi N, Fukuda M.The Rab interacting lysosomalprotein(RILP)homology domain functions as a novel effector domain for small GTPase Rab36:Rab36 regulates retrograde melanosome transport in melanocytes[J].J BiolChem, 2012, 287(34):28619-28631.
30 Wu XS, Masedunskas A, Weigert RA, et al.Melanoregulin regulates a shedding mechanism that drives melanosome transfer from melanocytes to keratinocytes[J].ProcNatlAcadSci U S A, 2012, 109(31):E2101-E2109.
31 Ando H, Kondoh H, Ichihashi M, et al.Approaches to identify inhibitors of melanin biosynthesis via the quality control of tyrosinase [J].Journal of investigative dermatology, 2007, 127(4):751-761.
32 Dooley CM, Mongera A, Walderich B, et al.On the embryonic origin of adult melanophores: the role of ErbB and Kit signalling in establishing melanophore stem cells in zebrafish[J].Development, 2013, 140(5):1003-1013.
33 Hoogduijn MJ, Cemeli E, Ross K, et al.Melanin protects melanocytes and keratinocytes against H2O2-induced DNA Strand breaks through its ability to bind Ca2+[J].Exp Cell Res, 2004, 294(1):60-67.
34 White RM, Zon Li.Melanocytes in development, regeneration, and cancer[J].Cell Stem Cell, 2008, 3(3):242-252.
35 Wong G, Gupta R, Dixon KM, et al.1,25 Dihydroxyvitamin D and three low-calcemic analogs decrease UV-induced DNA damage via the rapid response pathway[J].J Steroid Biochem Mol Biol, 2004, 89-90(1-5):567-570.
36 Pavel S, Van Nieuwpoort F, Van Der Meulen H, et al.Disturbed melanin synthesis and chronic oxidative stress in dysplastic naevi[J].Eur J Cancer, 2004, 40(9):1423-1430.
37 Choi SY, Kim S, Hwang JS, et al.Benzylamide derivative compound attenuates the ultraviolet B-induced hyperpigmentation in the brownish Guinea pig skin[J].Biochem Pharmacol, 2004, 67(4):707-715.
38 Lin SJ, Jee SH, Hsaio WC, et al.Formation of melanocyte spheroids on the chitosan-coated surface[J].Biomaterials, 2005, 26(12):1413-1422.
39 耿建军, 穆晓丽, 孙乐天, 等.内皮素受体B在不同毛色羊驼皮肤中的表达与定位[J].畜牧兽医学报, 2010, 41(11):1478-1484.
40 Dorshorst B, Molin AM, Rubin CJ, et al.A complex genomic rearrangement involving the endothelin 3 locus causes dermal hyperpigmentation in the chicken[J].PLoS Genet, 2011, 7(12):e1002412.
41 Saldana-Caboverde A, Kos L.Roles of endothelin signaling in melanocyte development and melanoma[J].Pigment Cell Melanoma Res, 2010, 23(2):160-170.
42 王大光, 朱文元, 马慧军, 等.人毛囊无黑素黑色素细胞培养的纯化和培养基成分对细胞影响的实验研究[J].临床皮肤科杂志, 2004, 33(2):80-83.
43 Tang J, Li Q, Cheng B, et al.Effects of diethylstilbestrol on the proliferation and tyrosinase activity of cultured human melanocytes[J].Biomed Rep, 2015, 3(4):499-502.
44 Motokawa T, Miwa T, Mochizuki M, et al.Adrenomedullin: a novel melanocyte dendrite branching factor[J].J DermatolSci, 2015, 79(3):307-310.
45 Hwang I, Park JH, Park HS, et al.Neural stem cells inhibit melanin production by activation of Wnt inhibitors[J].J Dermatol Sci, 2013, 72 (3):274-283.
46 白瑞, 于志慧, 范瑞文, 等.羊驼皮肤黑素细胞体外培养鉴定[J].畜牧兽医学报, 2014, 44(4):549-556.
47 Hu DN, Mccormick SA, Seedor JA, et al.Isolation, purification and cultivation of conjunctival melanocytes[J].Exp Eye Res, 2007, 84(4):655-662.
48 屈颖, 齐浩.黑素细胞的分离与培养综述[J].西安文理学院学报(自然科学版), 2005, 8(4):12-15.
Progress in biology and in vitro culture of hair follicle-derived melanocytes
Fan Ruirui1,2, Liu Feilin3, Hao Deshun4, Zhang Qi1, Zhang Yingyao1, Zheng Tong1, Li Shilun5, Wang Hongyan6, Qi Liangchen7, Liu Jinyu1.1Department of Toxicology, School of Public Health,4Department of Pathology, School of Basic Medical Sciences, Jilin University, Changchun 130021, China;2Department of Pathology, The First Hospital of Nanping, Nanping 353000, China;3The Second Affiliated Hospital of Jilin University, Ophthalmic hospital, Changchun 130021, China;5Department of Oncology, Lishu First People's Hospital, Siping 136500, China;6Department of Obstetrics and Gynecology, Jilin General Hospital of Armed Police Force, Changchun 130021, China;7Department of Thoracic Surgery, China-Japan Friendship Hospital, Jilin University, Changchun 130021, China
Corresponding author: Liu Jinyu, Email:jy_liu@jhu.edu.cn
Melanocytes are main cells in the vertebrate for staining skin and fair and locate in hair follicles and epidermis during embryonic development.They account for about 10﹪of basal cell.There are a small number of melanocytes in hair follicle, choroid membranes and vasa aurisinternae.The decrease of cell number or dysfunction of melanocytes will results in pigment disorders.Research about melanocytes in epidermis of skin is abundant and the culture technique is mature.However, no theory is widely accepted for hair color fading.Melanocytes in hair follicles can produce melanin to protect the skin from ultraviolet light radiation, and home to the skin posttransplant.These evidences provide theoretical and experimental basis for the treatment of pigment disorder.We review the current progress and future direction about the biological characteristics and cultivation technique of hair follicle-derived melanocytes.
Hair Follicle; Melanocytes; Biology; Cell culture techniques
2016-10-07)
(本文编辑:陈媛媛)
10.3877/cma.j.issn.2095-1221.2017.02.010
130021 长春,吉林大学公共卫生学院毒理教研室1,基础医学院病理教研室4;353000 南平,福建医科大学附属南平市第一医院病理科2;130021 长春,吉林大学附属第二医院院眼科3;136500 四平,梨树县第一人民医院肿瘤科5;130021 长春,武警吉林总队医院妇产科6;130021 长春,吉林大学中日联谊医院胸外科7
刘晋宇,Email:jy_liu@jlu.edu.cn
樊蕊蕊,刘菲琳,郝德顺,等.毛囊源性黑色素细胞的生物学特性及其体外培养技术研究进展[J/CD].中华细胞与干细胞杂志(电子版),2017,7(2):117-123.

