脐带血单个核细胞对大鼠帕金森病的治疗效果观察
陈超段婧申爱芳王伟宋昊芦现杰王晓兵韩忠朝韩发彬
脐带血单个核细胞对大鼠帕金森病的治疗效果观察
陈超1段婧1申爱芳2王伟1宋昊1芦现杰1王晓兵2韩忠朝3,4韩发彬1
目的 探讨人体脐带血单个核细胞(HUCB-MNC)对大鼠帕金森病(PD)的治疗效果和作用机制。方法 6-OHDA诱导产生大鼠PD模型,随机分为两组,一组移植从新生儿脐带血中分离HUCB-MNC细胞,另一组移植PBS作为对照,根据运动转圈数和转棒实验评估大鼠在细胞移植后不同时间的运动行为情况,移植16周后取出大脑进行冰冻切片,免疫荧光染色确定移植的细胞分化情况。动物行为采用Two-way ANOVA统计方法分析。结果 转圈实验显示,PD大鼠移植HUCB-MNC细胞4、8、12、16周后,注射阿朴吗啡产生的转圈比率分别为0.529±0.121、0.457±0.096、0.369±0.089、0.264±0.091,而对照组4、8、12、16周转圈比率分别为0.843±0.158、0.812±0.156、0.736±0.103、0.714±0.160,与对照组相比,移植细胞组转圈数明显减少,差异有统计学意义(t = 4.377,5.561,6.835,6.071,P均< 0.01);转棒实验显示,移植细胞大鼠在4、8、12、16周棒上持续时间分别为(46.333±2.082)s、(63.667±4.041)s、(76.667±7.638)s、(126±12.166)s,而对照组相应周数棒上持续时间分别为(29.250±5.560)s、(26.750±8.655)s、(34.250±10.905)s、(47.500±6.856)s,与对照组相比,移植细胞组棒上持续时间明显延长,差异有统计学意义(t = 4.966,6.189,5.707,10.990,P均 < 0.01)。通过用人特异性细胞核抗体HNuc,神经细胞标志物Tuj1,和多巴胺神经元抗体TH染色,发现移植物HNuc、Tuj1、TH染色阳性。结论 HUCB-MNC细胞可以分化为神经元和多巴胺神经元,减少PD大鼠阿朴吗啡诱导的转圈数,延长大鼠在转棒上的持续时间,改善PD大鼠模型的运动缺陷。
脐血干细胞移植; 单核细胞; 帕金森病; 细胞分化; 多巴胺; 神经元
帕金森病(Parkinson's disease,PD)患者以黑质中多巴胺神经元的缺失为病理特征。细胞的生物疗法有望替代缺失的神经元,并且恢复PD患者的运动功能。过去研究表明使用胎脑神经干细胞(neural stem cells,NSC)和胚胎干细胞(human embryonic stem cells,hESC)可以治疗PD动物模型和PD患者[1-3]。近年来利用体细胞重编程技术产生的人体多能干细胞(induced pluripotent stem cells,iPS)已经可以高效率地分化成神经干细胞和多巴胺神经元。iPS细胞移植到动物模型后可以分化成神经干细胞和多巴胺神经元,移植的神经元可以存活,并且大鼠PD模型的运动缺陷得到改善[4-5]。然而在临床应用中,hESC和NSC细胞存在伦理问题和免疫排斥反应,iPS细胞由于外源基因的整合可能会有致瘤性。自体细胞如骨髓间充质干细胞(bonemarrowmesenchymal stem cells,BM-MSC)移植治疗PD克服了免疫排斥和伦理学的障碍。研究表明,MSC细胞在治疗动物PD模型和患者方面有良好的效果[6-7]。
脐带血单个核细胞(human umbilical cord blood mononuclear cells,HUCB-MNC)可以经济便捷地从人体脐带血中分离出来,并且它富含多种干细胞,这些特点使得HUCB-MNC成为一种可以治疗神经退行性疾病很有潜力的细胞[8-9]。人体脐带血分离得到的HUCB-MNC细胞含有很多种干细胞,比如造血干细胞、内皮干细胞、淋巴母细胞、小胚胎干细胞、白细胞、内皮细胞、淋巴细胞和骨髓细胞[10]。最新研究表明,HUCB-MNC可以治疗神经系统疾病,比如中风和动物模型的外伤性脑损伤[11-13]。然而并没有令人信服的证据表明移植的HUCB-MNC细胞分化成了神经元。
一些研究表明,HUCB-MNC中还含有神经样干细胞,这显示HUCB-MNC移植是一种治疗神经退行性疾病很有潜力的策略[14-15]。本研究把HUCB-MNC移植到大鼠PD模型并且研究了HUCB-MNC的治疗效果。
材料与方法
一、实验材料与试剂
提供脐带血的健康志愿者经聊城市人民医院医学伦理委员会批准(批准编号2012004)并填写患者知情同意书。在无菌条件下,收集新鲜的新生儿脐带血,立即放入血袋中送达实验室。DMEM/F12、L-Glutamine、非必需氨基酸(Non-essential Amino Acid,NEAA)、胎牛血清(FBS)、成纤维细胞生长因子(fibroblast growth factor,bFGF)、TrypLE购自美国Invitrogen公司;离心管购自美国Corning公司;流式抗体购自美国BD公司;免疫荧光抗体购自德国Millipore公司;其他试剂购自美国Sigma公司。
二、实验方法
1.HUCB-MNC分离培养:新鲜收集的脐带血,在生物安全柜中用DMEM/F12进行1:1稀释。将离心机的升降速调为零,300×g离心10 min,去除上清液从而去除抗凝剂。用DMEM/F12对细胞沉淀进行清洗,然后用DMEM/F12重悬。在新的离心管中加入淋巴细胞抽提液Ficoll,缓慢在上层加入细胞悬液,使Ficoll和细胞悬液的比例为1:2。将离心机的升降速调为零,室温400×g离心35 min。离心后,小心吸取中间白膜层,再用DMEM/F12清洗1遍,室温300×g离心20 min,去除上清液,用事先配好的培养基重悬后打入T75瓶中,37 ℃、5﹪ CO2培养。
2.HUCB-MNC流式细胞鉴定:取对数生长期的细胞制备细胞悬液,PBS清洗2次后,调整细胞浓度为1×107个/ml,取100 μl细胞悬液,对照组和实验组分别加入相应抗体。实验组选用CD16、CD29、CD34、CD45、CD73和CD90,对照组选用相应同型对照抗体。
3.使用6-OHDA制作PD大鼠模型:新鲜配制10﹪水合氯醛溶液,按0.3 g/kg的用量经腹腔注射麻醉大鼠后,将大鼠固定至脑立体定位仪;将微量注射器PBS通针;于大鼠头顶部皮肤划1条长度2 ~ 3 cm的切口;暴露前后囟门,以前囟为基点,准确记录AP,ML,DV三轴的坐标,分别AP-0.2,ML-0.2,DV-0.80定位大鼠黑质位置,小心钻颅;用微量注射器抽取0.1﹪抗坏血酸溶液稀释成5 mg/ml的6-OHDA溶液,由钻孔处进针,达到计算位置;每只大鼠4 μl。进液完成后留针6 ~10 min,同时观察大鼠状态;撤针缝皮,小心将大鼠平放入新笼中。
4.移植细胞:注射过6-OHDA的大鼠,经阿朴吗啡诱导后在30 min内转圈数超过200圈,即为PD模型,用于之后的移植实验。共选择16只PD大鼠用于移植实验,分两组:随机抽取8只接受了纹状体处的HUCB-MNC移植(移植组,实验过程中1只死亡),另外8只则用PBS代替HUCB-MNC实行了同样的操作(对照组,实验过程中1只死亡)。成模大鼠,按上述方法麻醉后,将大鼠固定至脑立体定位仪;将微量注射器PBS通针后;于大鼠头顶部皮肤划1条长度2 ~ 3 cm的切口;暴露前后囟门,以前囟为基点,准确记录AP,ML,DV三轴的坐标,选取两处移植位点,坐标分别为:以前囟为基点,AP +0.07/-0.2,ML -0.3/-0.4,DV -0.5/-0.55,小心钻颅;混匀细胞悬液,用微量注射器抽取所需剂量,由钻孔处进针,达目的位置;每孔注射细胞4 ~ 5 μl,同时观察大鼠状态;撤针缝皮,小心将大鼠平放入新笼中。从移植前2 d开始一直到移植实验结束,所有实验PD大鼠每天都要注射相应剂量的环孢菌素以减少机体对移植物的排斥反应。
5.行为评估:转圈实验(rotation)是将阿朴吗啡皮下注射3 min后,大鼠被放到一个塑料盆里并记录它们的转圈数量;转棒实验(Rotarod)是把动物放在一个转动的木棒(Columbus Instruments,Columbus,USA)上,看动物坚持的时间。先将动物放在低速旋转的木棒上(2 ~ 4转/min),3 ~ 4次训练后,将转数提高到9转/min,并检测动物持续时间。计算移植组和对照组在移植后第4周、第8周、第12周和第16周的单位时间转圈比率和转棒持续时间,看两者之间是否存在显著性差异。
6.免疫组化:免疫组化实验流程参见Suzuki的文章[16],细胞移植16周后大鼠被处死,脑组织用4﹪多聚甲醛浸泡并固定24 h后,于30﹪蔗糖溶液中脱水24 ~ 48 h,然后包埋在Tissue-Tek OTC中并用低温切片机切成20 μm的薄片。切片分别用人细胞核抗体hNUC、人神经细胞标志分子Tuj1抗体、多巴胺能神经元标志分子TH抗体以及神经胶质细胞标志分子GFAP抗体4 ℃过夜孵育。用PBS冲洗之后,用荧光标记的二抗Alexa Fluor 488或者Cy3室温孵育3 ~ 4 h,然后用细胞核抗体Hoechest 33258孵育2 ~ 5 min。用荧光显微镜或者激光扫描共聚焦显微镜观察结果。
三、统计学分析方法
采用Graphpad Prism 6.0软件进行统计分析。流式细胞表达率采用±s表示,动物行为采用Two-way ANOVA和非配对t检验统计方法分析。以P < 0.05为差异有统计学意义。
结 果
一、HUCB-MNC流式细胞分析
HUCB-MNC含有多种不同类型的细胞,包括淋巴细胞,单核细胞,造血干细胞,间充质干细胞和内皮祖细胞,检测HUCB-MNC的表面标志物,来确定细胞组成。分离HUCB-MNC后,立即将细胞分成两部分,一部分冻存于液氮,另一部分做流式检测,检测了3份不同的脐血样品。CD16,CD29,CD34,CD45,CD73,和CD90的值分别是(31.90± 3.67)﹪,(71.50±0.56)﹪,(3.05±1.06)﹪,(91.65± 9.69)﹪,(18.90±4.38)﹪,和(43.70±0.42)﹪,提示大部分细胞为表达CD45,CD29和CD90的淋巴细胞、单核细胞,另外还有低表达CD34的造血干细胞(图1)。
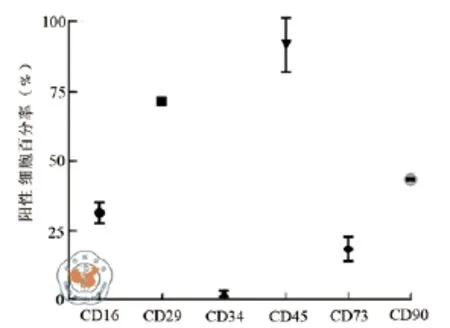
图1 三种HUCB-MNC样本表面标记物平均表达率的流式检测
二、HUCB-MNC移植对6-OHDA诱导的帕金森大鼠模型的影响
研究发现PD大鼠移植HUCB-MNC细胞4周、8周、12周、16周后,注射阿朴吗啡产生的转圈比率,与对照组相比,移植细胞组转圈比率明显减少,差异有统计学意义(P < 0.01,表1);转棒实验显示移植细胞大鼠在4周、8周、12周、16周棒上持续时间,与对照组相比,移植细胞组棒上持续时间明显延长,差异有统计学意义(P < 0.01,表2)。
表1 两组PD大鼠移植后不同时间点转圈比率比较(±s)
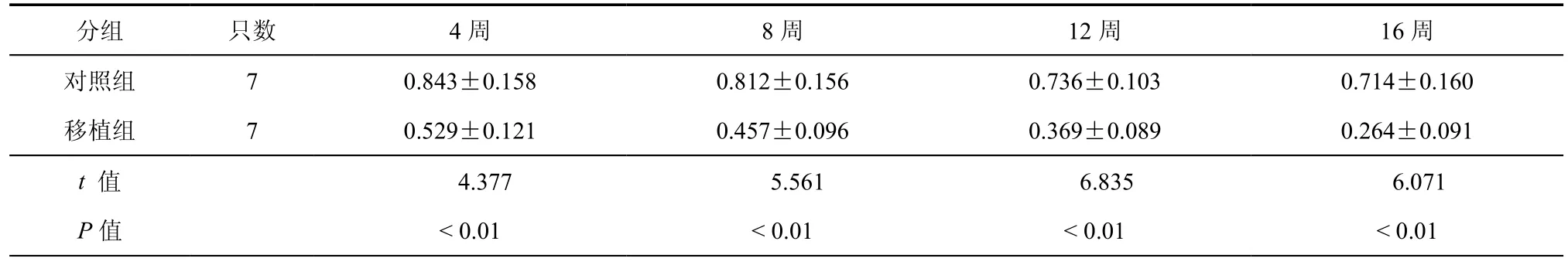
表1 两组PD大鼠移植后不同时间点转圈比率比较(±s)
分组 只数 4周 8周 12周 16周对照组 7 0.843±0.158 0.812±0.156 0.736±0.103 0.714±0.160移植组 7 0.529±0.121 0.457±0.096 0.369±0.089 0.264±0.091 t 值 4.377 5.561 6.835 6.071 P值 < 0.01 < 0.01 < 0.01 < 0.01
表2 两组PD大鼠移植后不同时间点棒上持续时间比较(s,±s)
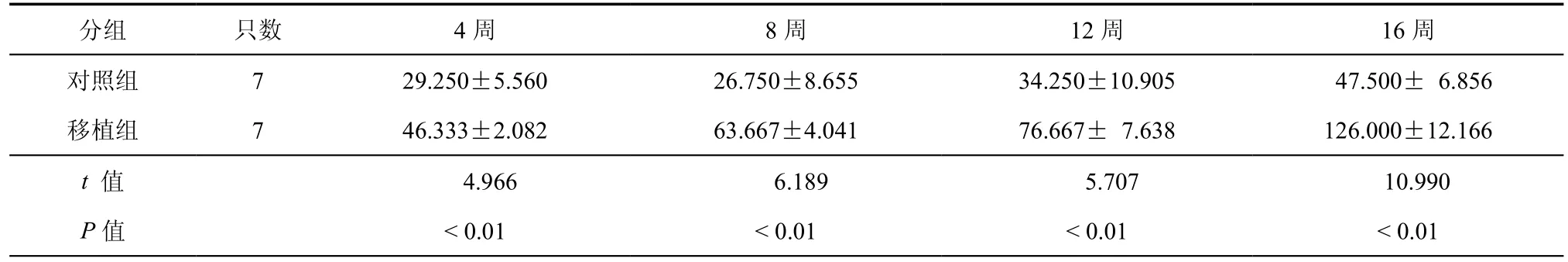
表2 两组PD大鼠移植后不同时间点棒上持续时间比较(s,±s)
分组 只数 4周 8周 12周 16周对照组 7 29.250±5.560 26.750±8.655 34.250±10.905 47.500± 6.856移植组 7 46.333±2.082 63.667±4.041 76.667± 7.638 126.000±12.166 t 值 4.966 6.189 5.707 10.990 P值 < 0.01 < 0.01 < 0.01 < 0.01
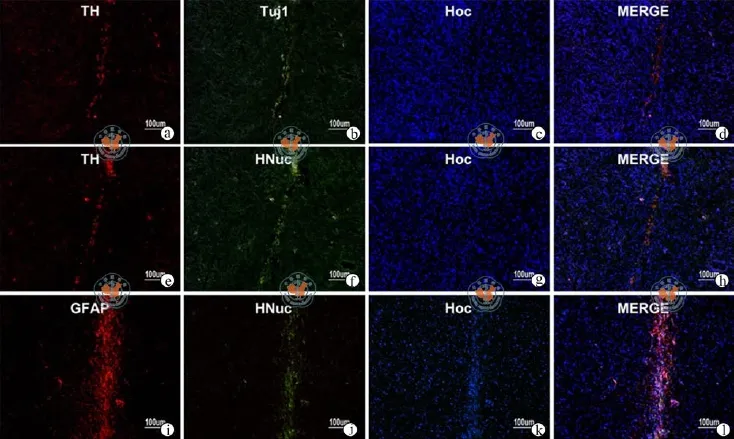
图2 荧光显微镜下脐带血单个核细胞移植术后16周的PD大鼠脑内免疫组化分析(×100)
三、HUCB-MNC在大鼠脑内的存活和神经分化能力
为了研究HUCB-MNC在大鼠体内的分化和迁移情况,将移植HUCB-MNC 16周后的大鼠处死,并将其大脑相应部位进行冰冻切片和免疫荧光染色分析。通过用人特异性细胞核抗体HNuc,神经细胞标志物Tuj1,和多巴胺神经元抗体TH染色,发现移植物HNuc、Tuj1、TH染色阳性,HUCB-MNC在大鼠体内成功的分化成了神经细胞以及多巴胺能神经元(图2)。
讨 论
分离HUCB-MNC并移植到6-OHDA损伤的PD模型,发现HUCB-MNC能够明显改善PD大鼠的运动障碍行为,表明HUCB-MNC能够作为治疗帕金森病的潜在细胞来源。
研究报道,HUCB-MNC细胞含有很多种干细胞,比如造血干细胞、内皮祖细胞、淋巴母细胞、小胚胎干细胞、白细胞、内皮细胞、淋巴细胞和骨髓细胞。为了解HUCB-MNC的细胞组成情况,本研究用流式细胞分析发现多数HUCB-MNC细胞表达CD45,CD29和CD90,但表达CD34的造血干细胞百分数比较低。最近的研究表明外周血中表达CD45的胰岛素产生细胞(PB-IPCs)能够被诱导成神经星形胶质细胞样细胞,这类独特的CD45+细胞可能对于神经退行性疾病患者中枢神经系统起到一定的保护作用[17],进一步证实实验研究结果的可重复性。尽管没有研究表明造血干细胞能够在体外分化为神经细胞,但是一些研究表明造血干细胞在补充了促血小板生成素、flt-3配体以及c-kit配体的培养基(TPOFLK)中能够分化为神经干细胞[18]。另有研究报道HUCB-MNC中含有一定数目的神经干细胞和小胚胎干细胞[11],可能对于HUCB-MNC移植后的神经分化起一定作用。
细胞移植后大鼠转圈比率随时间呈现稳定的下降的趋势,且在转棒上持续时间逐渐延长,与对照相比具有显著性差异,提示HUCB-MNC细胞移植对于治疗大鼠PD模型具有比较显著的效果。但由于对照组大鼠的个体差异产生的统计标准差较大,因此在选择PD模型大鼠进行实验时,应当尽可能选择转圈数基本相似的分为同一实验组进行移植实验。
本研究发现,HUCB-MNC细胞移植后能够在大鼠脑内存活并分化成神经细胞和多巴胺神经元,提示HUCB-MNC中的细胞组分具有神经分化能力。为排除多巴胺神经元来自于宿主大鼠,用人体特异的HNuc抗体和多巴胺神经元抗体TH对组织切片进行共染分析,证实多巴胺神经元来自于移植的人体细胞。其他的实验研究结果证实,分化的细胞和移植存活细胞的比例一般在20﹪~ 30﹪[4],提示如何提高移植细胞的存活率和分化效率,仍是细胞移植治疗亟待解决的问题。有研究报道,HUCB-MNC在动物脑内的神经分化,可能受到宿主脑内局部微环境的影响[19]。在中风[20]、多系统萎缩[21]、脊髓损伤[22]等疾病模型的研究中发现,HUCB-MNC可以迁移到受损的大脑区域,通过替代受损的神经元、改善局部的大脑微环境、降低炎症、促进血管和神经再生发挥治疗作用。
本研究发现,HUCB-MNC可以分化为神经元和多巴胺神经元,对PD大鼠具有一定的治疗作用。此研究提示,针对PD等神经退行性疾病而言,HUCB-MNC移植是一种有潜力的细胞治疗策略。
1 Lindvall O, Kokaia Z.Prospects of stem cell therapy for replacing dopamine neurons in Parkinson's disease[J].Trends PharmacolSci, 2009, 30(5):260-267.
2 周春辉, 王晓晴, 张剑宁.干细胞移植治疗帕金森病的研究进展[J].转化医学杂志, 2013, 2(6):341-343,347
3 Barker RA, Barrett J, Mason SL, et al.Fetal dopaminergic transplantation trials and the future of neural grafting in Parkinson's disease[J].Lancet Neurol, 2013, 12(1):84-91.
4 Han FB, Wang W, Chen BX, et al.Human induced pluripotent stem cell-derived neurons improve motor asymmetry in a 6-hydroxydopamine-induced rat model of Parkinson's disease[J].Cytotherapy, 2015, 17(5):665-679.
5 Hargus G, Cooper O, Deleidi M, et al.Differentiated parkinson patientderived induced pluripotent stem cells grow in the adult rodent brain and reduce motor asymmetry in parkinsonian rats[J].Proc Natl Acad Sci U S A, 2010, 107(36):15921-15926.
6 Venkataramana NK, Kumar SK, Balaraju S, et al.Open-labeled study of unilateral autologous bone-marrow-derived mesenchymal stem cell transplantation in Parkinson's disease [J].Transl Res, 2010, 155(2):62-70.
7 Blandini F, Cova L, Armentero M, et al.Transplantation of undifferentiated human mesenchymal stem cells protects against 6-Hydroxydopamine neurotoxicity in the rat[J].Cell Transplant, 2010, 19(2):203-217.
8 Hows JM, Marsh JC, Bradley BA, et al.Human cord blood: a source of transplantable stem cells[J].Bone Marrow Transplant, 1992, 9(1):105-108.
9 Yang WZ, Zhang Y, Wu F, et al.Safety evaluation of allogeneic umbilical cord blood mononuclear cell therapy for degenerative conditions[J].J Transl Med, 2010, 8:75.
10 Weiss ML, Troyer DL.Stem cells in the umbilical cord [J].Stem Cell Rev, 2006, 2(2):155-162.
11 Karlupia N, Manley NC, Prasad K, et al.Intraarterial transplantation of human umbilical cord blood mononuclear cells is more efficacious and safer compared with umbilical cord mesenchymal stromal cells in a rodent stroke model[J].Stem Cell Res Ther, 2014, 5(2):45.
12 Rodrigues LP, Iglesias D, Nicola FC, et al.Transplantation of mononuclear cells from human umbilical cord blood promotes functional recovery after traumatic spinal cord injury in Wistarrats[J].Braz J Med Biol Res, 2012, 45(1):49-57.
13 Chen J, Sanberg PR, Li Y, et al.Intravenous administration of humanumbilical cord blood reduces behavioral deficits after stroke in rats[J].Stroke, 2001, 32(11):2682-2688.
14 Domanska-Janik K BL, Lukomska B.A novel, neural potential of nonhematopoietic human umbilical cord blood stem cells[J].Int J DevBiol, 2008, 52(2/3):237-248.
15 Zangiacomi V, Balon N, Maddens S, et al.Human cord blood-derived hematopoietic and neural-like stem/progenitor cells are attracted by the neurotransmitter GABA [J].Stem Cells Dev, 2009, 18(9):1369-1378.
16 Suzuki M, Mchugh J, Tork C, et al.GDNF secreting human neural progenitor cells protect dying motor neurons, but not their projection to muscle, in a rat model of familial ALS [J].PLoS One, 2007, 2(8):e689.
17 Li H, Li J, Sheng WH, et al.Astrocyte-like cells differentiated from a novel population of CD45-positive cells in adult human peripheral blood [J].Cell BiolInt, 2015, 39(1):84-93.
18 Mcguckin CP, Forraz N, Allouard Q, et al.Umbilical cord blood stem cells can expand hematopoietic and neuroglial progenitors in vitro[J].Exp Cell Res, 2004, 295(2):350-359.
19 Chen N, Kamath S, Newcomb J, et al.Trophic factor induction of human umbilical cord blood cells in vitro and in vivo [J].J Neural Eng, 2007, 4(2):130-145.
20 Newcomb JD, Ajmo CT, Sanberg CD, et al.Timing of cord blood treatment after experimental stroke determines therapeutic efficacy[J].Cell Transplant, 2006, 15(3):213-223.
21 宫殿荣, 于海燕, 赵敏, 等.寰枕间隙侧方穿刺移植脐血单个核细胞治疗多系统萎缩的临床观察[J].中华细胞与干细胞杂志(电子版), 2016, 4(6):115-120.
22 Saporta S, Kim JJ, Willing AE, et al.Human umbilical cord blood stem cells infusion in spinal cord injury: engraftment and beneficial influence on behavior[J].J Hematother Stem Cell Res, 2003, 12(3):271-278.
Effects of human umbilical cord blood mononuclear cells in a rat model of Parkinson's disease
Chen Chao1, Duan Jing1, Shen Aifang2, Wang Wei1, Song Hao1, Lu Xianjie1, Wang Xiaobing2, Han Zhongchao3,4, Han Fabin1.1Center for Stem Cells and Regenerative Medicine,2Department of Gynecology and Obstetrics, the Liaocheng People's Hospital, Affiliated Liaocheng Hospital, Taishan Medical University, Liaocheng 252000, China;3the State Key Laboratory of Experimental Hematology, Institute of Hematology and Hospital of Blood Diseases, Chinese Academy of Medical Sciences, Peking Union of Medical College, Tianjin 300020, China;4National Engineering Research Center of Cell Products, Tianjin 300020, China
Han Fabin, Email: fhan2013@126.com
Objective To explore whether human umbilical cord blood mononuclear cells(HUCB-MNC)transplantation could treat Parkinson's disease(PD).Methods 6-OHDA-lesioned PD rats were divided into two groups randomly: one group was treated with HUCB-MNCs, which were isolated from umbilical cord and the other group was treated with PBS as control.Apomorphineinduced rotation test was used to evaluate the motor behavior of the rats at different times after celltransplantation.Immunochemistry was conducted to confirm the differentiation of the grafted cells in the brain.Results The rates of apomorphine-induced rotation were 0.529±0.121, 0.457±0.096, 0.369 ±0.089, and 0.264±0.091 at 4, 8, 12, and 16 weeks after transplantation respectively, which were significantly lower than those of the control group(0.843±0.158, 0.812±0.156, 0.736±0.103, and 0.714±0.160 respectively).And the duration time on rotation rod of the treatment group were(46.333 ±2.082)s,(63.667±4.041)s,(76.667±7.638)s, and(126±12.166)s respectively for each time points, while those of the control group were(29.250±5.560)s, (26.750±8.655)s,(34.250 ±10.905)s, and(47.500±6.856)respectively.Immunochemistry assay showed that the grafted HUCB-MNC expressed neuron maker Tuj1 and dopamine neuron maker TH.Conclusion Our study shows that transplanted HUCB-MNCs may differentiate into neurons and dopamine neurons and alleviate motor dysfunction of PD rats.
Cord blood stem cell transplantation; Monocytes; Parkinson disease; Cell differentiation; Dopamine; Neurons
2016-09-24)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2017.02.002
山东省科技发展计划(2012 GSF11808);山东省自然科学基金(ZR2015HL045)
252000 聊城市人民医院 泰山医学院聊城临床学院干细胞与再生医学实验室1,妇产科2;300020天津,中国医学科学院,协和医科大学血液学研究所实验血液学国家重点实验室3;300020 天津,国家干细胞工程技术研究中心4
韩发彬,Email:fhan2013@126.com
陈超,段婧,申爱芳,等.脐带血单个核细胞对大鼠帕金森病的治疗效果观察[J/CD].中华细胞与干细胞杂志(电子版),2017,7(2):71-76.

