两种人脐带间充质干细胞源外泌体分离方法的比较
刘高米洋潘兴华和法莲陆容刘菊芬何洁王红阳
两种人脐带间充质干细胞源外泌体分离方法的比较
刘高米洋1,2潘兴华2和法莲3陆容4刘菊芬2何洁2王红阳1
目的 探索人脐带间充质干细胞(hUMSCs)来源的外泌体的最佳分离条件并对其进行生物学鉴定。方法 无血清培养法培养hUMSCs,培养上清中收集外泌体,超高速离心法(ult-exo)和沉淀法分离外泌体(pri-exo),Western Blot检测外泌体标志性蛋白CD63、HSP70、HSP90和阴性对照蛋白TAPA1,透射电镜观察分离所得外泌体生物学形态,高清晰质谱分析外泌体包裹蛋白种类。结果 无血清培养法能够在不改变细胞生物学形态的条件下获取hUMSCs源外泌体,透射电镜下可见超高速离心可以获得具有典型双层膜结构的外泌体,大小在100 nm左右,而沉淀法分离所得产物不具有典型的外泌体形态表征,大小在30 nm左右;Western Blot结果表明超高速离心法所得外泌体CD63、HSP70、HSP90均呈现阳性,阴性对照蛋白TAPA1呈现阴性,沉淀法只能检测到HSP90;高清晰质谱检测出超高速离心法分离所得外泌体有169种蛋白,沉淀法有102种,共有蛋白79种。结论 超高速离心法和沉淀法所得外泌体在蛋白标志物、生物学形态和内含蛋白种类均有差别,本实验结果提示分离hUMSCs源外泌体超高速离心法优于沉淀法。
脐带; 间质干细胞; 外泌体; 分离; 鉴定
间充质干细胞(mesenchymal stem cells,MSCs)是一种来自中胚层间充质,具有多向分化潜能的成体干细胞,主要存在于全身结缔组织和器官间充质[1-2]中。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUMSCs)从分娩后的废弃组织脐带中分离和培养,脐带中的华通氏胶不但含有丰富的MSCs,且其来源的细胞在形态学、扩增能力、分化功能以及表面标志物等生物学鉴定结果都符合间充质干细胞的标准[3],是目前最具有转化应用前景的间充质干细胞。研究表明,脐带间充质干细胞能够修复损伤组织[4],改善或者治疗多种免疫系统疾病[5],但其长期植入体内存在细胞分化不良和潜在促进肿瘤转化的缺点[6],限制了hUMSCs的临床转化的步伐。
近年来,研究发现外泌体(exosomes)是由活细胞释放,直径30 ~ 100 nm,含有来源细胞的胞膜、蛋白质、miRNA和lncRNA等成分,通过膜融合进行物质传输和信号转导[7]。Lai等[8]发现MSCs分泌的外泌体中包含多种活性蛋白质参与细胞结构的维持、运动、信息交流以及组织的修复与再生。因此推测,MSCs的外泌体有可能成为一种替代细胞治疗的新手段和药物载体。研究表明:MSCs是目前发现分泌外泌体能力最强的细胞[9],MSCs源外泌体能够保护肾脏,修复药物、肾切除等导致的肾损伤[10],减轻心肌缺血/再灌注(I/R)损伤[11],保护内毒素诱导的肺损伤[12],通过转运miRNA-133b到神经组织以保护神经系统[13],并通过转运多种抗炎因子起到免疫调节的作用[14]。但外泌体的分离鉴定方法依然是限制外泌体应用的最大难点,国内相关的研究也相对较少,因此本研究对比两种分离纯化hUMSCs来源外泌体的方法,旨在为MSCs来源外泌体的临床转化应用提供实验依据。
材料与方法
一、材料
DMEM/F12培养基(美国BI公司),胎牛血 清(美 国BI公 司),Anti-CD63 antibody、Anti-CD9 antibody、Anti-hsp90 antibody、anti-hsp70 antibody、Anti-TAPA1 antibody、兔anti Mouse IgG H&L(HRP)、羊 anti Rabbit IgG H&L(HRP)(美国Abcam公司),牛血清白蛋白(美国Sigma公司),BCA蛋白定量试剂盒(美国Thermo fisher公司),快速银染试剂盒(中国碧云天公司),百万层级层流超净工作台(SW-CL-2F型,苏州佳宝净化工程设备有限公司),细胞培养37℃,CO2孵箱(美国Thermo公司),电泳槽(美国Bio-rad公司),倒置相差显微镜(日本奥林巴斯公司),多功能酶标仪(美国Biotek公司),超高速离心机(日本日立公司),exosome isolation kit(美国101bio公司)。
二、主要方法
1.hUMSCs分离和培养:在产妇及其家属知情同意并通过医院伦理审查(编号:2012009)情况下,取本院足月剖腹产新生儿脐带,产妇无传染性疾病,胎儿无先天性疾病和畸形。生理盐水反复冲洗以去除脐带残留血液。将脐带剪碎后转移到培养瓶中,用含20﹪FBS的DMEM/F12培养基培养,次日补液,3 d后换液,7 d后观察细胞生长状态,达到80﹪融合后传代培养。
2.hUMSCs源外泌体的提取和分离:待第4 ~6代huMSCs融合率为80﹪~ 90﹪时,无血清培养24 h后收集培养上清4 ℃保存待用。超速离心法分离外泌体如下:4 ℃条件下2 000×g离心10 min取上清液,10 000×g离心30 min取上清液,100 000×g离心90 min,小心弃上清液,收集底部沉淀用PBS溶解稀释后,再次100 000×g离心90 min,洗涤1次,弃上清液,PBS重悬,-80 ℃冻存。沉淀法按照101bio试剂盒说明书操作,纯化后所得外泌体-80 ℃冻存。
3.外泌体生物学形态观察:铜网上加入样本10 μl,吸附1 ~ 2 min,滤纸条垂直于液面吸走液体,干燥1 min,加入染色剂醋酸双氧铀染色1 min,干燥后透射电镜下观察形态并拍照。
4.外泌体蛋白质质谱分析:外泌体中加入SDT裂解液冰上裂解15 min,煮沸10 min,超声破碎(25 Hz)1 min,13 680×g四度离心10 min,取上清BCA法定量蛋白,FASP法酶解蛋白,NanoDrop定量肽段,随后进行LC-MS/MS分析。
5.银染检测EXO蛋白:SDT或者RIPA裂解液将外泌体冰上裂解并超声,4℃ 13 680×g离心10 min去除沉淀,收集上清获得外泌体蛋白样本,BCA法定量后取3 μg蛋白进行SDS-PAGE电泳,随后按照碧云天快速银染试剂盒提供的使用说明书操作,拍照并保存。
6.Western Blot:去除细胞培养基后用预冷的PBS洗2次,加适量RIPA裂解液冰上裂解10 min,超声破碎细胞(25 Hz,1 min),13 680×g四度离心10 min;取上清BCA法定量蛋白;将配置好的蛋白样本至于100 ℃恒温加热器上变性10 min后冰上放置;进行SDS-PAGE蛋白电泳;半干转将蛋白转移至硝酸纤维素膜;室温封闭1 h;TBST洗膜2 ~ 3次,每次5 ~ 10 min ;室温孵育一抗2 ~ 3 h或者4 ℃孵育过夜,回收抗体后,TBST洗3次,每次5 min;室温孵育二抗1.5 ~ 2 h或者4 ℃孵育过夜,回收抗体后,TBST洗3次,每次5 ~ 10 min;ECL法显色,拍照,保存数据。
结 果
一、hUMSCs的分离培养
组织块直接贴壁法培养hUMSCs次日即可看见少许细胞贴壁(图1a),3 ~ 5 d后可见细胞爬出(图1b),传代后的细胞转移时呈纤维样(图1c),稠密呈漩涡状生长(图1d)。
二、hUMSCs源外泌体生物学形态
为了不破坏外泌体原有形态并保持其典型双层膜结构,将分离得到的外泌体取30 μl分装存于4 ℃备用(不超过3 d)。按照负染法将超离法和沉淀法所得外泌体进行制样,透射电镜下观察2种不同分离方法所得外泌体形态可见,超速离心法分离所得外泌体直径为100 nm左右,具有典型的杯状结构(图2a),沉淀法所得外泌体直径为30 nm左右,形态为规则的圆形,不能观察到典型的杯状结构(图2b)。
三、银染检测exosome蛋白
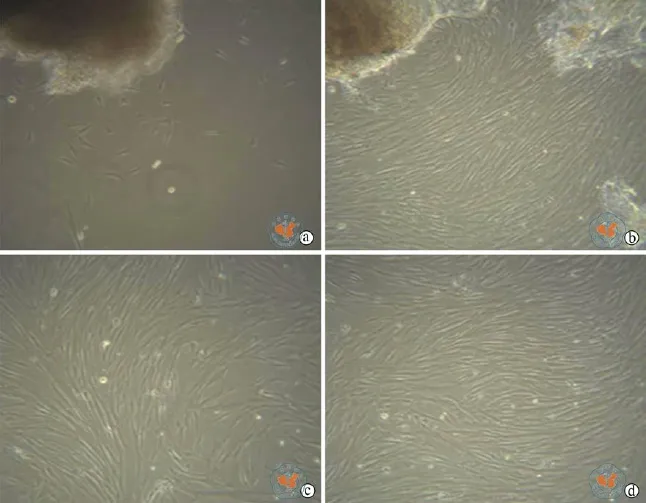
图1 倒置显微镜下观察人脐带间充质干细胞的生长形态(×40)
银染的灵敏度可达0.3 ng蛋白,而考马斯亮蓝染色是灵敏度为100 ng蛋白,因此我们采用银染而非考马斯亮蓝染色检测exosome蛋白。结果(图3)显示超速离心法(泳道1)所得外泌体蛋白丰度高于沉淀法(泳道2),在分子量20 kD以下蛋白沉淀法中基本检测不到。
四、Western Blot 检测exosome蛋白标志物
电镜和银染结果共同提示超速离心法和沉淀法所分离产物中含有多种蛋白质,因此为进一步明确所得产物是外泌体而非其他莫型囊泡结构,行Western Blot 检测所得蛋白样本是否含有外泌体阳性标志物。图4提示超高速离心法(泳道1)可以检测到外泌体阳性标志物CD63,HSP70,HSP90而阴性对照TAPA1则未被检出,沉淀法(泳道2)只能检出HSP70和HSP90,同时能杂出阴性对照TAPA1。
五、质谱分析外泌体蛋白组
本研究通过高精度质谱对超离法和沉淀法所得外泌体蛋白组进行定性定性分析,超离法(图5a)能够检测到169种蛋白质,沉淀法(图5b)能够检出102种蛋白质;对比可得两种分离方法所得外泌体中共有的蛋白质为79种(图5c)。将质谱检测结果用DAVID数据库分析uc-exo蛋白有148种蛋白被注释(表1附后),pri-exo蛋白有74种被注释(表2附后)。

图2 电镜下观察两种方法得到的外泌体形态(×67 000)
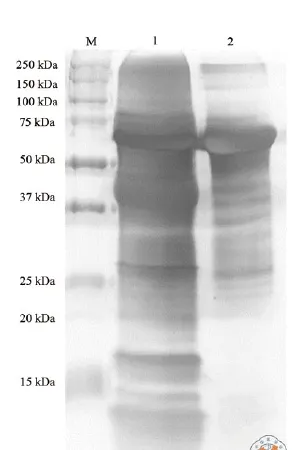
图3 银染检测外泌体蛋白丰度
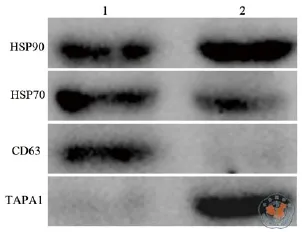
图4 Western Blot检测外泌体标志
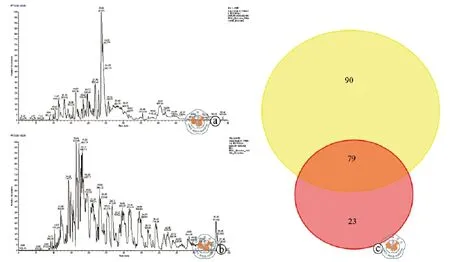
图5 高清晰质谱分析外泌体蛋白组
讨 论
外泌体的研究国内尚处于起步阶段,其分离方法是目前制约外泌体研究和应用转化的最主要因素,有研究表明细胞在不同的状态分泌的外泌体内含物不同[15],不同的分离方法得到的外泌体理化性质也不同[16],这导致了外泌体研究存在大量不可控性和难重复性。因此本研究针对hUMSCs来源的外泌体,利用最经典的多步超速离心法和目前最常见的基于PEG沉淀法的外泌体分离试剂盒对外泌体进行分离和鉴定,为hUMSCs源外泌体的基础研究和临床应用提供数据。
本研究首先通过组织块贴壁法获得原代hUMSCs,利用其贴壁生长特性多次传代培养获得纯化的脐带间充质干细胞,显微镜观察3代到6代的hUMSCs,可见典型的漩涡生长特征,并进行表面抗原鉴定,符合间充质干细胞特征。因此认为上述方法分离纯化得到的细胞为hUMSCs。为排除常规培养体系中胎牛血清中外泌体的影响,待hUMSCs贴壁生长融合率达70﹪时,去除原有培养基,PBS冲洗残留培养基上清,换为无血清培养基,继续培养hUMSCs 24 h后收集无外源外泌体污染的培养上清。采用多步超速离心法和基于沉淀法的试剂盒分别提取外泌体,投射电镜对其形态学观察可见,多步超速离心法分离纯化得到的外泌体直径约100 nm左右,其直径远大于试剂盒分离纯化得到的外泌体(直径约30 nm左右),超离所得外泌体可观察到典型的不规则立体的杯托样双层膜结构,而试剂盒所得外泌体电镜下观察不到典型双层膜结构,呈现规则的圆形或椭圆形。为进一步明确两种分离方法所得外泌体内含蛋白的差异,分别用银染,Western Blot以及高精度质谱对所得外泌体蛋白样本进行分析。银染的结果提示超离法所得外泌体蛋白丰富程度显著高于沉淀法,结合电镜观察结果可推测基于沉淀法的试剂盒分离纯化所得外泌体可能在分离纯化过程中受到破坏,损失了部分内含物。为明确上述实验分离所得产物是外泌体而非其他非外泌体囊泡,需要验证所得产物是否含有外泌体标志物同时不含有其他非外泌体囊泡标志物。目前,国际上较多学者采用4次跨膜蛋白CD63、CD9、CD81、CD82以及热激活蛋白家族的HSP90、HSP70还有多泡体生成相关蛋白Alix、TSG101为外泌体阳性标志物,而TAPA1为其他非外泌体囊泡特有标志物,因而被看做外泌体阴性标志物。通过Western Blot检测CD63,HSP90,HSP70和TAPA1可见,超离法分离所得外泌体CD63、HSP90,HSP70为阳性,TAPA1为阴性而试剂盒分离所得产物仅仅HSP90,HSP70表达且TAPA1为阳性,提示超离法能够得到较试剂盒法更纯的外泌体,试剂盒法所得产物可能不纯或者外泌体被破坏。由于Western Blot能够提供的数据有限,本研究采用高精度质谱的方法进一步分析外泌体蛋白组,以明确两种方法所得外泌体中蛋白组分的异同。质谱结果可见,本研究中hUMSCs源外泌体通过超离法分离纯化能够检测出169种蛋白质,基于沉淀法的试剂盒分离所得外泌体能够检测出102种蛋白质,其中有79中蛋白被同时检出。经生物信息学分析表明这些蛋白质参与了28种生物过程,包括外泌体生成和免疫,细胞相互作用等。在这些蛋白质中,与治疗作用相关的可能包括表面受体(PDGFRB、EGFR、PLAUR)、信号分子(RRAS/NRAS、MAPK1、GNA13/GNA12、CDC42和VAV2)、黏附分子(FN1、EZR、IQGAP1、CD47、整合素、LGALS1/LGALS3),热激活蛋白家族成员(HSP90,HSP70,HSP60)和MSCs相关表面抗原。其中,蛋白酶体20S核心颗粒的7条α和7条β链MSCs-exo都有表达,且免疫蛋白酶体中的3个亚基表达水平较高,提示hUMSCs-exo可能具有损伤修复功能。数据表明,两种方法所得外泌体的确有较大差异。综合上述结果,不论是从形态结构,蛋白水平还是蛋白丰度,超离法均优于基于沉淀法的试剂盒。但超离法外泌体产量低,耗时长,对离心机要求高,若要进行细胞实验和动物实验还需要对器材进行灭菌处理,因而限制该方法的广泛运用。
综上所述,超离法和沉淀法相比,能够获得形态完整,纯度更高的外泌体,但产量低,
工作量大;试剂盒法虽然需要的原材料较少,但存在破坏外泌体结构,有杂蛋白污染的问题。
1 姚志成, 刘波.间充质干细胞促进肝再生的研究进展[J].中华肝脏外科手术学电子杂志, 2016(03):198-200.
2 冯文磊, 张猛, 徐芳洁, 等.共培养体系间充质干细胞对同源内皮祖细胞增殖和血管形成的影响[J].医学研究生学报, 2015(03):229-235.
3 Seshareddy K, Troyer D, Weiss ML.Method to isolate mesenchymallike cells from Wharton's Jelly of umbilical cord[J].Methods Cell Biol, 2008, 86(1):101-119.
4 Weiss ML, Medicetty S, Bledsoe AR, et al.Human umbilical cord matrix stem cells: preliminary characterization and effect of transplantation in a rodent model of Parkinson's disease[J].Stem Cells, 2006, 24(3):781-792.
5 Kalwitz G, Endres M, Neumann K, et al.Gene expression profile of adult human bone marrow-derived mesenchymal stem cells stimulated by the chemokine CXCL7[J].Int J Biochem Cell Biol, 2009, 41(3):649-658.
6 Razzouk S, Schoor R.Mesenchymal stem cells and their challenges for bone regeneration and osseointegration[J].J Periodontol, 2012, 83(5):547-550.
7 Théry C, Amigorena S, Raposo G,et al.Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J].Curr Protoc Cell Biol,2006, Chapter 3:Unit 3.22.
8 Lai RC, Yeo RW, Tan KH, et al.Mesenchymal stem cell exosome ameliorates reperfusion injury through proteomic complementation[J].Regen Med, 2013, 8(2):197-209.
9 Yeo RW, Lai RC, Zhang B, et al.Mesenchymal stem cell: an efficient mass producer of exosomes for drug delivery[J].Adv Drug Deliv Rev, 2013, 65(3):336-341.
10 He J, Wang Y, Sun S, et al.Bone marrow stem cells-derived microvesicles protect against renal injury in the mouse remnant kidney model[J].Nephrology (Carlton), 2012, 17(5):493-500.
11 Arslan F, Lai RC, Smeets MB, et al.Mesenchymal stem cell-derived exosomes increase ATP levels, decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury[J].Stem Cell Res, 2013, 10(3):301-312.
12 Zhu YG, Feng XM, Abbott J, et al.Human mesenchymal stem cell microvesicles for treatment of Escherichia coli endotoxin-induced acute lung injury in mice[J].Stem Cells, 2014, 32(1):116-125.
13 Xin H, Li Y, Buller B, et al.Exosome-mediated transfer of miR-133b from multipotent mesenchymal stromal cells to neural cells contributes to neurite outgrowth[J].Stem Cells, 2012, 30(7):1556-1564.
14 Mokarizadeh A, Delirezh N, Morshedi A, et al.Microvesicles derived from mesenchymal stem cells: potent organelles for induction of tolerogenic signaling[J].Immunol Lett, 2012, 147(1/2):47-54.
15 Kim HS, Choi DY, Yun SJ, et al.Proteomic analysis of microvesicles derived from human mesenchymal stem cells[J].J Proteome Res, 2012, 11(2):839-849.
16 Paolini L, Zendrini A, Di Noto G, et al.Residual matrix from different separation techniques impacts exosome biological activity[J].Sci Rep, 2016, 6:23550.
Comparisons of two isolation methods for exosomes from human umbilical cord mesenchymalstem cells
Liu-Gao Miyang1,2, Pan Xinghu2, He Falian3, Lu Rong4, Liu Jufen2, He Jie2, Wang Hongyang1.1International Co-operation Laboratory on Signal Transduction, Eastern Hepatobiliary Surgery Institute, Second Military Medical University, 225 Changhai Road, Shanghai 200438, China;2Cell Biological Therapy Center of Kunming General Hospital, Chengdu Military Region of Chinese People's Liberation Army, Cell Biological Medicine integrated Engineering Laboratory of State and Region of Yunnan Province, Kunming 650032, China;3Kunming General Hospital Clinical Collage of Kunming Medical University, Kunming 650032, China;4Department of Pediatric, Shanghai Children's Hospital, Shanghai 200062, China
Corresponding author: Wang Hongyang, Email:hywang@vip.sina.com
Objective To explore the best method of separating exosomes secreted by human umbilical cord mesenchymal stem cells(huMSCS).Methods Exosomes were collected from huMSCS in the serum-free medium culture system by either ultracentrifugation or precipitation methods.Western Blot was used to detect TAPA1, CD63, HSP70, and HSP90 of exosomes.Tansmission electron microscope was used to observe exosome morphology, and proteome of exosomes isolated via the two methods was compared.Results Exosomes isolated via ultracentrifigation were around 100 nm in diameter under transmission electron microscopy and were positive for CD63, HSP70, and HSP90, while negative for TAPA1; exosomes isolated via 101 Kit were around 30 nm in diameter and were positive only for HSP90.High-resolution mass spectrometry(HRMS)revealed 169 proteins in exosomes isolated via ultracentrifigation while only 102 proteinswere identified in exosomes isolated via 101 Kit.Comparative analysis dates from HRMS indicated that there were 79 proteins shared by exosomes isolated by the two methods.Conclusion Exosomes isolated by ultracentrifugation and precipitation are different in biomarkers and proteome profile, and ultracentrifugation method is superior to precipitation method.
Umbilical Cord; Mesenchymal Stem Cells; Exosomes; Isolation; Identification
2016-08-02)
(本文编辑:陈媛媛)
10.3877/cma.j.issn.2095-1221.2017.02.004
国家自然科学基金(81170316)
200438 上海,第二军医大学东方肝胆外科医院国际合作生物信号转导研究中心1;650032 昆明,成都军区昆明总医院细胞生物治疗中心 干细胞与免疫细胞生物医药技术国家地方联合实验室 云南省细胞治疗技术转化医学重点实验室2;650032 昆明医科大学成都军区昆明总医院临床学院3;200062 上海市儿童医院儿科4
王红阳,Email:hywang@vip.sina.com
刘高米洋,潘兴华,和法莲,等.两种人脐带间充质干细胞源外泌体分离方法的比较[J/CD].中华细胞与干细胞杂志(电子版),2017,7(2):81-86.

