脐带间充质干细胞联合UM171对脐血源CD34+细胞的扩增效果研究
李猛盛宏霞刘阳廖丽田宠孙鹏张斌陈虎
脐带间充质干细胞联合UM171对脐血源CD34+细胞的扩增效果研究
李猛1盛宏霞1刘阳2廖丽1田宠1孙鹏1张斌1陈虎1
目的 研究脐带间充质干细胞联合UM171对脐血来源CD34+细胞的扩增效果。方法 脐血来源CD34+细胞及脐带来源间充质干细胞分为以下4组进行体外扩增培养10 d:对照组、UM171培养组、间充质干细胞共培养组、UM171联合间充质干细胞共培养组,采用方差分析比较不同组别间细胞扩增倍数及流式表型和集落培养情况。结果 脐带间充质干细胞CD105,CD73,CD90,不表达CD14,CD34,CD19,CD45,HLA-DR,经过诱导可以向成骨细胞、脂肪细胞、软骨细胞分化。CD34+细胞在不同条件下体外培养10 d后,UM171培养组总有核细胞数扩增14倍,CD34+细胞扩增13.5倍;MSCs共培养组总有核细胞数扩增11倍,CD34+细胞扩增10倍;联合培养组总有核细胞数扩增达22倍,CD34+细胞扩增21倍。联合培养组扩增后细胞CD34+CD38-比例达(91.49±2.67)﹪,较间充质干细胞培养组(78.11±2.35)﹪及UM171培养组(91.49±2.68)﹪相比差异具有统计学意义(P均< 0.01)。扩增后细胞集落培养14 d后,各系集落形成良好,UM171扩增组细胞较MSCs扩增组在红系及粒系形成能力方面存在优势。结论 脐带血间充质干细胞作为细胞滋养层可提高CD34+细胞体外扩增效果,UM171在扩增过程中可较好的保持细胞干性,二者联合应用扩增效果最佳,建立的脐带间充质干细胞联合UM171对脐血源CD34+细胞的扩增方法可用于CD34+细胞体外扩增培养。
间质干细胞; CD34+; 造血干细胞; 脐血
自1989[1]年第1例脐带血移植开展以来,脐带血作为造血干细胞(hematopoietic stem cells,HSCs)的重要来源一直备受关注,脐带血移植的优势在于其不需要严格的人类白细胞主要抗原(human leukocyte antigen,HLA)配型,对供者无伤害且不存在伦理问题,感染风险小,可冷冻保存使用便捷[2-3]等。制约其在临床中大量应用的最主要障碍在于脐带血中HSCs的数量有限,移植后会导致造血恢复延迟,感染风险增加等问题[4]。而双份脐带血移植则会增加移植的风险,导致植入延迟等问题出现,且会增加患者经济负担[5]。近年来国内外一直尝试对脐带血来源造血干祖细胞(hematopoietic stemprogenitorcells,HSPCs)进行体外扩增,以解决其细胞数量不足的问题。目前HSPCs扩增技术主要有细胞因子扩增技术,化学分子扩增技术,联合培养扩增技术以及三维培养系统的应用[6]。涉及脐血源HSPCs扩增实验已经进入临床实验阶段,并证实了扩增后HSPCs的安全性及有效性[7],但最佳的扩增条件至今尚没有明确的共识。
造血微环境在HSCs的成长分化过程中扮演重要角色,体外培养过程中能否更有效的模拟造血微环境,是决定HSPCs体外扩增效果的重要先决条件。间充质干细胞(mesenchyma stem cells,MSCs)作为造血微环境的重要组成部分,可以分泌造血生长因子和细胞因子,为HSPCs的增殖提供信号,研究表明其与HSPCs共培养可以显著提高扩增效率[8]。UM171是造血干细胞龛中筛选出的选择性的人HSCs再生激动剂,可以选择性的增加长期HSPCs的再生[9]。鉴于以上结果,为更有效的模拟造血微环境,本研究采用与脐血同源的MSCs与UM171联合应用于脐血HSPCs的体外扩增培养,取得了较好的效果,截至本文发稿前该方法在国内外均无相关报道。
材料与方法
一、材料
1.标本采集:实验用脐带及脐血均源自307医院产科,报经医院伦理委员会批准(伦理编号KY-2016-8-36)并征得产妇及家属同意。健康足月顺产产妇娩出胎盘后,无菌剪刀采集脐带30 cm,并收集于相应脐血储存于脐血采集袋中。
2.实验用试剂:UM171(美国Selleck公司);无血清扩增培养基(StemSpanTMSFEMⅡ,美国StemCell公司)、甲基纤维素培养基(MethoCultTM,美国StemCell公司);干细胞因子(SCF,美国R&D Systems)、促血小板生成素(TPO,美国R&D Systems)、fms样酪氨酸激3(FLT3,美国R&D Systems);Ficoll淋巴细胞分离液(美国GE医疗集团);胎牛血清(FBS,美国Gibco公司)、磷酸盐缓冲液(PBS,美国Gibco公司)、双抗(美国Gibco公司)、DMEM/F12培养基(美国Gibco公司)、成骨诱导培养基(美国Gibco公司)、成脂诱导培养基(美国Gibco公司)、成软骨诱导培养基(美国Gibco公司);Ⅱ型胶原酶(美国Sigma公司)、胰蛋白酶(美国Sigma公司);CD34 MicroBead Kit UltraPure(德国MACS公司);
二、方法
(一)实验分组
依据是否与MSCs共培养及是否添加UM171将实验分为以下4组:对照组、UM171培养组、MSCs共培养组、UM171及MSCs共培养组。每次培养设3个副孔,重复6次。
(二)细胞制备
1.MSCs制备:采集的脐带在无菌条件下应用含1﹪双抗的生理盐水反复冲洗,手术剪剪至1 mm3小块,转移至含有0.2﹪Ⅱ型胶原酶的DMEM/F12培养基中,置于37 ℃震荡消化1 h,得到的消化液分别过100目及50目滤网,滤液900×g离心15 min洗涤2遍,弃上清液后重悬于培养基中(包含20﹪ FBS、2 mmol/L L-谷氨酰胺、1﹪双抗及DMEM/F12培养基)。
2.脐血CD34+细胞制备:脐血与PBS按1 : 2稀释,50 ml离心管中加入20 ml Ficoll密度梯度淋巴分离液,倾斜离心管,缓慢加入30 ml稀释后各血样至分离液上层。4 ℃下400×g离心30 min,吸取中层灰白色单个核细胞层至50 ml离心管中,加入5倍体积PBS混匀后400×g离心10 min清洗2次,加入MACS缓冲液300 μl重悬并计数。采用德国美天尼公司CD34磁珠分选技术,将上述单个核细胞悬液分别加入100 μl FcR Blocking reagent和CD34 MicroBeads UltraPure混匀后置于4 ℃冰箱孵育30 min。孵育完成后加入10 ml MACS缓冲液500×g离心10 min,弃上清液加入MACS缓冲液500 μl重悬。500 μl MACS缓冲液预湿分选柱,将上述悬液过柱子后,500 μl MACS缓冲液清洗3次,将分选柱移出磁场,加入2 ml MACS缓冲液,迅速用配套活塞推出液体至15 ml离心管中,计数备用。
(三)细胞扩增培养
1.对照组:对照组采用StemSpanⅡ无血清培养基,添加100 ng/ml SCF,100 ng/ml FLT3,50 ng/ml TPO六孔板中细胞接种密度为1×105个/孔,置于37 ℃ 5﹪CO2培养箱培养10 d。
2.UM171扩增组:采用StemSpanⅡ无血清培养基,添加100 ng/ml UM171,以及100 ng/ml SCF,100 ng/ml FLT3,50 ng/ml TPO,取适量培养基于六孔板中,分选的CD34+细胞接种密度为1×105个/孔,置于37 ℃ 5﹪ CO2培养箱中,间隔3 ~ 4 d换液,培养10 d后行指标检测。
3.脐带MSCs共培养组:分离到的脐带MSCs贴壁培养48 h后去除未贴壁细胞继续培养,间隔3 ~ 4 d换液1次。待细胞90﹪融合后,0.25﹪胰蛋白酶消化并传代,3次传代后以5×104个/孔浓度铺于6孔板中,加入MSCs培养基,待细胞贴壁90﹪融合后采用GWXJ80型60Co照射,总剂量为10 Gy,去除培养基,加入StemSpanⅡ无血清培养基,并添加100 ng/ml SCF,100 ng/ml FLT3,50 ng/ml TPO,按1×105个/孔密度接种分选的CD34+细胞,置于37 ℃ 5﹪CO2培养箱培养10 d,间隔3 ~ 4 d换液。
4.UM171及MSCs共培养组:参照脐带MSCs共培养组培养方法,培养基中额外添加100 ng/ml UM171。
(四)流式检测
采用BD FACSCalibur流式检测仪,取培养前及培养后细胞悬液20 μl均分为2个管,1管加入FITC标记的抗体CD34,PE标记的抗体CD133,APC标记的抗体CD38;2管加入1管对应同型对照抗体FITC标记的抗体Mouse IgG2a,PE标记的抗体Mouse IgG1,APC标记的抗体Mouse IgG2a。各管涡旋震荡后室温下避光孵育15 min,加入适量PBS,500×g室温水平离心5 min,弃上清液,加入PBS 100 μl上机测定。
(五)MSCs诱导分化实验
脐带MSCs贴壁培养至第3代,融合70﹪,去除培养基,分别添加成骨诱导培养基,成脂诱导培养基及成软骨诱导培养基,间隔3 ~ 4 d换液,培养21 d固定后分别行碱性磷酸酶染色、油红O染色和阿尔新蓝染色。
(六)集落培养实验
采用MethoCuhTmGF(H4434)培养体系,六孔板中加入培养基1 ml/孔,CD34+细胞接种密度为1 000个/孔,置于37 ℃ 5﹪ CO2培养箱培养14 d,计数各系集落数目。
(七)细胞凋亡实验
采用BDAnnexin V PE Apoptosis kit 细胞凋亡检测试剂盒,分别取各组培养后细胞,经PBS洗涤离心后采用缓冲液调整细胞浓度至1×106/ml,取100 μl细胞液至5 ml离心管中,加入5 μl PE膜联蛋白以及5 μl 7-ADD,室温避光反应15 min,加入400 μl缓冲液后行流式测量。
三、统计学分析方法
采用SPSS18.0软件进行统计处理,扩增后细胞数量及流式测量细胞百分比均以±s表示,组间细胞扩增后数量、细胞流式表型比例以及各系集落培养结果比较采用方差分析,两组之间上述数据比较采用t检验,以P < 0.05为差异有统计学意义。
结 果
一、MSCs表型测定
MSCs置于37 ℃ 5﹪CO2培养箱体外培养,培养第3天可见成克隆增长的梭形贴壁细胞,传代后1周细胞融合可达90﹪(图1),取第3代细胞胰酶消化后流式测定CD105,HLA-DR,CD73,CD90,CD14,CD34,CD19,CD45及 SSEA-4等细胞表型(图2)。结果可见未分化MSCs高表达CD105,CD73,CD90,表达率均高于99﹪,不表达CD14,CD34,CD19,CD45,HLA-DR,表达效率均低于1﹪,MSCs标志物SSEA-4表达率在(0.98±0.51)﹪。MSCs经诱导分化可形成成骨细胞(图3a),脂肪细胞(图3b),和软骨细胞(图3c),证明其具多谱系分化潜能。
二、磁珠分选效果
CD34+细胞的纯度和活力分别采用流式细胞仪和台盼蓝染色分析,经检验分离得到细胞的纯度和存活率分别为(96.46±2.92)﹪和(92.63±3.56)﹪。
三、扩增效果比较
对照组CD34+细胞10 d培养后细胞总数扩增3.7倍,CD34+细胞扩增3.5倍;UM171组经10 d培养后细胞总数扩增14倍,CD34+细胞扩增13.5倍(图1);MSCs共培养组细胞总数扩增11倍,CD34+细胞扩增10倍;联合培养组细胞总数在第10天扩增达22倍,CD34+细胞扩增21倍,扩增后3组细胞总数及CD34+及CD133+差异具有统计学意义(P均< 0.01)。各组细胞培养情况见图4,各组培养后细胞总数、CD34+及CD133+细胞数(表1)。
四、流式检测结果
各组培养10 d后收获细胞进行流式检测,结果显示UM171联合MSCs组得到CD34+CD38-细胞比例为(91.49±2.67)﹪,较MSCs及UM171组差异具有统计学意义(P < 0.01),含UM171培养体系CD133细胞比例较单独MSCs培养组差异具有统计学意义(P < 0.01)。各组细胞培养后流式检测情况见表2。
(一)细胞凋亡实验
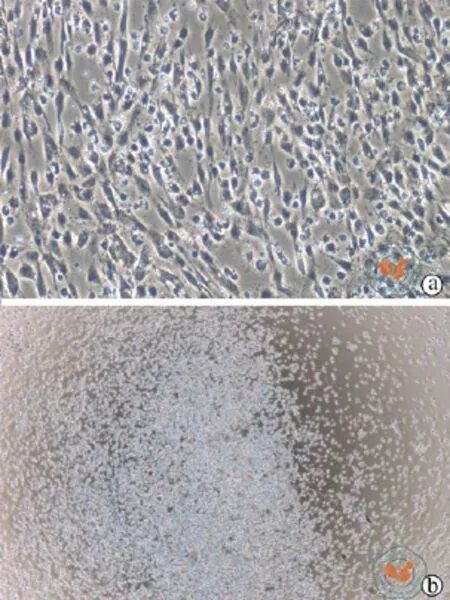
图1 倒置显微镜下观察 MSCs及CD34+细胞培养形态
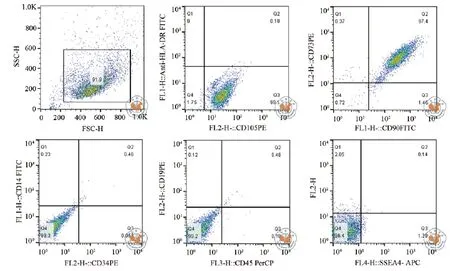
图2 流式细胞仪对MSCs表面抗原检测结果
对照组细胞早期凋亡比例约为1.5﹪晚期凋亡比例为1﹪,死亡细胞约3﹪;其余3组细胞早期凋亡比例约为1﹪,晚期凋亡比例约为1﹪,各组间差异无统计学意义(图6)。
(二)集落培养效果
分别对未扩增脐血及3组扩增后CD34+行集落培养,培养第3天可见集落形成,扩增后细胞经甲基纤维素培养14 d后集落形成良好(图7),各组集落计数见表3。数据分析显示,MSCs扩增组集落形成能力较其他各组间差异无统计学意义,在红系及粒系形成能力方面差异较为明显,扩增体系中包含UM171的两组与脐血对照组差异无统计学意义。
表1 培养后各组细胞总数、CD34+及CD133+细胞数比较(×105,±s)
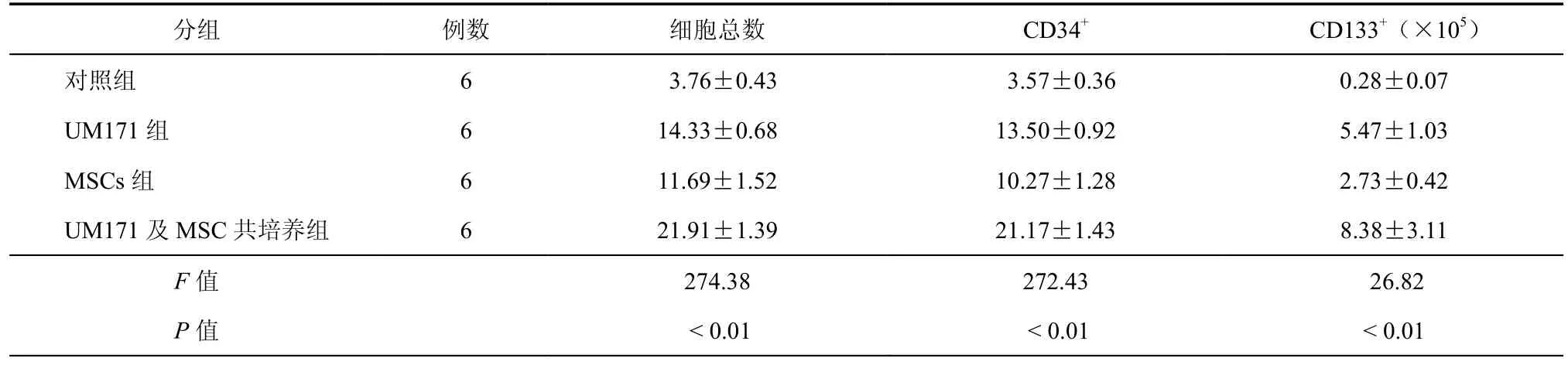
表1 培养后各组细胞总数、CD34+及CD133+细胞数比较(×105,±s)
分组 例数 细胞总数 CD34+ CD133+(×105)对照组 6 3.76±0.43 3.57±0.36 0.28±0.07 UM171组 6 14.33±0.68 13.50±0.92 5.47±1.03 MSCs组 6 11.69±1.52 10.27±1.28 2.73±0.42 UM171及MSC共培养组 6 21.91±1.39 21.17±1.43 8.38±3.11 F值 274.38 272.43 26.82 P值 < 0.01 < 0.01 < 0.01
表2 培养后各组细胞流式表型比较(﹪,±s)
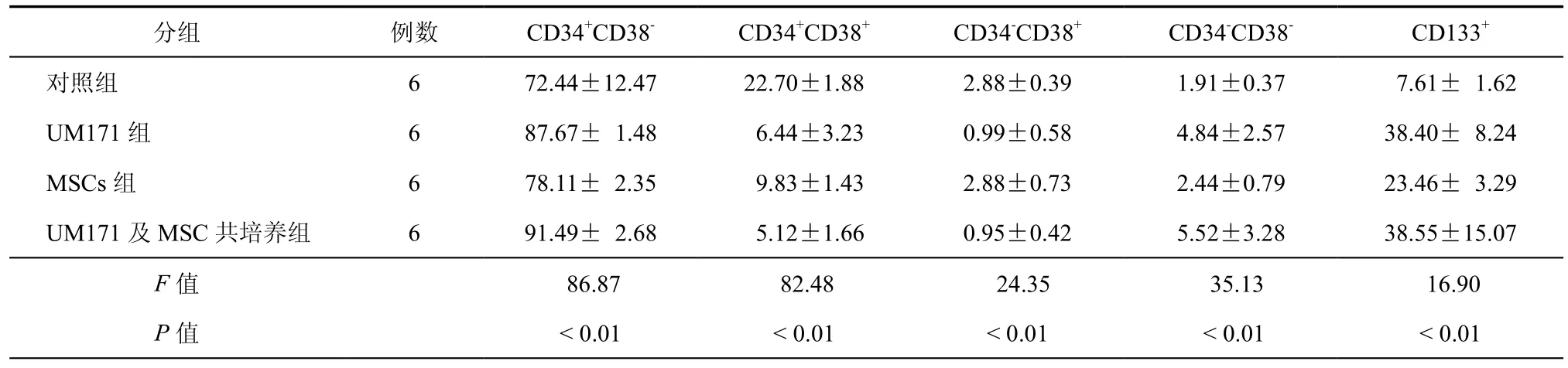
表2 培养后各组细胞流式表型比较(﹪,±s)
分组 例数 CD34+CD38- CD34+CD38+ CD34-CD38+ CD34-CD38- CD133+对照组 6 72.44±12.47 22.70±1.88 2.88±0.39 1.91±0.37 7.61± 1.62 UM171组 6 87.67± 1.48 6.44±3.23 0.99±0.58 4.84±2.57 38.40± 8.24 MSCs组 6 78.11± 2.35 9.83±1.43 2.88±0.73 2.44±0.79 23.46± 3.29 UM171及MSC共培养组 6 91.49± 2.68 5.12±1.66 0.95±0.42 5.52±3.28 38.55±15.07 F值 86.87 82.48 24.35 35.13 16.90 P值 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01

图3 光学显微镜下观察MSCs分化诱导成像(×200)
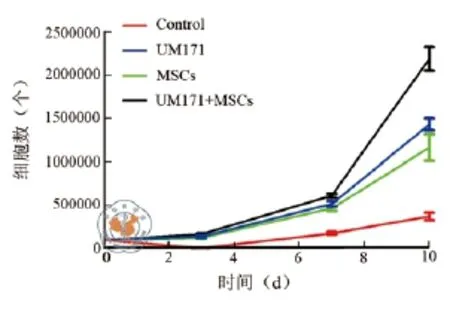
图4 各组培养过程不同时间点细胞总数变化情况
讨 论
脐血来源HSPCs体外扩增体系较多,从最初的添加细胞因子向多种手段联合应用发展,以期获得更好的扩增效果,但长期体外培养对HSPCs干性损伤较大,研究表明体外培养时间控制在2周以内可以更好地保留扩增后细胞干细胞特性。造血微环境是能够支持造血干细胞定居、自我更新以及繁殖分化的特殊生理环境,造血组织中的非造血细胞对造血增值分化发挥着特殊作用,目前的扩增体系也大都基于模拟造血微环境对HSPCs行体外扩增。体外培养过程中造血微环境对干性保持起着重要作用,MSCs作为造血微环境的重要组份,其作为饲养层与CD34+细胞共培养,可通过分泌细胞因子、生长因子和黏附分子细胞支持HSPCs的生长和增殖,提高其生存率和自我更新能力[10]。既往研究表明MSCs经传代培养后,细胞因子分泌能力有所下降[11]。实验中采用与脐血同源的第3代MSCs,其流式表型及诱导分化能力较为稳定。
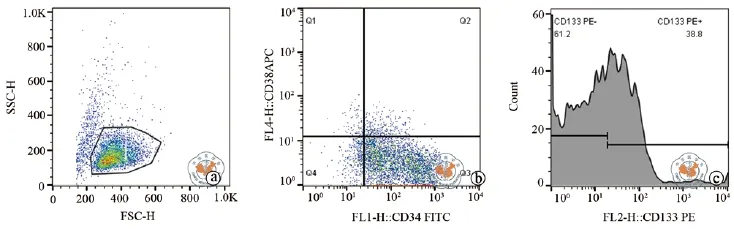
图5 各组细胞培养后流式检测情况
表3 扩增前后各组细胞集落培养结果比较(±s)
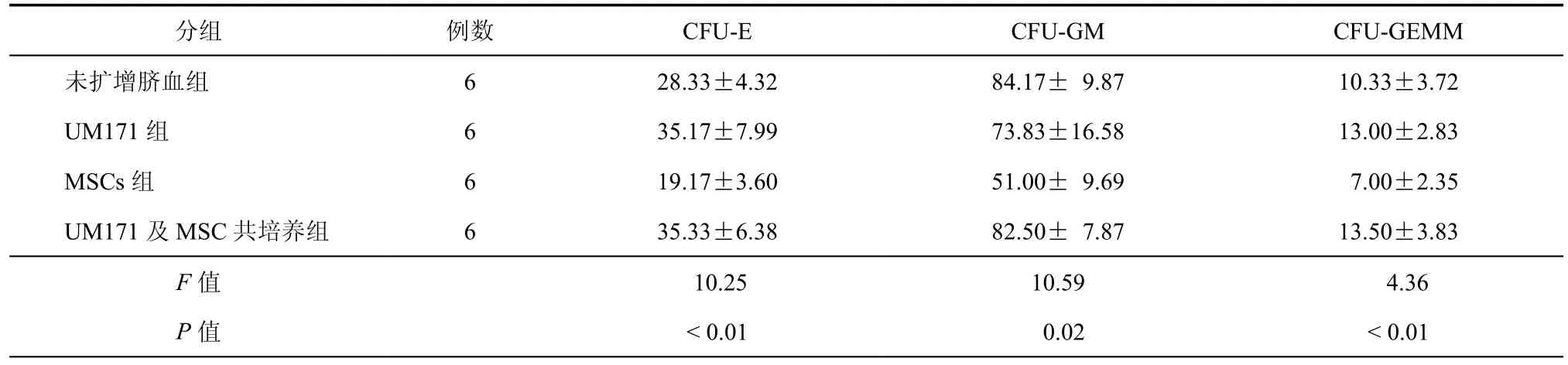
表3 扩增前后各组细胞集落培养结果比较(±s)
分组 例数 CFU-E CFU-GM CFU-GEMM未扩增脐血组 6 28.33±4.32 84.17± 9.87 10.33±3.72 UM171组 6 35.17±7.99 73.83±16.58 13.00±2.83 MSCs组 6 19.17±3.60 51.00± 9.69 7.00±2.35 UM171及MSC共培养组 6 35.33±6.38 82.50± 7.87 13.50±3.83 F值 10.25 10.59 4.36 P值 < 0.01 0.02 < 0.01

图6 细胞凋亡流式检测
添加细胞因子作为HSPCs体外培养的基础方法,其在调节HSPCs增殖、分化、生存中发挥重要作用[12],应用于HSPCs扩增的细胞因子及其组合方式很多,但一般均包含以下3个细胞因子:SCF、TPO以及FLT3,该组合可有效提高细胞存活率、细胞端粒长度、黏附因子表达及干细胞扩增[13-14]。
在造血干细胞龛中通过高通量筛选出小分子化学物质在HSPCs扩增应用越来越广泛,其特点就是在提高扩增效率的同时可以较好的保持细胞干性。UM729是存在于造血干细胞龛中的小分子化合物,它能够增加人的CD34+CD45RA-外周血细胞比例。UM171是UM729的类似合成物,研究表明其扩增能力是UM729的10 ~ 20倍,经UM171扩增后CD34+细胞在猕猴体内植入效率可以提高约3倍。UM171对有丝分裂和表型上原始种群的分裂速度没有影响。此外,UM171与StemRegenin(SR1)协作可以增加短期性祖细胞的扩张。而UM171自身可以显著扩大长期正常的造血干细胞[8]。本实验中同样发现添加UM171的培养体系在HSPCs扩增中可有效提高CD34+CD38-及CD133细胞比例。
试验结果表明细胞因子联合MSCs或UM171均可对HSPCs进行有效扩增,二者联合应用在提高扩增效率同时可以更有效对CD34+CD38-进行扩增,扩增效率可达20倍,凋亡实验显示MSCs联合UM171在增加扩增效率同时并未增加细胞凋亡比例,集落培养实验表明该方法扩增后细胞较MSCs扩增组的红系及粒系形成能力存在优势。
造血干细胞移植前,患者通常接受清髓的放射治疗,移植的造血干细胞寄宿在照射的基质并增殖分化,最终重建造血系统。照射的基质可能刺激造血干细胞,Celebi等[15]研究认为照射的MSCs能够更好的模拟造血干细胞龛从而支持HSPCs扩增。Walenda也验证了照射后MSCs扩增的HSPCs中CD34+CD38-比例较未照射提高[16]。本实验同样选择照射处理的MSCs对HSPCs进行扩增,取得较好效果。
HSPCs扩增数量与其干性保持的矛盾是目前需探讨的一个重要问题,未分化的HSCs是体外扩增的追求目标,目前技术层面下扩增的更多是祖细胞而非干细胞,多数临床实验研究结果表明,扩增后的HSPCs长期造血功能并未得到明显改善,但高剂量的HSPCs输注后可以显著缩短UCBT患者全血细胞减少期,减少机会感染及移植相关疾病发病率和死亡率,因此HSPCs体外扩增仍具有较好的科研前景。
综上所述,本研究建立了全新的基于模拟造血微环境的HSPC体外培养体系,该体系可实现HSPCs数量扩增一个数量级,培养后CD34+CD38-细胞比率较高,体外实验初步验证了其具有长期造血重建功能,后续将在动物模型上进一步评估其移植后造血重建能力。
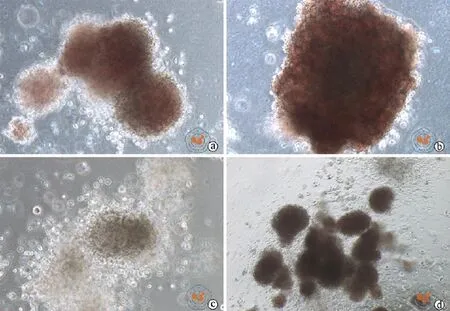
图7 倒置显微镜下观察各谱系集落形成(×200)
1 Gluckman E, Broxmeyer HA, Auerbach AD, et al.Hematopoietic reconstitution in a patient with Fanconi's anemia by means of umbilical-cord blood from an HLA-identical sibling[J].N Engl J Med, 1989, 321(17):1174-1178.
2 Broxmeyer HE.Enhancing the efficacy of engraftment of cord blood for hematopoietic cell transplantation[J].Transfus Apher Sci, 2016,54(3):364-372.
3 金婷, 王利, 王红祥.非血缘脐血移植治疗成人急性白血病的研究进展[J].中华器官移植杂志, 2015, 36(2):120-123.
4 Ballen KK, Gluckman E, Broxmeyer HE.Umbilical cord blood transplantation: the first 25 years and beyond[J].Blood, 2013, 122(4):491-498.
5 Oran B, Shpall E.Umbilical cord blood transplantation: a maturing technology[J].Hematology Am Soc Hematol Educ Program, 2012, 2012:215-222.
6 李猛, 盛宏霞, 张斌, 等.脐血来源造血干细胞体外培养扩增技术研究进展[J].中华细胞与干细胞杂志(电子版), 2016, 6(2):127-133.
7 Bari S, Seah KK, Poon Z, et al.Expansion and homing of umbilical cord blood hematopoietic stem and progenitor cells for clinical transplantation[J].Biol Blood Marrow Transplant, 2015, 21(6):1008-1019.
8 De Lima M, Mcniece I, Robinson SN, et al.Cord-blood engraftment with ex vivo mesenchymal-cell coculture[J].N Engl J Med, 2012, 367(24):2305-2315.
9 Fares I, Chagraoui J, Gareau Y, et al.Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal[J].Science, 2014, 345(623):1509-1512.
10 Gammaitoni L, Weisel KC, Gunetti M, et al.Elevated telomerase activity and minimal telomere loss in cord blood long-term cultures with extensive stem cell replication[J].Blood, 2004, 103(12):4440-4448.
11 刘婷.脐带间充质干细胞体外扩增研究及其分泌细胞因子的高通量筛查[D].北京:中国人民解放军军事医学科学院, 2012.
12 Chu PP, Bari S, Fan XB, et al.Intercellular cytosolic transfer correlates with mesenchymal stromal cell rescue of umbilical cord blood cellviab ility during ex vivo expansion[J].Cytotherapy, 2012, 14(9):1064-1079.13 Chou S, Chu P, Hwang W, et al.Expansion of human cord blood hematopoietic stem cells for transplantation[J].Cell Stem Cell, 2010, 7(4):427-428.
14 Gullo F, Van Der Garde M, Russo G, et al.Computational modeling of the expansion of human cord blood CD133+hematopoieticstem/progen itorcells with different cytokine combinations[J].Bioinformatics, 2015, 31(15):2514-2522.
15 Celebi B, Mantovani D, Pineault N.Irradiated mesenchymal stem cells improve the ex vivo expansion of hematopoietic progenitors by partly mimicking the bone marrow endosteal environment[J].J Immunol Methods, 2011, 370(1/2):93-103.
16 Walenda T, Bork S, Horn P, et al.Co-culturewithmesenchymal stromal cells increases proliferation and maintenance ofhaematopoietic progenitor cells[J].J Cell Mol, 2010, 14(1-2):337-350.
Effect of umbilical cord mesenchymal stem cells in combination with UM171 on amplificationof cord blood CD34+ cells
Li meng1, Sheng Hongxia1, Liu Yang2, Liao Li1, Tian Chong1, Sun Peng1, Zhang Bin1, Chen Hu1.1Department of Hematopoietic Stem Cell Transplantation,2Gynaecology and Obstetrics, Affiliated Hospital of Military Medical Sciences, Beijing 100071, China
Corresponding author: Chen Hu, Email:chenhu217@aliyun.com
Objective To investigate the effect of umbilical cord mesenchymal stem cells(MSCs)in combination with UM171 on amplification of cord blood CD34+cells.Methods The cord blood CD34+cells and umbilical cord MSCs were divided into four groups: Group A(control group), Group B(UM171 culture group), Group C(MSCs co-culture group)and Group D(UM171 and MSCs co-culture group).The cell number, phenotype and colony formation ability were compared among different groups after amplification in vitro for 10 days.Results The umbilical cord MSCs expressed CD105, CD73 and CD90, while didn't express CD14, CD34, CD19, CD45 and HLA-DR.After induction, the cells could differentiate into osteoblasts, adipocytes and chondrocytes.After the CD34+cells were cultured in vitro for 10 days, the total nuclear cells in the UM171 culture group were amplified by 14 times, and CD34+cells by 13.5 times; the total nuclear cells in the MSCs co-culture group were amplified by 11 times, and CD34+cells by 10 times; the total nuclear cells in the UM171 and MSCs co-culture group were amplified by 22 times, and CD34+cells by 21 times.The ratio of CD34+CD38-cell in the UM171 and MSCs co-culture group was(91.49±2.67)﹪.There was significant difference compared with the UM171 culture group(91.49±2.68)﹪and the MSCs co-culture group(78.11±2.35)﹪.After amplification, the cells were cultured for 14 days,and colony formation were observed in all groups.Besides, cells in the UM171 group formed more erythroid cells and granulocytes than cells in the MSC co-culture group.Conclusion As feeder cells, umbilical cord MSCs can improve in vitro amplification of CD34+cells.UM171 can favorably maintain stemness of the cells in the amplification process.The optimal amplification can be achieved by combining umbilical cord MSCs and UM171.
Mesenchymal Stem Cells; CD34+; Hematopoietic stem cells; Fetal blood
2016-11-17)
(本文编辑:李少婷)
10.3877/cma.j.issn.2095-1221.2017.02.006
100071 北京,军事医学科学院附属医院造血干细胞移植科1,妇产科2
陈虎,Email:chenhu217@aliyun.com
李猛,盛宏霞,刘阳,等.脐带间充质干细胞联合UM171对脐血源CD34+细胞的扩增效果研究[J/CD].中华细胞与干细胞杂志(电子版),2017,7(2):93-100.

