临床级脐带间充质细胞制备及鉴定方法研究
袁艳鹏 王淑艳 唐玺和 刘仲凤 张愚 陈志国
临床级脐带间充质细胞制备及鉴定方法研究
袁艳鹏 王淑艳 唐玺和 刘仲凤 张愚 陈志国
目的 在GLP实验室中制备并鉴定临床级脐带间充质细胞(UC-MSC)。方法 新鲜获取的脐带去除血管并进行充分清洗,获得的华通胶(Wharton’s jelly)机械分离后分别进行直接贴壁法和不同的酶消化法,比较获取UC-MSC的数量差别;用不同的无血清培养基进行培养比较细胞形态是否良好,得到最佳形态的UC-MSC。体外培养第3代后进行UCMSC质检,包括细胞活性,生长曲线,无菌检测,人类相关病毒、支原体、内毒素检测,染色体核型分析,FACS免疫表型检测及分化能力检测。不同消化方法获取细胞数之间比较采用两样本配对t检验。结果 胶原酶Ⅱ消化获得的UC-MSC数(5.3×106±0.58个/ml)与胶原酶Ⅰ+ 0.25﹪胰酶消化法(2.53×105±0.03个/ml)及直接贴壁法(2.6×105±0.05个/ml)之间差异有统计学意义(P < 0.05),与胶原酶Ⅰ消化法获取细胞数(5.1×106±0.57个/ml)之间差异无统计学意义(P = 0.07),但培养视野最干净;MesenCult-ACF Medium培养获得的UC-MSC形态最佳;UC-MSC质检细胞活性冻存前达99.8﹪,冻存复苏后达99﹪;无细菌、支原体、乙肝病毒、丙肝病毒、梅毒螺旋体、艾滋病毒、肺炎支原体、EB病毒、巨细胞病毒污染;内毒素检测结果均< 1 EU;CD73/CD90/CD105阳性率达98﹪,CD34/CD45/HLA-DR呈阴性,阳性率< 2﹪;染色体核型分析无突变或缺失;UC-MSC具有成脂、成骨或成软骨方向分化的能力。结论 通过优化分离和培养条件,采用无血清及无动物来源的培养系统,在GLP实验室内可获得临床级UC-MSC。
脐带; 间质细胞; 胶原酶类; 培养基、无血清; 细胞分化
间充质干细胞(mesenchymal stromal cells,MSCs)最早从骨髓中发现[1],随着MSCs的广泛应用,逐渐在多种组织中也发现了MSCs,包括脂肪、胎盘、脐带、脐血、羊膜及肌肉等[2]。目前脐带间充质干细胞(umbilical cord mesenchymal stromal cells,UC-MSC)由于其增殖能力强,免疫调节作用及多向分化能力被广泛用于细胞移植治疗,但获取UC-MSC的方法各不相同,本实验室在GLP实验室中采用无血清及无动物来源的培养基制备临床级UC-MSC。
材料与方法
一、材料及试剂
足月顺产新生儿脐带(首都医科大学宣武医院妇产科);100 ml培养瓶(德国DURAN GROUP公司)、无菌手术器械(上海医疗器械有限公司);10 cm培养皿、T75培养瓶(美国Corning公司);胶原酶Ⅰ、胶原酶Ⅱ、DNA酶Ⅰ(美国Sigma公司);Mesen Cult-ACF Medium、Mesen Cult-ACF Dissociation Kit、Mesen Cult-ACF Freezing Medium(加拿大Stem Cell Technologies公司);人MSCs培养基(北京百乐通生物科技有限公司);加强型人MSCs培养基(天津市灏洋生物制品科技有限公司);倒置相差显微镜(日本Nikon公司);乙型肝炎病毒核酸检测试剂盒、人类免疫缺陷病毒1型核酸检测试剂盒、丙型肝炎病毒核酸检测试剂盒、人类巨细胞病毒核酸检测试剂盒、梅毒螺旋体核酸检测试剂盒、EB病毒核酸检测试剂盒、肺炎支原体核酸检测试剂盒(湖南圣湘生物公司);人MSCs成脂、成骨、成软骨分化试剂盒(赛业生物科技有限公司);细胞培养箱(美国Thermo Fisher公司)。
二、方法
1.新鲜脐带的处理及华通胶(Wharton's jelly)获取:产妇顺利分娩后获取20 cm左右脐带,放置于含有Hank's Solution 10 ml及1﹪P ~ S(青链霉素)溶液的100 ml培养瓶内,转运盒常温转运至GLP内准备间,将脐带分离为3 ~ 5 cm小段并用DPBS(不含钙和镁离子的磷酸盐缓冲液)和75﹪酒精分别清洗3遍至液体澄清,将2根脐动脉和1根脐静脉剥离后再次清洗即可获得华通胶。该研究经由首都医科大学宣武医院伦理委员会审批,告知产妇及家属签署知情同意书。
2.比较不同酶消化法UC-MSC获取的数量:将华通胶机械分离为1 ~ 2 mm3小块,转移入50 ml离心管中,等量加入DPBS 250×g,4°离心5 min,弃上清液,重复2次。用无血清培养基重悬组织块,其中1/4直接接种于T75培养瓶内,培养基能够浸湿培养瓶底即可,组织块要达到底面积的50﹪~ 70﹪即可放入孵箱内培养;其余3/4平均分为3份,分别用等体积胶原酶Ⅰ、胶原酶Ⅱ和胶原酶Ⅰ+ 0.25﹪胰酶37℃消化5 h,之后均用DNA酶Ⅰ处理3 min,DPBS清洗2遍后计数并接种至T75培养瓶内,放入无血清培养基10 ml后混匀孵育。
直接贴壁培养的组织块5 d后换液,之后每3天换液1次;酶消化法获得的UC-MSC每3天换液,统一在培养第15天时用Mesen Cult-ACF Dissociation Kit消化UC-MSC计数,比较4种方法获取细胞的数量。
3.比较不同无血清培养基培养UC-MSC的形态:获得UC-MSC后分别采用3种不同培养基Mesen Cult-ACF Medium(Stem Cell Technologies)、人MSC培养基(北京百乐通生物科技有限公司)和加强型人MSC培养基(天津市灏洋生物制品科技有限公司)培养UC-MSC,比较哪种培养基获得的细胞形态最佳。
4.UC-MSC的质检:UC-MSC培养至第3代后进行冻存前及冻存后细胞活性鉴定;每次传代计数细胞数了解UC-MSC生长曲线;随机采集细胞培养上清(48 h未换液)进行无菌检测(常见有氧菌和厌氧菌);随机选取P3和P4培养上清(48 h未换液)各3个样本进行支原体PCR检测;应用人内毒素ELISA试剂盒对P3和P4培养上清(48 h未换液)各3个样本进行检测;人类相关病毒(乙肝病毒、丙肝病毒、艾滋病毒、EB病毒、巨细胞病毒、梅毒螺旋体和肺炎支原体)用荧光定量PCR试剂盒检测;取P4增殖期细胞进行染色体核型鉴定;P3细胞固定后分别标记表面抗原CD73-FITC、CD90-PE、CD105-PE、CD34-APC、CD45-PE和HLA-DRPE进行FACS免疫表型检测。
5.UC-MSC的分化:第3代UC-MSC消化后按照人MSC成脂、成骨、成软骨分化试剂盒,简单描述为成骨分化在六孔板内接种2×105/孔UCMSC,细胞生长至60﹪~ 70﹪融合时更换为成骨分化培养基,每3 d换液1次,3周后应用茜素红染色观察成骨分化情况;成脂方向分化在六孔板内每孔接种2×105/孔UC-MSC,细胞生长至100﹪融合时更换为成脂分化培养基A,3 d后更换成脂分化培养基B培养1 d,重复4次,之后持续用培养基B培养至3周,应用油红“O”染色鉴定成脂情况;成软骨分化将2.5×105/管UC-MSC放入15 ml离心管内,用不完全培养基150×g离心5 min,离心过程重复2次,之后弃上清,再用0.5 ml完全培养基(含TGF-β3)重悬细胞后再次150×g离心5 min,将离心管盖拧松放入孵箱内,每2 ~ 3 d更换完全培养基0.5 ml(换液时避免吸到细胞团),3周后将得到的软骨颗粒固定后石蜡包埋切片进行阿辛蓝染色鉴定。
三、统计学分析方法
应用SPSS16.0统计软件,不同消化方法获取细胞数据以±s表示,两种消化方法获取细胞数之间比较采用两样本配对t检验,以P < 0.05为差异具有统计学意义。FACS数据应用FlowJo软件分析并作图。
结 果
1.不同方法获取UC-MSC的数量比较:经过15 d的培养,直接贴壁法获得的细胞数为2.6× 105±0.05个/ml,胶原酶Ⅰ消化法可获得5.1× 106±0.57/ml,胶原酶Ⅱ消化法可获得5.3× 106±0.58/ml,胶原酶Ⅰ+ 0.25﹪胰酶消化法可获得2.53×105±0.03/ml,胶原酶Ⅱ与胶原酶Ⅰ+ 0.25﹪胰酶消化法及直接贴壁法之间存在显著性差异(P <0.0001),与胶原酶Ⅰ消化法获取细胞数差异无统计学意义(P = 0.07),但镜下发现胶原酶Ⅱ消化法培养视野最干净。不同方法获取细胞数结果比较Medium(STEM CELL Technologies)的培养基获得的细胞形态最佳,另外两种培养基获取的细胞形态欠佳。具体细胞培养形态见图2。见图1。
2.不同培养基获取的UC-MSC形态不同:目前UC-MSC的培养基较多,但用于临床级的培养基必须是无血清和无动物来源的培养基,选取3种不同公司培养基进行培养,比较得出MesenCult-ACF

图1 不同酶消化法获取细胞数比较
3.细胞活性比较:冻存前每次传代都计数细胞活性,活性可达99.8﹪,冻存后复苏UC-MSC活性可达99﹪,且细胞放置在冰上保存24 h细胞活性仍可达80﹪。
4.UC-MSC生长曲线:从原代获取的UC-MSC开始,每次传代后计数细胞,横轴为细胞代次,纵轴为细胞计数,显示UC-MSC的生长曲线(图3)。
5.细菌、支原体、内毒素、人类相关病毒及核型检测:(1)细菌检测:细胞培养上清送检验科进行无菌检测3次,常见有氧菌和厌氧菌检测均为(-);(2)支原体检测:随机选取P3和P4培养上清进行支原体PCR检测,凝胶电泳显示阳性对照为270bp条带,而阴性对照及6个样本结果均为阴性,结果见图4;(3)内毒素检测随机选取P3和P4培养上清各3个样本应用人内毒素ELISA试剂盒检测内毒素水平,结果吸光度均< 1 EU,详细结果见表1;(4)人类相关病毒检测:应用圣湘生物7个人类病毒核酸检测试剂盒荧光定量PCR的方法分别检测P3及P4培养上清的病毒水平,结果均为(-);(5)染色体核型分析 UC-MSC P4传代后第2天(增殖期)送检验科进行染色体核型分析,为46XX,无突变或缺失(图5)。
6.FACS细胞免疫表型检测 UC-MSC P3细胞消化后DPBS清洗、固定及表面抗原免疫表型检测,CD73/CD90/CD105呈阳性,阳性率达98﹪,CD34/ CD45/HLA-DR呈阴性,阳性率< 2﹪,符合MSC的免疫表型(图6)。
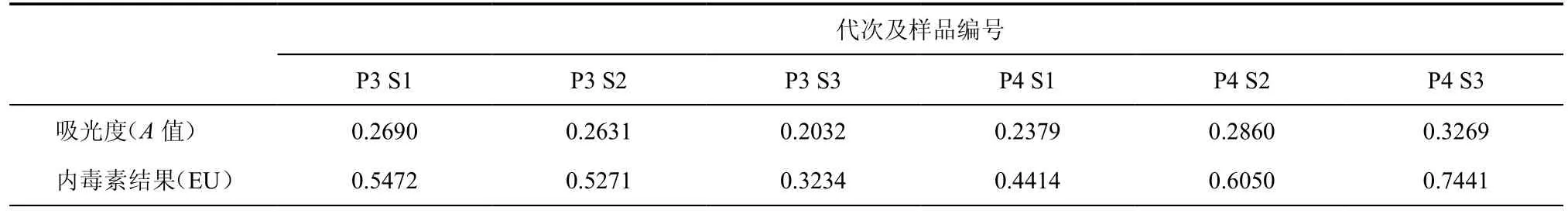
表1 UC-MSC不同代次细胞内毒素检测结果

图2 倒置相差显微镜下观察不同培养基获取UC-MSC形态比较(×20)
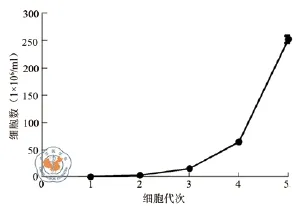
图3 UC-MSC生长曲线
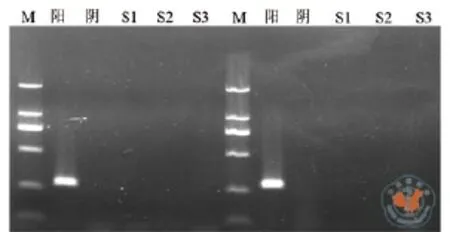
图4 支原体PCR检测结果
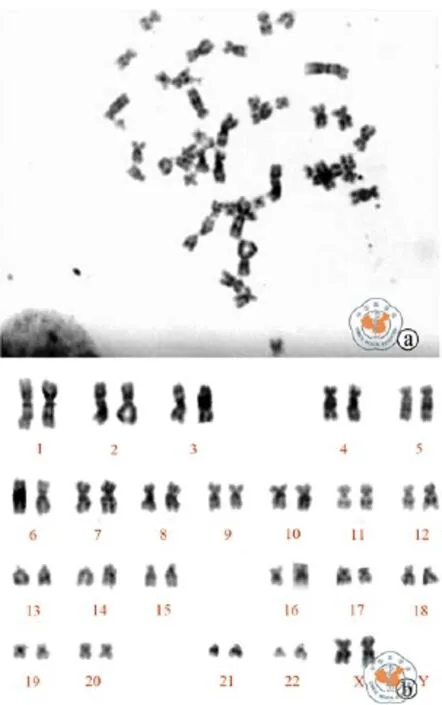
图5 UC-MSC染色体核型分析
7.UC-MSC成脂、成骨、成软骨三方向分化检测将UC-MSC P3消化后按照分化试剂盒说明向成骨、成脂、成软骨方向分化,21 d左右分别进行茜素红、油红“O”及阿辛蓝染色鉴定(图7)。
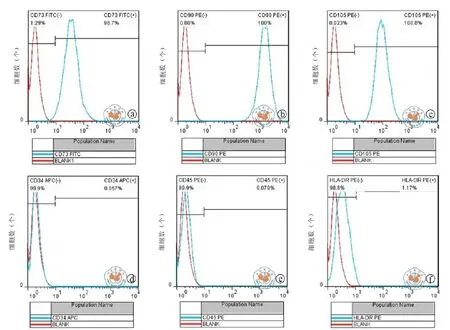
图6 UC-MSC免疫表型FACS检测结果

图7 倒置相差显微镜下观察UC-MSC成骨、成脂、成软骨分化结果(×20)
讨 论
MSC自有学者报道以来,一直是基础研究及临床应用的热点,主要由于其来源于早期中胚层,有自我增殖能力、多向分化的潜能等。目前获取的MSC多从成人骨髓而来,其获取过程为有创性,获取的量极少,且因患者年龄及疾病原因不能得到满意的MSC。目前已经发现多种组织中存在MSC,如脂肪、肌肉、胎盘、羊膜、脐血及脐带等[2]。脐带为连接胎儿与母体的重要纽带,产妇顺利分娩后脐带的纽带作用随即消失成为弃物,故获取脐带相对容易,对产妇及胎儿无任何影响,与骨髓MSC相比较,UCMSC增殖能力及细胞活性更高,免疫原性更低[3],且有报道表明脐带可获取最大量的UC-MSC[4],逐渐成为基础与临床研究的新宠。
UC-MSC的获取方法目前主要有直接贴壁培养法及酶消化法[5-9],两大类方法各有可取之处,本实验对比了直接贴壁法与不同酶消化法获取细胞的数量,发现直接贴壁法步骤简单,获取的细胞形态良好,但从华通胶内爬出足够细胞的时间较长,污染的几率明显上升,且传代时组织块不易分离;酶消化法分别比较了胶原酶Ⅰ,胶原酶Ⅱ及胶原酶Ⅰ+ 0.25﹪胰蛋白酶的消化效率,发现5 h组织块基本消化完毕,与郝世凯等[10]研究结果相似,消化后得到的UC-MSC经3 ~ 5 d培养后即可在镜下看到明显的细胞增殖,同一时间点消化收集细胞得到的细胞数经统计学分析提示胶原酶Ⅱ消化法得到的细胞数较多。由此可知用酶消化法与直接贴壁法相比不易污染且获得的细胞数更多,而酶消化法中胶原酶Ⅱ消化得到的UC-MSC细胞数最多且培养视野最干净。
目前培养UC-MSC的培养基中多存在胎牛血清、脐血血清等血清成分[11],UC-MSC在血清存在的培养基中生长良好,但由于脐血血清获取的量有限,不能维持足够的培养周期,胎牛血清中含有动物源性成分,可能携带动物来源的病毒等病原体,且血清中成分复杂,不能预测临床应用中存在的风险。已有学者采用无血清培养基进行UC-MSC的培养,可以获取形态良好的UC-MSC[12-13],但用于临床移植的培养基中最好无血清也不存在动物成分[14]。本实验室比较了3种无血清及无动物来源的MSC培养基,发现用MesenCult-ACF Medium(Stem Cell Technologies)的培养基获得的细胞生长良好,形态最佳,且消化酶、酶中止剂及细胞冻存液均采用无血清及无动物成分的试剂,保证全程获取UC-MSC的过程不存在人员以外的物质,保证临床使用安全性。
本实验室通过在GLP实验室制备UC-MSC,获得的UC-MSC起始数量较多,贴壁能力强,成簇状或漩涡状生长,生长增殖能力强,细胞活性无论在冻存前还是冻存后均在99﹪以上,生物学活性无明显改变[15],且在冰上放置24 h细胞活性仍达80﹪,细胞各种无菌检测及病毒、支原体等检测均为阴性,细胞免疫表型提示CD73、CD90、CD105等间质细胞标记高表达,阳性率达98﹪,CD34、CD45等造血干细胞标记基本不表达,阳性率低于1﹪,MHC-Ⅱ类分子标记HLA-DR表达阳性率低于2﹪,经体外诱导分化可向成骨、成脂及成软骨方向分化,以上特征均符合MSC的鉴定标准[16]。
本实验室长期致力于干细胞的移植治疗研究,通过本实验室的脐带酶消化法、无血清及无动物来源的培养体系的建立,临床移植相关的细胞检测鉴定,能够为临床移植提供良好的细胞供体。
1 Caplan AL.Mesenchymal stem cell[J].J Orthop Res, 1991, 9(05):641-650.
2 Vemuri MC, Chase LG, Rao MS.Mesenchymal Stem Cell Assays and Applications[M].London:Humana Press, 2011:11-200.
3 Pham PV, Truong NC, Phuong TL, et al.Isolation and proliferation of umbilical cord tissue derived mesenchymal stem cells for clinical applications[J].Cell Tissue Bank, 2016, 17(2):289-302.
4 Thomas Vangsness JC, Sternberg H, Harris L.UC tissue offers the grestest number of harvestable mesenchymal stem cells for research and clinical application: A Literature Review of Different Harvest Sites[J].The Journal of Arthroscopic and Related Surgery, 2015, 31(9):1836-1843.
5 王菲, 周洪, 郭昱成, 等.原代人脐带间充质干细胞培养方法的研究[J].中国组织工程研究, 2014,18(19):3042-3047.
6 刘玲英, 柴家科, 段红杰, 等.人脐带间充质干细胞不同分离方法的效果比较[J].中华医学杂志, 2013,93(32):2592-2596.
7 辛毅, 李娜, 黄益民, 等.人脐带间充质干细胞的原代培养及多向分化潜能的研究[J].细胞与分子免疫学杂志, 2013, 29(10):1087-1093.
8 孙瑞婷, 陈瑶瑶, 王华, 等.脐带来源间充质干细胞的制备及其质量检定[J].中国医药生物技术, 2013, 8(6):401-407.
9 祝加学, 沈尊理, 秦金保, 等.一种大量快速分离脐带间充质干细胞的新方法[J].现代生物医学进展, 2010, 10(6):1164-1169.
10 郝世凯, 苏相相, 洪敬欣.不同消化时间下胶原酶对人脐带间充质干细胞分离的影响[J].中国民族民间医药, 2014, 5(24):36-40.
11 吴洁莹, 陆琰, 陈劲松, 等.脐血血浆替代胎牛血清培养脐带间充质干细胞及冷冻保存[J].中国组织工程研究, 2014, 18(37):5947-5954.
12 李兰兰, 马炬明, 陈玲肖.脐带间充质干细胞无血清培养的实验研究[J].中国现代医生, 2013, 51(27):85-87.
13 Brun J, Abruzzese T, Rolauffs B, et al.Choice of xenogenic-free expansion media significantly influences the myogenic differentiation potential of human bone marrow-derived mesenchymal stromal cells[J].Cytotherapy, 2016, 18(3):344-359.
14 中国医师协会神经修复学专业委员会, 国际神经修复学会中国分会.中国神经修复细胞治疗临床应用指南(2015年版)[J].中华细胞与干细胞杂志:电子版, 2016, 6(1):1-7.
15 李洁, 傅勇辉, 吴琼, 等.冻存前后脐带间充质干细胞生物学特性的比较[J].实验与检验医学, 2014, 32(1):8-10.
16 Pham PV, Vu NB, Pham VM, et al.Good manufacturing practicecompliant isolation and culture of human umbilical cord bloodderived mesenchymal stem cells[J].Journal of Translational Medicine, 2014,12(1):56-65.
Generation of clinical grade umbilical cord mesenchymal stromal cells
Yuan Yanpeng, Wang Shuyan, Tang Xihe, Liu Zhongfeng, Zhang Yu, Chen Zhiguo.Cell Therapy Center, Xuanwu Hospital Capital Medical University, Beijing 100053, China
Corresponding author: Chen Zhiguo, Email:chenzhiguo@gmail.com
Objective To produce clinical grade umbilical cord mesenchymal stromal cells(UC-MSCs)with a umbilical cord in a GLP lab.Methods The umbilical cord was collected after delivery and the arteries, veins and blood cells were removed.Different treatment conditions were applied to compare the yield of UC-MSCs.The Wharton's jelly was cut to 1 mm3cubes, which were then either directly placed into an adhesive culture dish, or digested with different types of collagenases, followed by expansion in three types of serum free culture medium.After three passages in vitro, the cells were characterized and analyzed for cell viability, morphology, growth, sterility, endotoxin levels, chromosome karyotyping, surface antigen expression, and differentiation capacity.Data analysis between different groups was performed with coupled t test.Results Digestion with collagenase Ⅱor collagenaseⅠachieved the highest yield of MSCs(5.3×106±0.58/ml and 5.1× 106±0.57/ml, respectively, P = 0.07), both higher than treatment with collagenaseⅠ + 0.25﹪trypsin(2.53×105±0.03/ml)and enzyme-free method..The culture medium appeared clear after collagenase Ⅱ digestion.MSCs cultured in Stemcell MesenCult-ACF Medium showed optimal cell morphology.Before freezing, the cell viability was 99.8﹪, and 99﹪ after freezing and thawing.The obtained MSCs were negative for bacteria or mycoplasma contamination, hepatitis B virus(HBV),hepatitis C virus(HCV), human immunodeficiency virus(HIV), Mycoplasma pneumonia(MP), Treponema pallidum(TP), EB virus(EBV), and cytomegalovirus(CMV).The endotoxin levels were less than 1 EU as tested by ELISA.FACS results showed that more than 98﹪of the obtained cells were positive for CD73, CD90 and CD105, and more than 98﹪of the cells negative for CD34, CD45 and HLA-DR.The cells showed a normal karyotype and could be differentiated into adipocytes, osteoblasts and cartilage cells.Conclusion Clinical grade MSCs are generated in a GLP lab with optimized isolation/culture conditions.
Umbilical cord; Stromal cells; Collagenases; Culture media, serum-free; Cell differentiation
2016-09-26)
(本文编辑:陈媛媛)
10.3877/cma.j.issn.2095-1221.2017.02.001
100053 北京,首都医科大学宣武医院细胞治疗中心
陈志国,Email:chenzhiguo@gmail.com
袁艳鹏,王淑艳,唐玺和,等.临床级脐带间充质细胞制备及鉴定方法研究[J/CD].中华细胞与干细胞杂志(电子版),2017,7(2):65-70.

