人脐带间充质干细胞对小鼠实验性溃疡性结肠炎的疗效
翟俊山 李方 孙亚梅 宋久刚 吴凯 王艳梅 张林 姚怡 李楠
人脐带间充质干细胞对小鼠实验性溃疡性结肠炎的疗效
翟俊山 李方 孙亚梅 宋久刚 吴凯 王艳梅 张林 姚怡 李楠
目的 探讨人脐带间充质干细胞移植术对溃疡性结肠炎(UC)小鼠的疗效,以及对血清中肿瘤坏死因子α(TNF-α)、白细胞介素-8(IL-8)水平的影响。方法 选用雄性小鼠48只,完全随机分为正常对照组、模型对照组、脐带间充质干细胞(hUC-MSCs)治疗组,每组16只。模型对照组与hUC-MSCs治疗组通过口服5﹪葡聚糖硫酸钠诱导UC模型。对hUC-MSCs治疗组小鼠经尾静脉注射脐带间充质干细胞。观察各组疾病活动指数评分;采用酶联免疫吸附(ELISA)法测量各组小鼠血清中TNF-α、IL-8的表达水平,各组数据两组比较采用t检验,多组比较使用重复测量资料的方差分析对结果进行统计分析。结果 模型对照组与hUC-MSCs治疗组DAI评分从第2天开始上升,直至实验结束分别为8.72±0.71、4.01±0.35均高于正常对照组0.21±0.20,且差异有统计学意义(F = 1 300.66,P < 0.01);模型对照组与hUCMSCs治疗组比较,在造模期间及治疗的第4天DAI评分分别为7.95±0.71、8.01±0.73,差异无统计学意义(t = -0.24,P = 0.08),在治疗的第5天hUC-MSCs治疗组DAI评分开始下降为7.23 ±0.82,且与模型对照组8.01±0.81相比,差异有统计学意义(t = -2.71,P = 0.01)。造模第7天,模型对照组与hUC-MSCs治疗组两组TNF-α分别为(363.32±15.84)pg/ml、(375.52±16.21)pg/ ml,均高于空白对照组(112.14±11.23)pg/ml(F = 624.12,P < 0.01);模型对照组与hUC-MSCs治疗组两组IL-8分别为(65.32±10.12)pg/ml、(57.21±8.71)pg/ml均高于空白对照组(25.02± 7.81)pg/ml(F = 34.29,P < 0.01),但两组比较差异无统计学意义(P > 0.05);第2次干细胞注射7 d后即实验结束时,模型对照组与hUC-MSCs治疗组TNF-α分别为(453.23±15.63)pg/ml、(276.84±17.91)pg/ml,仍高于空白对照组(134.32±12.31)pg/ml(F = 642.41,P < 0.01);模型对照组与hUC-MSCs治疗组两组IL-8分别为(75.23±6.72)pg/ml、(39.12±4.42)pg/ml仍高于空白对照组(27.12±5.91)pg/ml(F = 113.90,P < 0.01),但hUC-MSCs治疗组水平较造模结束时有所下降,低于模型对照组(P < 0.05)。结论 间充质干细胞移植术对UC小鼠有良好的治疗作用,且能降低血清中TNF-α、IL-8的水平。
结肠炎,溃疡性; 脐带; 间质干细胞; 肿瘤坏死因子α; 白细胞介素8
溃疡性结肠炎(ulcerative colitis,UC)是一种累积全结肠的慢性炎症性肠病,同结直肠癌密切相关,与克隆恩病(Crohn's disease,CD)统称炎症性肠病(inflamaatory bowel disease,IBD)[1-2]。其确切病因仍不明确,可能与肠道细菌感染、患者情绪压抑及遗传因素有关[3]。UC的药物治疗主要包括5-氨基水杨酸、糖皮质激素、免疫抑制剂和分子靶向药物等几大类,但由于药物治疗只能使患者尽可能的长期处于疾病的缓解期,并不能从根本上治愈疾病[4]。加之药物长期临床使用易产生严重的不良反应,新研发药物价格昂贵,使UC药物治疗受到了限制。本研究对实验性UC小鼠模型进行人脐带间充质干细胞(human umbilical cord derived mesenchymal stem cells,hUC-MSCs)移植,观察疗效,并且同时测量移植前后小鼠血清中肿瘤坏死因子α(TNF-α)、白细胞介素-8(IL-8)水平。
材料与方法
一、材料
1.实验动物:实验性SPF级C57BL/6J雄性小鼠48只,6 ~ 8周龄,体质量20.1 ~ 23.2 g,购自北京维通利华公司。在解放军309医院动物房饲养,饲养室内温度:20 ~ 22℃;湿度:50﹪~ 60﹪;光照周期:12 h,实验开始前所有小鼠在上述饲养环境中适应4 d。
2.试剂及仪器:hUC-MSCs由中美康士生物有限公司馈赠、DSS干粉(美国MP公司)、细胞培养基(美国Gibco公司)、IX70显微镜(日本Olympus公司)、PKH26(西安依科生物技术有限公司)、TNF-α、IL-8与CRP试剂盒(美国强生公司)、CX23荧光显微镜(日本Olympus公司)。
二、方法
1.细胞悬液制备:取第2代细胞培养扩增,共培养扩增5代。取第5代细胞移植前溶于生理盐水中,在细胞悬液中加入浓度为4×10-6mmol/L的PKH26荧光示踪剂,染色方法按说明书进行,最终细胞悬液浓度调整为1×107/ml。
2.动物模型制备:对实验性小鼠编号后,通过SPSS统计软件完全随机分为3组:空白对照组、模型对照组与hUC-MSCs治疗组,每组16只。空白对照组自由饮用蒸馏水,模型对照组与hUC-MSCs治疗组小鼠自由饮用5﹪的葡聚糖硫酸钠(dextran sulfate sodium,DSS),造模时间7 d。模型制备过程中,小鼠如出现稀便、粪便隐血阳性,肉眼血便中任一项即可认定造模成功。实验过程中如有小鼠死亡,移出饲养笼。
3.干细胞移植方法:造模结束后的第1天及第3天,对hUC-MSCs治疗组小鼠经尾静脉分别缓慢注射已染色细胞悬液200 μl(含2×106个PKH26标记的hUC-MSCs);对空白对照组及模型对照组分别经尾静脉注射等体积PKH26染色剂与生理盐水的混合液。
4.观察指标:实验第1天起,观察实验小鼠的精神状态,饮食、活动和毛发,每天测量体质量,观察大便情况,是否成型,有无血便,是否粘连在肛门上。结合上述指标对小鼠进行疾病活动度指数(DAI)评分(表1)。

表1 DAI评分标准
5.细胞因子测定:在造模第7天及试验结束后分别取各组小鼠6只,摘除眼球后眼眶取血。标本离心10 min,相对离心场(relative centrifugal field,RCF)为300×g。取上层血清,分装于EP管中,保存于-20 ℃中。采用美国强生公司试剂盒双抗体夹心ELISA法检测细胞因子TNF-α及IL-8水平,检测方法按试剂盒说明书操作。并同时监测C反应蛋白(C-reactive protein,CRP)水平。
6.结肠组织病理及干细胞定位情况观察:实验结束后处死所有小鼠,留取结肠组织。部分结肠组织经4﹪甲醛(福尔马林)固定24 h后制作HE染色石蜡切片,光镜下观察结肠病理变化。部分结肠组织放入干冰冻存,于-70 ℃冰箱保存。按4 ~ 5 μm进行切片,荧光显微镜下观察干细胞分布情况。
三、统计学分析方法
采用SPSS 19.0软件进行统计学处理。各组实验动物DAI评分、血清TNF-α及IL-8结果采用±s表示,模型对照组与治疗组两组之间比较用t检验分析,空白对照组、模型对照组与治疗组3组比较,使用重复测量资料的方差分析,以P < 0.05为差异有统计学意义。
结 果
一、干细胞扩增情况
高倍显微镜下观察干细胞,扩增至第4代时,形态呈长梭形,融合率50﹪,扩增至第5代时,融合率90﹪,呈旋涡状排列(图1)。
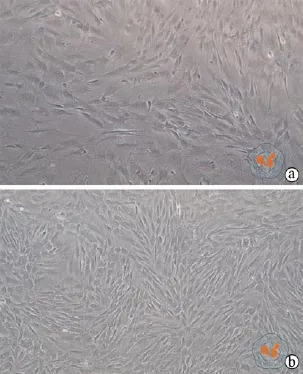
图1 普通光显微镜下观察人脐带间充质干细胞形态(×100)
二、造模情况
经过自由饮用5﹪的DSS 7 d后,模型对照组与hUC-MSCs治疗组小鼠均不同程度出现稀便、血便、体质量下降,活动度减少,精神萎靡等情况,认为全部造模成功。但模型对照组与治疗组分别有1只小鼠于第5和第7天死亡,予以剔除。对照组小鼠未出现稀便、血便等情况,试验中无死亡。
三、DAI评分
通过测量并记录各组小鼠体质量、大便性状、血便情况,计算各组小鼠DAI评分情况。模型对照组与hUC-MSCs治疗组DAI评分从第2天开始上升,直至实验结束分别为8.72±0.71、4.01±0.35均高于正常对照组0.21±0.20,差异具有统计学意义(F = 1300.66,P < 0.01);模型对照组与hUC-MSCs治疗组比较,造模期间及治疗的第4天DAI评分分别为7.95±0.71、8.01±0.73,差异无统计学意义(t = -0.24,P = 0.08),治疗的第5天hUC-MSCs治疗组DAI评分开始下降为7.23±0.82,且与模型对照组8.01±0.81相比,差异有统计学意义(t = -2.71,P = 0.01,表2)。
四、细胞因子水平
造模第7天,模型对照组与治疗组两组TNF-α、IL-8、CRP均高于空白对照组(P < 0.01),但两组比较差异无统计学意义(P > 0.05);第2次干细胞注射7 d后即实验结束时,模型对照组与治疗组TNF-α、IL-8、CRP仍高于空白对照组(P < 0.01),但治疗组水平较造模结束时有所下降,低于模型对照组(P < 0.05,表3)。
五、结肠组织病理及干细胞定位结果
1.病理结果:空白对照组小鼠结肠上皮黏膜完整,黏膜及黏膜下少量炎性细胞浸润;模型对照组结肠上皮黏膜多处缺损,黏膜及黏膜下大量炎性细胞浸润;hUC-MSCs治疗组黏膜上皮缺损及炎性细胞浸润程度轻于模型对照组(图2)。
表2 hUC-MSCs移植术后各组小鼠DAI评分表(n = 16,±s)

表2 hUC-MSCs移植术后各组小鼠DAI评分表(n = 16,±s)
注:hUC-MSCs:人脐带间充质干细胞;与正常对照组比较,aP < 0.01;与模型对照组比较,bP < 0.05
分组 第1天 第2天 第3天 第4天 第5天 第6天 第7天 第8天 第9天正常对照组 0.28±0.07 0.31±0.23 0.35±0.21 0.29±0.22 0.21±0.19 0.34±0.23 0.43±0.26 0.37±0.21 0.39±0.25模型对照组 0.26±0.03 2.01±0.07a 3.91±0.12a 4.12±0.23a 5.13±0.34a 6.08±0.44a 6.67±0.51a 7.23±0.61a 7.47±0.71a治疗组 0.31±0.02 1.68±0.06a 3.47±0.14a 4.33±0.25a 5.52±0.31a 6.43±0.46a 6.55±0.48a 7.12±0.59a 7.63±0.67aF值 0.00 635.28 2 781.59 1 515.73 1 696.68 1 225.20 1 112.72 969.61 808.03 P值 > 0.05 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01分组 第10天 第11天 第12天 第13天 第14天 第15天 第16天 第17天正常对照组 0.44±0.24 0.16±0.12 0.19±0.12 0.22±0.16 0.35±0.25 0.32±0.23 0.24±0.22 0.21±0.20模型对照组 7.65±0.67a 7.95±0.71a 8.01±0.81a 8.23±0.82a 8.43±0.79a 8.54±0.68a 8.61±0.65a 8.72±0.71a治疗组 7.83±0.65a 8.01±0.73a 7.23±0.82ab 6.91±0.61ab 5.53±0.54ab 5.01±0.43ab 4.23±0.37ab 4.01±0.35abF值 918.22 930.65 663.18 827.28 822.15 1 165.67 1 384.16 1 300.66 P值 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01
表3 造模第7天及实验结束时各组小鼠细胞因子TNF-α、IL-8与CRP水平(±s)
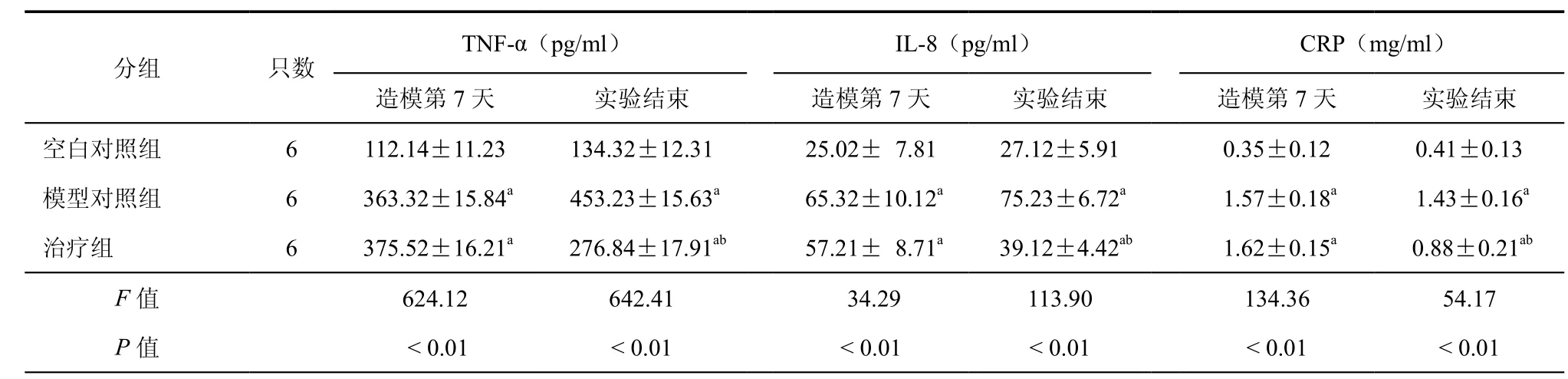
表3 造模第7天及实验结束时各组小鼠细胞因子TNF-α、IL-8与CRP水平(±s)
注:hUC-MSCs:人脐带间充质干细胞;与正常对照组比较,aP < 0.01;与模型对照组比较,bP < 0.05
TNF-α(pg/ml) IL-8(pg/ml) CRP(mg/ml)造模第7天 实验结束 造模第7天 实验结束 造模第7天 实验结束空白对照组 6 112.14±11.23 134.32±12.31 25.02± 7.81 27.12±5.91 0.35±0.12 0.41±0.13模型对照组 6 363.32±15.84a 453.23±15.63a 65.32±10.12a 75.23±6.72a 1.57±0.18a 1.43±0.16a治疗组 6 375.52±16.21a 276.84±17.91ab 57.21± 8.71a 39.12±4.42ab 1.62±0.15a 0.88±0.21abF值 624.12 642.41 34.29 113.90 134.36 54.17 P值 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01分组 只数
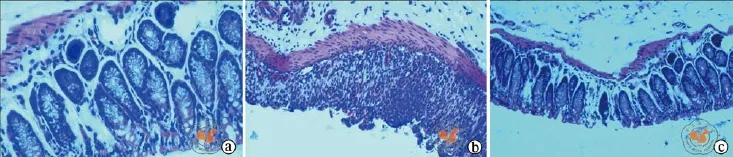
图2 光学显微镜下观察各实验组小鼠结肠组织病理照片(HE染色,×200)
2.干细胞定位结果:PKH26染色剂在荧光显微镜下发红光,观察小鼠结肠组织冰冻切片可见黏膜及黏膜下大量细胞发红色荧光,证实干细胞在结肠组织中主要定位于黏膜及黏膜下层(图3)。
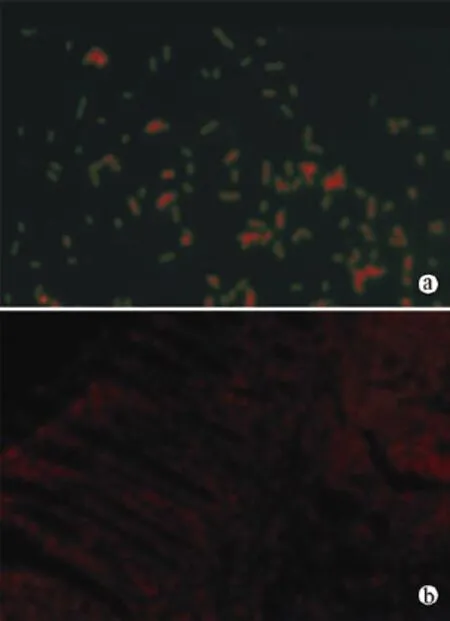
图3 荧光显微镜下观察hUC-MSCs在结肠定位情况(PKH26染色)
讨 论
干细胞因其良好的分化潜能,目前成为医学研究的热点,在一些常规药物治疗效果不佳的疾病如脑梗塞[5]、肝硬化[6-7]方面展现出良好的应用前景。其中的hUC-MSCs因其来源方便,不涉及医学伦理,组织相容性低等特点,成为研究的热点[8]。
在本次试验中,采用目前公认的DSS进行UC动物造模[9]。经过7 d自由饮用模型组与治疗组除各有1只老鼠死亡均不同程度出现了稀便、血便,DAI评分明显高于正常对照组,本研究认为这种造模方法可靠、简便、经济。
UC主要损伤部位是结肠浅表黏膜,黏膜表面充血糜烂,出现隐窝脓肿,黏膜细胞脱落坏死引起大便性状改变、便血,临床上出现腹痛、消瘦等症状。治疗UC黏膜细胞的修复是重要的一环[10]。干细胞因其潜在多向分化属性,从尾静脉注入体内后可迁徙并定居于肠黏膜表面,分化并增殖为新的结肠黏膜细胞[11]。这个现象在本实验中通过在结肠组织中观察到荧光染色的干细胞,而得以证实。但具体如何通过趋化、黏附、定位在肠道黏膜机制尚不清楚。在本实验中,治疗组的小鼠经过2次干细胞移植,活动状态、饮食状况、便血情况均得到改善,DAI评分较模型组下降,显示出干细胞在治疗UC上良好的效果。
UC发病机制中免疫因素起了重要的作用,免疫紊乱是突出表现,多种免疫细胞参与其中,诱导不正常的免疫反应。据报道,UC肠道内细菌具有和结肠黏膜组织类似的免疫原性,造成了自身免疫组织对结肠黏膜的攻击,其中细胞炎性因子是重要的因素[12]。TNF-α与IL-8是肠道两种重要的炎性因子,相互作用,共同诱发炎性反应。TNF-α由巨噬细胞、T淋巴细胞、B淋巴细胞和肥大细胞等释放,主要发挥局部作用,低浓度就可以诱导肠道黏膜出现炎症反应[13]。TNF-α作用机制为通过诱导IL-8等细胞因子,趋化自然杀伤细胞、细胞毒性T细胞等效应细胞,引起炎症反应[14]。因此降低TNF-α和IL-8在体内的水平,可以降低肠道炎性反应,减轻临床症状。在本实验中,模型对照组与治疗组在造模结束后,小鼠血清中TNF-α与IL-8明显高于正常对照组,说明这两种细胞因子与UC发病密切相关。治疗组经过脐带血干细胞移植,两种细胞因子水平较模型对照组明显下降,说明脐带血干细胞移植可以降低小鼠结肠炎症反应。这一点通过同时监测小鼠体内经典CRP水平也得到了证实。但是干细胞移植降低TNF-α和IL-8水平的具体机制尚需进一步实验去探索。
1 Grivennikov SI, Cominelli F.Colitis-Associated and Sporadic Colon Cancers: Different Diseases, Different Mutations?[J].Gastroenterology, 2016,150(4):808-10.
2 叶院宁, 余纳, 孙文荣, 等.粪便新喋呤及钙卫蛋白对炎症性肠病活动性的诊断价值[J].医学研究生学报, 2016, 29(2):159-164.
3 Becker C, Neurath MF, Wirtz S.The intestinal microbiota in inflammatory bowel disease[J].ILAR J, 2015, 56(2):192-204.
4 Hata K, Ishihara S, Watanabe T.Diagnosis and treatment for colitis associated cancer[J].Nihon Shokakibyo Gakkai Zasshi, 2016, 113(3):430-438.
5 Abeysinghe HC, Bokhari L, Quigley A, et al.Pre-differentiation of human neural stem cells into GABAergic neurons prior to transplant results in greater repopulation of the damaged brain and accelerates functional recovery after transient ischemic stroke[J].Stem Cell Res Ther, 2015, 6:186.
6 Mohamed HE, Elswefy SE, Rashed LA, et al.Bone marrow-derived mesenchymal stem cells effectively regenerate fibrotic liver in bile duct ligation rat model[J].Exp Biol Med (Maywood), 2016, 241(6):581-591.
7 汪国营, 唐晖, 易慧敏, 等.间充质干细胞治疗肝移植术后难治性急性移植物抗宿主病临床研究[J].中华移植杂志(电子版), 2015,9(3) : 133-136.
8 Damien P, Allan DS.Regenerative therapy and immune modulation using umbilical cord Blood-Derived cells[J].Biol Blood Marrow Transplant, 2015, 21(9):1545-1554.
9 Randhawa PK, Singh K, Singh N, et al.A review on chemical-induced inflammatory bowel disease models in rodents[J].Korean J Physiol Pharmacol, 2014, 18(4):279-288.
10 Wiernicka A, Szymanska S, Cielecka-Kuszyk J, et al.Histological healing after infliximab induction therapy in children with ulcerative colitis[J].World J Gastroenterol, 2015, 21(37):10654-10661.
11 Salcedo L, Penn M, Damaser M, et al.Functional outcome after anal sphincter injury and treatment with mesenchymal stem cells[J].Stem Cells Transl Med, 2014, 3(6):760-767.
12 Huang Y, Chen Z.Inflammatory bowel disease related innate immunity and adaptive immunity[J].Am J Transl Res, 2016, 8(6):2490-2497.
13 Kuo B, Bhasin M, Jacquart J, et al.Genomic and clinical effects associated with a relaxation response Mind-Body intervention in patients with irritable bowel syndrome and inflammatory bowel disease[J].PLoS One, 2015, 10(4):e0123861.
14 钟玉芬, 颜海帆, 陈振华.奥替溴铵对肠易激综合征患者IL-18和TNF-α的影响[J].中国现代医生, 2011, 49(36):40-41.
Curative effect of human umbilical cord mesenchymal stem cells on ulcerative colitis mice
Zhai Junshan, Li Fang, Sun Yamei, Song Jiugang, Wu Kai, Wang Yanmei, Zhang Lin, Yao Yi, Li Nan.Department of Gastroenterology, the 309th Hospital of Chinese People's Liberation Army, Beijing 100091, China
Corresponding author: Li Nan, Email: fmmuzjs@163.com
Objective To investigate human umbilical cord derived mesenchymal stem cells(hUC-MSCs)transplantation for the treatment of ulcerative colitis(UC)in mice, and evaluated the effect of hUC-MSCs on tumor necrosis factor-alpha(TNF-α)and interleukin-8(IL-8)production.Methods Forty eight male adult mice were randomly divided into three groups, namely normal control group, model control group and hUC-MSC group, with 16 mice in each group.UC was induced by drinking 5﹪ dextran sulfate sodium(DSS).The hUC-MSC group was treated by i.v.hUC-MSCs cells through tail vein.The disease activity index(DAI)was evaluated and TNF-α and IL-8 were detected by ELISA.t-test was used to determine statistical significance between the two groups, and ANOVA was used among the three groups.Results The DAI began to rise at the second day for the model control group and the hUC-MSCs group, which were(8.72±0.71)and(4.01± 0.35)respectively at the end of the experiment, both higher than the normal control group(0.21 ±0.20, F = 1 300.66, P = 0.000).The DAI were not different between the model control group and the hUC-MSCs group at the 4 days after induction of UC(7.95±0.71 vs 8.01±0.73, t = - 0.236, P = 0.08153).The DAI of the hUC-MSCs group began to decrease at the 5th treatment day and was lower than that of the model control group(7.23±0.82 vs 8.01±0.81, t = -2.707, P = 0.0111).TNF-α levels of the model control group(363.32±15.84)pg/ml and the hUC-MSCs group(375.52 ±16.21)pg/ml were similar(P > 0.05), but higher than that of the normal group(112.14±11.23)pg/ml at the 7th day(F = 624.12, P = 0.000); IL-8 level of the model control group(65.32±10.12)pg/ml and the hUC-MSCs group(57.21±8.71)pg/ml were similar(P > 0.05), but higher than that of the normal group(25.02±7.81)pg/ml at the 7th day(F = 34.29, P = 0.000).Seven days after the second injection of stem cells(the end of experiment), TNF-α level of the model control group(453.23±15.63)pg/ml and the hUC-MSCs group(276.84±17.91)pg/ml were higher than that of the normal group[(134.32±12.31)pg/ml, F = 642.41, P = 0.000]; IL-8 level of the model control group(75.23±6.72)pg/ml and the hUC-MSCs group(39.12±4.42)pg/ml were higher than that of the normal group[(27.12±5.91)pg/ml, F = 113.90, P = 0.000], but TNF-α and IL-8 levels of the hUC-MSCs group were lower than that of the model group(P < 0.05).Conclusion hUC-MSCs may alleviate UC in DSS-treated mice via decreasing production of TNF-α and IL-8.
Colitis, ulcerative; Umbilical cord; Mesenchymal stem cells; Tumor necrosis factor-alpha; Interleukin-8
2016-10-05)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2017.02.005
北京市自然科学基金(13G30191)
100091 北京,解放军第309医院消化科
李楠,Email:fmmuzjs@163.com
翟俊山,李方,孙亚梅,等.人脐带间充质干细胞对小鼠实验性溃疡性结肠炎的疗效[J/CD].中华细胞与干细胞杂志(电子版),2017,7(2):87-92.

