黑素小体的结构及功能研究进展
钟敏,岳芸芸*,尚靖,2,3,4*
(1.中国药科大学中药学院,江苏 南京 211198;2.中国药科大学江苏省中药评价与转化重点实验室,江苏 南京211198;3.中国药科大学天然药物活性组分与药效国家重点实验室,江苏 南京 210009;4.国家药品监督管理局化妆品研究与评价重点实验室,北京 100050)
0 引言
黑素细胞中的黑素小体是黑色素合成和储存的细胞型特异性细胞器,黑素在黑素小体中合成后,黑素小体被进一步转运到角质形成细胞,最终随着角质形成细胞的分化而被降解。成熟黑素小体的功能决定了人类皮肤的颜色。深色皮肤的黑素小体比白色皮肤的黑素小体更大,色素更稠密[1],并且更频繁地转移到角质形成细胞[2]。色素紊乱性疾病的发生和黑素小体发育、转运密切相关,研究证明黑素小体的功能异常会导致严重的色素性疾病的发生。
1 黑素小体的来源及分类
黑素合成是黑素细胞最重要的生物学功能,黑素小体作为黑素细胞特有的细胞器是合成和贮存黑素的主要场所,也是一种溶酶体相关的细胞器[3]。它起源于核周的多囊泡小体,随着囊泡的不断分化、成熟,多种黑素合成相关蛋白进入囊泡,使得前黑素小体具有了黑素合成能力[4]。根据所包含的黑色素不同,分为真黑素小体和褐黑素小体。真黑素小体呈椭圆形,往往比褐黑素小体大,有明显的蛋白质样纤维基质,它是真黑色素在黑素小体成熟早期整齐有序排列所必需的;而褐黑素小体是呈圆形,色素表面粗糙,所包含的蛋白多于真黑素小体,且为无定型的蛋白纤维基质[5-6]。早期的真黑素小体可以在透射电镜下观察到完整的黑色素纤维堆积产生的条纹,而褐黑素小体在镜下呈不完全黑化斑点状的条纹[7]。
2 黑素小体的发生
2.1 黑素小体成熟过程
黑素小体经过四个阶段成熟并产生黑色素(图1)。第Ⅰ阶段为前黑素小体阶段,这一阶段含有很多腔内囊泡 (intraluminal vesicles,ILVs),PMEL(也称为Pmel17或gp100)一种膜蛋白在此被蛋白水解,从而使腔内囊泡伸出不规则纤维[8],此阶段不含任何色素且细胞器呈球状。第Ⅱ阶段,黑素小体伴随着腔内囊泡延长,外部形成纤维状结构,内部产生纤维基质,这一阶段有黑素生成酶从反式高尔基网络或早期内体系统运输来[9];第Ⅲ阶段,合成的黑素存储在PMEL有序纤维上,产生第三阶段黑素小体特有的厚纹[10];第Ⅳ阶段,黑色素继续在淀粉样纤维上合成和沉积直到充满内部纤维结构,形成完全着色的成熟黑素小体[11]。
2.2 黑素小体的生物发生及功能行使
2.2.1 第一阶段
第Ⅰ阶段为前黑素小体阶段,这一阶段含有很多腔内囊泡 (intraluminal vesicles,ILVs),PMEL(也称为PMEL17或GP100)是一种膜蛋白,它被转运到未成熟的黑素小体是黑素小体生物发生的早期步骤,但其实现机制尚不完全清楚。PMEL被带入I期未成熟黑素小体的管腔,并被蛋白水解,这一过程是腔内囊泡伸出不规则纤维所必需的[12]。许多蛋白质形成淀粉样纤维与神经退行性疾病(包括阿尔茨海默病和帕金森氏病)等有关。而PMEL纤维,由于一种名为ApoE[13]的脂蛋白的存在,表现为生理性、非致病性的淀粉样纤维[14],并且表现出有序的纤维化。这种脂蛋白集中在ILV的表面,并覆盖PMEL的片段,推测ApoE通过ILV来引导PMEL有组织的纤维化[15],此阶段不含任何色素且细胞器呈球状。
2.2.2 第二阶段
第Ⅱ阶段,黑素小体伴随着囊泡延长,在Pmel17的促进下,黑素小体外部形成纤维状结构,内部产生纤维基质[16]。这一阶段有酪氨酸酶等黑素小体蛋白从反式高尔基网络或早期内体系统运输来[17]。据报道,参与黑素小体蛋白运输主要有两种途径:一种是溶酶体相关细胞器复合体(BLOC-1)依赖途径,另一种是BLOC-1非依赖/AP-3依赖途径(图1)。BLOC-1是由8个亚基组成的蛋白质复合体,最初定位于早期内体,具有弯曲结构[18],主要调节某些黑素小体蛋白(包括ATP7A和Tyrp1)从早期核内体到黑素小体的转运[19-20]。BLOC-2是由三个亚基组成的蛋白质复合体,也定位于早期内体,研究推测它在BLOC-1下游发挥运输载体的作用,并且能够促进含有黑素小体蛋白的循环核内体和成熟黑素小体之间的融合[21]。APs是四聚体蛋白质复合物,能够介导蛋白进入囊泡后的分选。目前已有五种APs被报道,其中AP-3依赖途径主要用于酪氨酸酶向黑素小体的转运[22]。

图1 调节黑素小体生物发生的内体和黑素小体运输系统示意图[31]
2.2.3 第三阶段
这一阶段,BLOC-3作为Rab32/38特定的鸟嘌呤核苷酸交换因子,能够使Rab32/Rab38与GTP结合从而被激活[23]。研究发现BLOC-3基因表达缺陷会导致无法招募Rab32/Rab38-锚蛋白重复蛋白(ankyrin repeat protein,Varp),并且使包括酪氨酸酶、Tyrp1和Dct在内的黑素生成酶的运输受阻[24-27]。Rab32/Rab38-Varp复合体也被认为能调节酪氨酸酶和Tyrp1从早期内体到黑素小体的顺行运输[28]。在黑素小体第Ⅲ阶段,黑素小体膜上a-促黑素皮质激素(a-MSH)与黑皮质素受体1(MC1R)结合后,通过上调cAMP水平,激活真黑素的合成, 这一过程在各种黑素生成酶催化下将酪氨酸转化为多巴醌类,并最终生成真黑素[29]。若Agouti基因编码的刺豚鼠信号蛋白高表达,就会与a-MSH竞争性结合MC1R,从而下调cAMP水平,激活褐黑素的合成[30]。最终黑素合成并存储在淀粉样纤维上,并使其变黑增厚。
2.2.4 第四阶段
第四阶段Rab32/Rab38-Varp复合体通过与肌球蛋白Ⅵ合作,能够从成熟的黑素小体中回收膜囊泡蛋白7 (VAMP7)[26]。回收的VAMP7被认为会返回到早期的内体中,进行下一轮的黑素生成酶运输。在这一阶段黑色素继续在淀粉样纤维上合成和沉积直到充满内部纤维结构,形成完全着色的成熟黑素小体[11]。
3 黑素小体的运输与转运
3.1 黑素小体在黑素细胞内的运输
20世纪70年代的开创性工作表明,在非哺乳动物黑素细胞中,微丝[32]和微管[33]负责将黑素小体从细胞体向外运输到树突尖端(即离心),并从树突的远端返回细胞体(向心)。非洲爪蟾的黑素细胞表达Kinesin-Ⅱ和dynein,前者是一种微管相关的负责正端定向运动的蛋白,后者是一种微管相关的负端定向运动蛋白[34]。在低等脊椎动物中,黑素小体沿着树突的双向移动更快。这种黑素小体在细胞内的选择性移位可以使其在细胞体内聚集,也可以分散在树突上,这种特性与皮肤颜色的深浅相关,能够很快地适应环境。相反,哺乳动物黑素细胞中黑素体沿树突的运动不是通过双向运动的方法进行的。
在哺乳动物皮肤黑素细胞中,黑素小体在核周区域成熟,并与驱动蛋白(一种正端导向的微管马达)结合。黑素小体以离心方式沿着微管向细胞外围移动。一旦黑素小体到达细胞的外围,它就会从微管中分离出来,并通过分子马达肌球蛋白Ⅴa与临近的肌动蛋白细丝结合在一起,在其上经历局部的短程运动(图2)[35]。这一步骤将黑素小体均匀分布在细胞的外围,从那里它们可以转移到相邻的角质形成细胞。
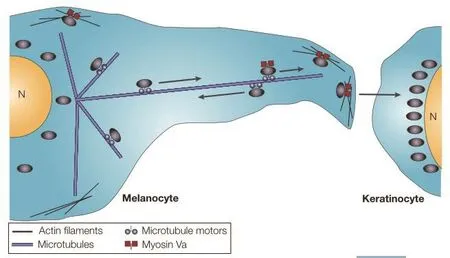
图2 表皮黑素细胞中黑素小体转运模型[36]
那么哺乳动物中肌球蛋白Ⅴa又是如何与黑素小体连接的呢?目前研究发现主要有Rab27a、leaden一起参与了黑素小体的运输,猜测可能存在2种模型机制:在模型1中,Rab27a的膜结合需要leaden,Rab27a进而通过其尾巴招募肌球蛋白Ⅴa。在模型2中,Rab27a首先与成熟的黑素小体结合,然后招募leaden,leaden又将肌球蛋白Ⅴa招募到黑素小体。在这两种模型中,肌球蛋白Ⅴa的头部结构域与肌动蛋白细丝的结合将黑素小体与外周肌动蛋白网络联系起来(图3)[36]。
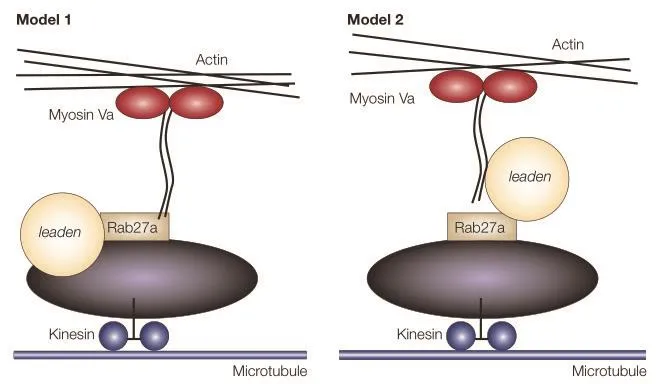
图3 黑素小体转运分子机制模型[36]
3.2 黑素小体从黑素细胞转运到角质形成细胞
3.2.1 转运机制
黑素小体从黑素细胞转移到角质形成细胞是唯一已知的细胞器在细胞间移动的例子。近年来提出了4种黑素小体在黑素细胞和角质形成细胞之间运输的机制(图4)[38]。
①细胞吞噬模型(图4A):Singh等人[39]通过检测和跟踪正在发育的黑素小体表面的蛋白gp100得到证实,角质形成细胞可以吞噬黑素细胞中富含黑素小体的树突尖端。②膜融合模型(图4B):在人类皮肤中,Scott等人[40]研究发现黑素细胞树突在肌球蛋白Ⅴa的存在下,能够形成丝状伪足,随后有一列单独的黑素小体沿着丝状伪足移动,并穿过这个快速形成的通道进入角质形成细胞。③脱落吞噬模型(图4C):Wu等人[41]研究报导黑素细胞将黑素小体包装成珠状,然后将其转移在黑素细胞外围,角质形成细胞随后捕获并吞噬这些黑素小球。④胞外分泌内吞模型(图4D):黑素细胞通过胞外分泌作用将不含黑素小体膜的黑色素内核释放到黑素细胞和角质形成细胞之间的细胞外间隙。随后,黑色素内核通过吞噬作用被角质形成细胞内化,并在核周区域成簇存在[38]。目前多项研究支持黑素小体的转运主要通过机制3和机制4完成。
3.2.2 转运关键蛋白
最近有研究表明,质膜糖蛋白、凝集素可能调节黑素细胞和角质形成细胞之间黑素小体的识别、相互作用以及物质转移。Kieda等人发现各种凝集素或新糖蛋白可以抑制人黑色素瘤细胞和鳞状细胞癌来源的角质形成细胞之间的黑素小体转移[42-43]。作者通过一种体外模型,用荧光染料(羧基荧光素二乙酸琥珀酰亚胺酯)预先标记黑素细胞,随后与角质形成细胞共培养,通过共聚焦显微镜监测荧光的转移并通过流式细胞术定量证实黑素小体的转移。利用该模型系统,证实了Kieda等人的观察结果,即各种凝集素和新糖蛋白可以抑制黑素小体向角质形成细胞的转移。此外,也有研究证明了烟酰胺也能抑制黑素小体的转移[44]。
蛋白激酶受体2(PAR-2)在角质形成细胞吞噬黑素小体的过程中也非常重要。它是质膜上的一种跨膜G蛋白偶联受体,被丝氨酸蛋白酶在细胞外切割发生自激活[45]。Seiberg等人通过一系列实验证明,PAR-2受体位于角质形成细胞的膜上,通过激活角质形成细胞对分离的黑素小体[46]或微球[47]的吞噬活性参与黑素小体的转移从而调节色素颗粒的吞噬量。
3.3 黑素小体在角质形成细胞内的分布
黑素小体在角质形成细胞内的分布根据肤色的不同而不同[48-49]。在深色皮肤的个体中,黑素小体直径约0.8mm,以单个细胞器的形式存在于角质形成细胞的胞质中。相反,在浅色皮肤的个体中,黑素小体直径明显小于0.8mm,并聚集成由4-8个细胞器组成的膜结合簇。目前还不确定这些不同的分布模式是由转移的黑素小体内的因素决定的,还是由于受体角质形成细胞固有的性质决定。在最近的一项研究中,利用不同肤色的几组黑素细胞和角质形成细胞,评估了体外皮肤重建模型角质形成细胞中黑素小体的分布,研究人员得出结论,受体黑素小体的分布模式由供体黑素细胞的类型决定[50]。相反,最近在黑素细胞和角质形成细胞共培养中的实验证明,转移的黑素小体的分布模式受受体角质形成细胞来源的皮肤类型调节[51]。然而,这两种实验方法都相对主观,因此黑素小体在皮肤中的分布调节问题仍然没有解决。
4 黑素小体的降解
随着角质形成细胞的终末分化,受体黑素小体也会发生降解。最终,除极少数出现在颜色非常深的皮肤情况下,当角质形成细胞变成角质细胞后,黑素小体结构将不复存在[52]。
黑素小体的解体是一个渐进的过程。轻度解体的色素颗粒在边缘出现磨损,附近有黑色素碎片。随着解体程度的加深,黑素小体出现解体,密度降低。在晚期,黑素小体的基质结构逐渐变得明显并与黑色素碎片混合[53]。但目前研究发现,除了黑素小体成分可被水解降解,黑素小体中的黑色素部分很难被分解。日本科学家在用溶酶体水解酶处理放射性标记的黑素小体后,注意到黑素小体的脂类快速降解,蛋白质成分缓慢降解,但黑色素部分仍然很稳定[54-56]。有研究表明黑素小体的黑色素部分能在120℃抵抗强盐酸 72小时[57-58]。在组织学中,黑色素主要是通过用氧化剂如高锰酸盐[59]或过氧化氢[60]进行色素漂白来去除的。用过氧化氢高温加热会使黑色素部分分解,并产生强荧光,可用于黑色素定量[61-62]。但产生的荧光素的性质尚不清楚,目前有人提出荧光表明黑色素聚合物中的结构发生损坏[63]。
5 调节黑素小体形态和内环境的相关基因
除了黑素小体结构蛋白和黑素生成酶外,黑素合成还需要某些转运蛋白(或离子通道)来优化黑素小体的管腔pH和其他离子(如Cu2+和Zn2+)的浓度。最近,一些定位于黑素小体膜的转运蛋白的功能已被揭示。
5.1 OCA2
OCA2是眼皮肤白化病的致病基因产物,在黑色素细胞和视网膜色素上皮细胞黑色素生物合成中有着重要作用[64-65]。研究发现OCA2蛋白有12个跨膜结构域,相当于Na+/H+离子泵,OCA2通过泵出H+来维持黑素小体腔内PH,使酪氨酸酶发挥最佳活性来催化酪氨酸产生黑色素[66]。OCA2表达量降低可使黑素小体内PH降低,从而导致酪氨酸酶活性减低,黑色素合成减少[67]。S.Park等[68]通过电镜观察发现,下调OCA2的表达,将导致黑素小体形态、结构、数量以及黑色素含量显著减少。
5.2 P转运蛋白
P转运蛋白是一种含有12个跨膜结构域的蛋白,在pink-eyed dilute小鼠和人类眼皮肤白化病2型患者中缺乏。P转运蛋白的突变影响了黑素小体的酸性、形态和蛋白定位[69-71]。基于P蛋白与某些细菌转运蛋白的同源性,Brilliant提出P蛋白通过转运阴离子来抵消未成熟黑素小体中的高质子含量[72]。通过改变管腔内的酸碱度或膜电位,P转运蛋白缺乏可能影响转运小泡与靶前黑素小体融合的能力,导致小泡聚集或错误靶向溶酶体。
5.3 TPC2
两孔通道2(Two-pore channel 2,TPC2)也与人类色素沉着疾病有关。据推测,TPC2可以使Na+、Ca2+等阳离子穿过黑素小体膜。已有研究表明抑制TPC2可提高黑素小体的管腔pH值来促进色素沉着。虽然TPC2是通过转运哪种阳离子来对黑素小体的酸化起作用尚不清楚,但已提出通过Na+或Ca2+外流介导的黑素小体膜电位的增加来调节V-ATPase酸化黑素小体的功能[73-74]。
6 总结
黑素小体是一种特殊的含有黑色素的细胞内细胞器。它在高度树突化的黑素细胞内发育,从无色素前体开始,到黑色素包被膜包住的阶段结束。在表皮黑素细胞中,黑素小体被运输到树突的顶端,随后转移到邻近的角质形成细胞(黑素小体转移到大约36个相邻的角质形成细胞[75]),角质形成细胞在基底层保留黑色素,并在黑色素移动到皮肤表面分化时将其降解。黑素小体内环境的稳定依赖于OCA2、P转运蛋白和TPC2等对腔内PH的调控,酸性环境的破坏将会影响酪氨酸酶活性,直接导致黑色素产生受阻。所以以黑素小体为核心黑素小体的形态发生和成熟,黑素小体蛋白的正常转入,黑素小体的转运以及其稳定的内环境,都是黑色素合成的基础条件。因此对黑素小体的正确认识将有助于对色素性疾病的治疗提供重要的研究思路和理论指导。

