白细胞介素17与甲状腺相关性眼病的Meta分析
尹谢添,赵诗超,向楠,陈继东,曾明星,周广文
(1.湖北中医药大学第一临床学院,湖北 武汉 430061;2.湖北省中医院风湿免疫科,湖北 武汉 430061;3.向楠名医工作室,湖北 武汉 430061;4.湖北省中医院老年病科,湖北 武汉 430061;5.湖北省中医院内分泌科,湖北 武汉430061;6.湖北中医药大学基础医学院,湖北 武汉 430061;7.湖北中医药大学针灸骨伤学院,湖北 武汉 430061)
0 引言
甲状腺相关性眼病(Thyroid-Associated Ophthalmopathy, TAO),又 称 为 格 雷 夫 斯 眼 病(Graves’Ophthalmopathy, GO)和甲状腺眼病(Thyroid Eye Disease, TED),是 与 格 雷 夫 斯 病(Graves’ disease,GD)密切相关的以眼球后及眼眶周围组织浸润性病变为主要特征的自身免疫性疾病。20%-50%的GD患者常有眼部受累[1],TAO以40-60岁女性多发,男女患病比例约为1:5[2],总发病率约为0.0422‰[3],在成人眼眶疾病中,TAO在国内外的发病率约占20%[4],约5%-8.6%的TAO患者会发展成严重阶段[5],如出现暴露性角膜溃疡和甲状腺功能障碍性视神经病变等[6]。其发生发展与环境因素、遗传因素和免疫因素密切相关[7],主要临床表现包括眼睛充血、畏光、流泪、异物感、疼痛等不适,较重者会出现眼睑闭合不全、复视、眼球运动障碍、失明等症状[8]。其治疗包括基本治疗(戒烟、眼睛局部治疗)、维持甲状腺功能稳定治疗、针对突眼治疗(糖皮质激素、免疫抑制剂、硒剂、利妥昔单抗、妥珠单抗、放射治疗、手术治疗)和中草药治疗等[9]。TAO病机复杂,其特征在于糖胺聚糖的过量沉积、炎性浸润和细胞因子的过度产生,而其中细胞因子的过度产生在眼眶局部炎症过程起着重要作用[10]。白介素17(Interleukin-17, IL-17)是一类重要的细胞因子,该家族分别以IL-17A到IL-17F为命名[11],当机体和组织受到感染或损伤时,迁移于此的淋巴细胞会分泌IL-17,其一方面诱导炎症因子和趋化因子表达,从而募集更多的免疫细胞到达炎症部位加剧炎症反应,另一方面能诱导组织修复因子表达,从而加速机体和组织的恢复。虽然IL-17在机体抗感染及组织修复过程中起到了积极作用,但在很多肿瘤和自身免疫性疾病当中,过高表达的IL-17又可诱导炎症因子的过度表达,从而使这些疾病的病理发展出现了恶化[12-14]。故为了明确TAO与IL-17的关系,设计了本研究,以期通过系统评价的方法得出两者相关性,以便为以后临床使用抗IL-17类药物提供理论依据。
1 资料与方法
1.1 检索策略
由 2名研究者在 VIP、CNKI、WanFang、CBM、PubMed、Cochranelibrary、Embase 和 Web Of Science数据库中独立检索建库至2020.12.12前发表的IL-17与TAO相关关系的研究。检索策略遵循Cochrane协作网工作手册,检索方式采取主题词加自由词的方式。中文检索词包括“Graves眼病、甲状腺相关性眼病、格雷夫斯眼病、甲状腺眼病、甲状腺相关眼病、白细胞介素17、白介素17、白细胞介素-17、白介素-17、对照”等,英文检索词 包 括“Ophthalmopathies, Thyroid-Associated、Thyroid-Associated Ophthalmopathies、Graves Ophthalmopathy、Interleukin-17、Interleukin 17、CTLA-8、IL-17、randomized controlled trial”等。
1.2 纳入及排除标准
(1)纳入标准 ①文献类型:文献研究类型均为病例-对照研究,语种和国籍不限。②试验对象:观察组为符合欧洲GO研究组(EUGOGO)制定标准[15]的临床诊断明确的患者,部分患者按照临床活动度评分(clinical activity score, CAS)[16]将CAS≥3分和CAS<3分的分别评为TAO活动组和TAO非活动组。对照组为健康体检人群,无甲状腺疾病及手术史,甲状腺功能正常且甲状腺相关抗体阴性的人群,同时与观察组比较,两者在年龄、性别比例方面匹配或差异无统计学意义。所有研究对象3个月内均未使用过免疫抑制剂和糖皮质激素,并排除其他自身免疫性疾病、感染、肿瘤、过敏和妊娠或哺乳期女性等。③结局指标:结局评价指标为两组研究对象体液中IL-17的含量,结论均以均数±标准差表示。(2)排除标准 ①重复文献。②动物实验、体外实验、综述、病例报道、护理文献等。③研究类型不符。④观察组和对照组在性别、年龄、样本量方面差异有统计学意义。⑤数据不完整及无法提取数据进行研究的文献。
1.3 文献筛选、资料提取及质量评价
由2名研究者独立完成文献筛选、资料提取及质量评价,并进行交叉核对,如评价不一,交由第三方判定。提取内容包括:作者、发表年份、基线情况、样本量、诊断标准、来源类型、两组IL-17水平和测量单位等。按照纽卡斯尔-渥太华量表 (Newcastle-Ottawa Scale, NOS)对纳入研究进行质量评价,该量表包括3个栏目和8个条目,3个栏目分别包括研究人群选择、组间可比性和暴露因素的测量等,此量表满分9分,评分≥7分为高质量研究[17]。
1.4 统计学方法
采用Revman 5.3软件进行统计分析,为祛除不同测量单位对数据的影响,计量资料使用标准化均数差(standardized mean difference, SMD)进行统计分析,使用95%置信区间(CI)表示效应量,P<0.05表示差异有统计学意义。并进行异质性检验,当I2<50%,异质性较小,选用固定效应模型,当I2>50%,异质性较大,选用随机效应模型。并根据CAS评分进行亚组分析,评价TAO活动度是否是其异质性来源。如异质性较大则进行敏感性分析,挨个剔除较低质量的文献或结果明显不同的文献后再行评价,若结果未发生大的改变则表明结论可靠、Meta分析结果稳定可信。同时采用漏斗图来评估发表偏倚。
2 结果
2.1 文献检索结果
初检出相关文献总量为55篇,中文文献44篇,英文文献11篇,去除重复后获得文献37篇,去除综述、动物实验、个案报道后获得文献34篇,通过阅读标题、摘要及全文后获得文献9篇[18-26],最终将这9篇文献纳入Meta分析。筛选流程见图1。

图1 文献筛选流程图
2.2 文献的基本特征和质量评价
本研究共纳入9篇文献,共995例研究对象,其中TAO观察组有650例,而健康人对照组有345例。1篇文献[21]IL-17来源于泪液,其余均来源于血清。2篇文献[20,21]IL-17测量单位为ng/L,其余均为pg/mL。具体见表1。

表1 纳入文献的基本特征和质量评价
2.3 Meta分析结果
2.3.1 TAO和IL-17 相关性的Meta分析结果
TAO组和健康组的IL-17水平为计量资料,且测量单位 和数据大小均有差异,故选用SMD值为统计指标及95%CI为效应量。9篇文献[18-26]异质性检验结果显示,各项研究间异质性大(I2=98%),采用随机效应模型进行合并分析。结果显示:SMD=3.78,95% CI为(2.17,5.40)。提示与对照组相比,TAO患者的IL-17水平明显升高,TAO的发生与IL-17有相关性,两组差异具有统计学意义(P<0.00001),见图2。
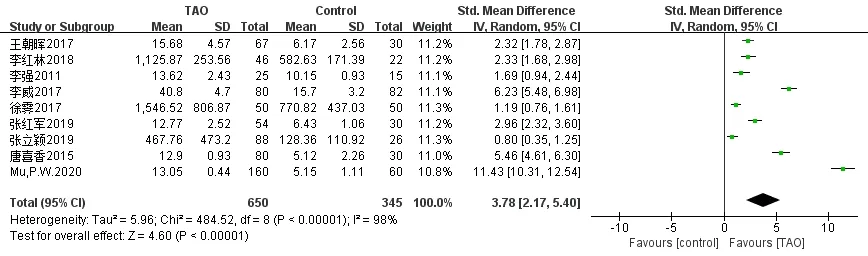
图2 TAO与IL-17关系的森林图
2.3.2 TAO严重程度与IL-17相关性的Meta分析结果
TAO活动期组和TAO非活动期组(按CAS评分≥3分和<3分)的IL-17水平为计量资料,且测量单位和数据大小差异均有统计学意义,故选用SMD值为统计指标及95%CI为效应量。7篇文献[18,19,21,22,24-26]异质性检验结果显示,各项研究间异质性大(I2=98%),采用随机效应模型进行合并分析。结果显示:SMD=3.67,95% CI为(1.87,5.47)。提示TAO严重程度与IL-17有相关性,TAO病情越严重IL-17水平越高,两组差异具有统计学意义(P<0.0001),见图3。
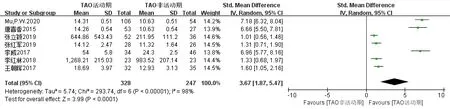
图3 TAO严重程度与IL-17关系的森林图
2.3.3 TAO活动期亚组分析
为评估TAO的疾病活动度是否为各研究间的异质性来源,对各项研究按CAS评分≥3分和<3分划分为TAO活动组和TAO非活动组,并进行亚组分析。结果显示:TAO活动期与健康对照 组 相 比,I2=98%,SMD=5.62,95% CI=(3.07,8.17),P<0.0001。TAO 非活动期与健康对照组相 比,I2=95%,SMD=2.97,95% CI=(1.82,4.12),P<0.00001。汇总结果比较,I2=97%,SMD=4.27,95% CI=(3.03,5.51),P<0.00001。 提 示 与 对照组相比,TAO不同分期患者的IL-17水平均明显升高,TAO患者无论疾病活动与否,其发生均与IL-17有相关性,两组差异具有统计学意义(P<0.00001)。TAO活动组和TAO非活动组间亚组分析差异无统计学意义(χ2=3.46,P=0.06),提示TAO的活动性并非各研究间的异质性来源。见图4。通过以上亚组分析显示,此次研究结论准确,稳定可信。

图4 TAO活动期亚组分析
2.3.4 敏感性分析
⑴选用两种不同模型效应量点估计值与区间估计值的差异:通过随机效应模型与固定效应模型切换可见,当选取两种不同模型时,虽然会改变可信区间,但研究结论并未发生改变。⑵逐个剔除各项文献重新合并效应量分析:使用逐个剔除各项文献的方法重新合并分析,估计合并后的效应量,并和剔除前的合并效应量进行相互比较。无论是剔除SMD值最大的研究、样本量最大的研究、IL-17来源不同的研究还是测量单位不同的研究,均未对总体结果产生明显影响,研究结论并未发生改变。剔除SMD值最大的研究后[18],余研究I2=97%,SMD=2.85,95% CI=(1.64,4.06),P<0.00001。见图5。通过以上敏感性分析显示,此次研究结论准确,稳定可信。

图5 敏感性分析(剔除最大SMD值研究)
2.3.5 发表偏倚
采用Revman 5.3软件来生成文献发表偏倚漏斗图,漏斗图显示不对称分布,提示存在发表偏倚。见图6。

图6 文献发表偏倚漏斗图
3 讨论
TAO是一种病因病机复杂且治疗效果欠佳的自身免疫性疾病。随着目前对其越来越深入的研究,炎症、免疫因素和抗炎、抗免疫治疗越来越受到临床重视。TAO的发病机制尚不十分明确,免疫因素常被认为是TAO发生和进展的核心因素,目前比较公认的是甲状腺组织和眼眶周围组织的共抗原学说,即在遗传和环境等因素的共同作用下,机体发生免疫耐受失衡,激活自身的免疫性淋巴细胞,在细胞免疫与体液免疫的共同参与下,促使甲状腺组织和眼眶周围组织发生免疫交叉反应,进而导致疾病发生发展[27-28]。研究显示,炎症反应在TAO病程中发挥了不可或缺的作用,炎性细胞因子和炎性细胞作为炎症反应链中重要的一环,它的地位日益显现[29-30],同时TAO患者眼眶周围组织的炎症反应也常伴有免疫细胞的浸润与迁移。IL-17最早是被发现由激活的CD4+T细胞分泌,这类特征性分泌IL-17的T细胞亚群被称做Th17细胞[11]。IL-17的产生可通过激活NF-κB、STAT3等信号通路来完成,也可通过TGF-β、IL-6诱导Th17细胞来完成,同时也可通过B细胞的激活来完成[31]。因Th17细胞在人体内分布最广,并且在炎症反应中作用广泛,所以通常认为它是IL-17的主要来源细胞[32]。IL-17信号通路是指IL-17通过诱导靶细胞表达多种趋化因子和炎症因子来发挥其促进炎症反应功能的通路。IL-17可以作用于巨噬细胞,促使TNF、IL-1与IL-6等炎症因子释放,发挥促炎效应。IL-17也可以作用于中性粒细胞,促进其发育成熟,并通过诱导中性粒细胞移动因子(IL-6、MIP-2等)募集中性粒细胞,促使TNF、IL-8与MMP等因子释放,参与炎症反应。IL-17还可以刺激角质形成细胞产生抗菌肽、趋化因子、促炎和增生性细胞因子,促进其在表皮损伤后的增殖。IL-17亦可以活化内皮细胞,通过上调ICAM-1、IL-6和IL-8,促进组织炎症和促凝活性,介导血管活性[25]。同时在IL-17的刺激下,成纤维细胞能产生促炎介质(IL-8、IL-6等),造成基质破坏。另外IL-17能作用于破骨/成骨细胞及软骨细胞,造成骨侵蚀、骨形成和软骨损伤。目前有研究指出许多疾病的发生均与IL-17相关[33-35],也有学者指出甲状腺相关疾病如自身免疫性甲状腺炎[36-37]、GD[38-39]和TAO[40-41]的发生与IL-17亦相关。CD4+T细胞(Th1、Th2、Th17)在 TAO的发生和发展过程中起着重要作用,有研究表明,TAO在活动期时,Th17细胞数量增多,随着TAO缓解,Th17细胞数量逐渐下降[42],同时Th17细胞是本病的致病因素,能增加眼眶的炎症反应[43-44]。
目前,虽然有关于IL-17和TAO相互关系的研究,但各研究间样本量少,测量单位、研究人群、测量方式、结果准确度均存在差异,临床意义欠佳。基于此,本研究采取系统评价的方法,来进一步阐明两者的关系。研究发现,TAO患者的IL-17水平与健康对照组相比明显升高,且TAO患者病情越严重IL-17水平越高,虽然各项研究间的异质性较大,但无论是通过病情严重程度进行亚组分析,还是通过敏感性分析,无论是剔除样本来源不同的研究还是剔除SMD值最大的研究,结果均很稳定。
本研究所纳入文献的NOS评分均较高,但仍有以下局限性,可能会对研究结果产生影响:①病例-对照研究难免会受到选择性偏倚的影响,结果不如前瞻性研究真实可靠。②所纳入文献大部分为小样本研究,研究例数过少。③各研究间测定IL-17的试剂盒不尽相同,导致测量结果和测量单位不同。④未收集到未发表的研究,可能存在文献漏选情况。⑤纳入研究以中英文为主,且存在发表偏倚。并且本研究异质性高,故在后期研究中,需要大样本、设计严谨、高质量的RCT研究来进一步分析,以期得到更完善的结论,为今后临床免疫靶向治疗提供新的理论依据。
综上所述,本次研究对IL-17和TAO的关系进行了Meta分析,发现IL-17水平在TAO患者中明显升高,且与TAO病情严重程度呈正相关,IL-17可能参与了TAO的发病。同时根据各入选研究进行推测,IL-17水平可能对TAO的诊断、疗效判定、病情预后存在一定的指导意义。IL-17参与了TAO的发病,与病情严重程度有关,其可作为诊断TAO的标志物和可能的治疗靶点之一。

