产3-羟脯氨酸重组菌的构建及发酵优化
姚雪娜, 张震宇*, 孙付保, 陈 昶, 黄建华, 沈 松
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;3.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122)
产3-羟脯氨酸重组菌的构建及发酵优化
姚雪娜1,2,3, 张震宇*1,2,3, 孙付保1,2,3, 陈 昶1,2,3, 黄建华1,2,3, 沈 松1,2,3
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;3.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122)
顺式-3-羟基-L-脯氨酸(顺式-3-羟脯氨酸)可用于合成多种抗癌药物,具有重要的商业价值,目前大多通过添加IPTG来诱导表达脯氨酸-3-羟化酶,采用两步法生物合成顺式-3-羟脯氨酸。作者通过目的基因优化设计,引入强启动子色氨酸串联启动子(Ptrp2)来避免异源表达时的诱导剂使用,构建重组质粒pES-Ptrp2-P3H,成功构建了重组大肠杆菌BL21(DE3)/ pET21a-Ptrp2-P3H,优化后的脯氨酸-3-羟化酶基因(P3H)改变了168个碱基,GC含量由原来的64.83%降低到49.31%。该菌在初步优化培养基(葡萄糖1 g/dL,甘油0.125 g/dL,胰蛋白胨1.6 g/dL,(NH4)2SO40.5 g/dL,K2HPO40.1 g/dL,NaCl 0.2 g/dL,FeSO41 mmol/L,MgSO40.5 g/dL,CaCl20.015 g/dL,脯氨酸10 g/L,pH 7.5)上能一步法原位合成顺式-3-羟脯氨酸,摇瓶发酵24 h,产量0.8 g/L,比优化前提高一倍以上,为进一步开展顺-3-羟脯氨酸产业化提供了依据。
脯氨酸-3-羟化酶;顺式-3-羟脯氨酸;密码子优化;重组菌构建;发酵优化
羟基-L-脯氨酸 (Hydroxyproline,Hyp,羟脯氨酸)为亚氨基酸,是L-脯氨酸羟基化后的产物。根据羟脯氨酸的羟基所在位置不同,可形成4种立体异构体,分别是反式-4-羟脯氨酸、顺式-4-羟脯氨酸、反式-3-羟脯氨酸和顺式-3-羟脯氨酸。其中反式-4-羟脯氨酸最为常见,对哺乳动物骨胶原合成至关重要[1],已被广泛应用于动物饲料、营养和美容业等许多行业;其次为反式-3-羟脯氨酸,它在I、II和III型骨胶原中含量较多,能通过脯氨酰-3-羟化酶的催化形成。相对地,顺式羟脯氨酸比较少见,比如稀有的顺式-3-羟脯氨酸[2],现有资料证明它存在于产放线菌素、宜他霉素和远霉素等次级代谢物的微生物中[3]。
而为数不多的资料表明,顺式-3-羟脯氨酸在许多领域均具有重要的应用价值。在医药领域,顺式-3-羟脯氨酸可以直接作为治疗肿瘤和胶原蛋白障碍的药物[4],并且该种氨基酸作为重要的手性合成子能够用于合成许多药物,如选择性雄性受体调节剂BMS-564929[5]、碳氢霉烯类抗生素、血管紧张肽转化酶抑制剂和解痉挛制剂等[6]。此外也可用于合 成 DNA 促 旋 酶 抑 制 剂 , 如 plusbacin、cyclothialidine和tripropeptins等。在化学合成领域,顺式-3-羟脯氨酸已用作重要的手性分子来合成倒千里光裂碱和流涎胺等。在不对称合成领域,它还被直接用作有机催化剂。另外,顺式-3-羟脯氨酸衍生物,如卡泊芬净和Pneumocandin B0,还能作为抗真菌药物使用[1]。但是由于顺式-3-羟脯氨酸在自然界中含量极为稀少,导致其价格相当昂贵(约3 800元/g),严重限制了在各领域的应用,尤其在医药领域,很多以顺式-3-羟脯氨酸为前体合成的抗癌药物才处于临床试验阶段,并不能满足人类的需求。因此各国科研工作者都在研究顺式-3-羟脯氨酸的生产方法。
目前,羟脯氨酸的生产方法主要有3种:水解法、化学合成法以及微生物转化法。由于顺式-3-羟脯氨酸在骨胶原中含量极少,因而无法通过常见的水解法获得。已有报道显示,可通过化学全合成或者差向异构化反应生成[6]。Surajit Sinha等人通过夏普勒斯不对称环氧化反应从丙氨酸出发,经过十多步反应合成顺式-3-羟脯氨酸[2];Navnath B.等人从D-谷氨酸出发,通过一系列化学反应最终合成顺式-3-羟脯氨酸,转化率不足30%[4]。目前,这些化学法存在明显不足:1)合成工序较为繁琐和产率低;2)反应过程中会用到一些有毒试剂;3)分离纯化工艺复杂。因此,经济效益欠佳,难以工业化生产。
随着微生物资源的开发和利用,研究者们逐步发现一些能够合成顺式-3-羟脯氨酸的微生物。1996年 HIDEO MORI等 人 发 现 链 霉 菌(Streptomyces sp.)TH1能够产一种脯氨酸-3-羟化酶,该酶能够将游离的L-脯氨酸羟基化为顺式-3-羟脯氨酸,接着他们发现脯氨酸-3-羟化酶还存在于包括产远霉素的链霉菌和芽孢杆菌等多种微生物体内[8],这也是在微生物中发现脯氨酸-3-羟化酶的首次报道。进一步研究发现,该酶的羟基化活性需要2-酮戊二酸和O2的存在,把它归为2-酮戊二酸依赖性加双氧酶类。并且以发酵3 d的链霉菌TH1为酶源,在含L-脯氨酸、2-酮戊二酸、硫酸亚铁、L-抗坏血酸和100 mmol/L TES buffer(pH 7.5)的反应体系里能够催化产生约174 μmol/L的顺式-3-羟脯氨酸[9]。2009年,Robert M.等通过重组菌的构建,实现了脯氨酸-3-羟化酶在大肠杆菌中的异源表达,20 L发酵罐发酵8 h后,加入IPTG诱导,以收集的菌体为酶源,在10 L的反应体系中60 h能够催化产生约9.1 g/L的顺式-3-羟脯氨酸[5]。2011年,德国研究者Christian klein等人直接向发酵液中添加底物L-脯氨酸,800 mL培养基发酵3 d后能够产生约305 mg的顺式-3-羟脯氨酸[6]。在对脯氨酸-3-羟化酶基因(P3H)克隆后,异源表达时还需加入昂贵且有毒性的诱导剂IPTG,这并不适用于药物蛋白质和食用氨基酸的大规模生产[10]。而且,这些微生物发酵生产顺式-3-羟脯氨酸主要采用分步法,即通过大规模的发酵培养获得能够产脯氨酸-3-羟化酶的菌体,以这样的菌体为酶源,加入到合适的反应体系中,催化L-脯氨酸为顺式-3-羟脯氨酸。这种分步法可能是为了高产顺式-3-羟脯氨酸,但生产工序偏长,投资和运行成本偏高,且染菌风险增加。
作者尝试开展微生物一步法合成顺式-3-羟脯氨酸的研究工作,首先对脯氨酸-3-羟化酶基因进行设计优化,然后通过引入强启动子色氨酸串联启动子(Ptrp2)来避免异源表达时诱导剂使用,接着构建重组大肠杆菌,最后探讨利用该菌株在发酵液中原位催化游离脯氨酸来一步法合成顺式-3-羟脯氨酸的可行性。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒 菌株 E.coli BL21(DE3)、E.coli JM109:作者所在实验室保存;克隆载体PES:购于上海旭冠公司;表达载体pUC19、pET28a和pET21a:作者所在实验室保存。
1.1.2 酶和试剂 限制性内切酶EcoRI、HindⅢ和BamHI:宝生生物工程有限公司;T4 DNA连接酶、1 kb DNA Marker、Premixed Protein Marker、DNA胶回收试剂盒和质粒小量抽提试剂盒:上海生物工程有限公司。
1.1.3 培养基 种子培养基LB:胰蛋白胨1 g/dL,酵母膏0.5 g/dL,NaCl 1 g/dL,pH 7.0。初始发酵培养基:葡萄糖1 g/dL,甘油0.5 g/dL,胰蛋白胨1 g/dL,(NH4)2SO40.5 g/dL,K2HPO40.1 g/dL,NaCl 0.2 g/dL,FeSO43 mmol/L,MgSO40.02 g/dL,CaCl20.015 g/dL,脯氨酸46 g/L,pH 7.0。
1.2 实验方法
1.2.1 脯氨酸-3-羟化酶基因的优化 脯氨酸-3-羟化酶基因密码子使用频率分析由数据库(http:// www.kazusa.or.jp/codon)完成。通过同义替换的方法消除一些在大肠杆菌中使用频率低的密码子,调整脯氨酸-3-羟化酶基因的GC含量,使其接近大肠杆菌的GC含量。利用密码子优化软件Java Codon Adaptation Tool(JCAT)来对基因进行评估。为便于基因操作,分别在脯氨酸-3-羟化酶基因的5’端设计了EcoRI、HindⅢ,3’端设计了BamHI酶切位点。同时利用RNAstructure软件对其mRNA的二级结构进行优化,保证起始密码子ATG及其后的数个碱基组成的密码子呈开环状态,降低核糖体结合到mRNA上的能势,使得核糖体能够顺利地沿着起始密码子向后翻译。优化后的基因序列提交给上海旭冠公司合成。
1.2.2 重组质粒的构建 合成的基因连接到质粒pES上 (pES-P3H),含色氨酸串联启动子的质粒pUC19-Ptrp2-Hyp(作者所在实验室构建)经EcoRI和HindⅢ酶切后,回收Ptrp2片段,与经过同样双酶切的质粒pES-P3H连接,构建重组质粒pESPtrp2-P3H。构建过程见图1。
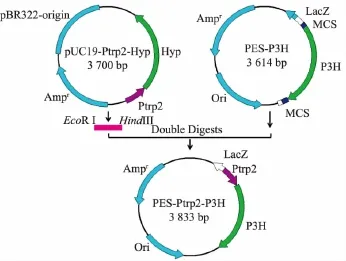
图1 pES-Ptrp2-P3H重组质粒的构建Fig.1 Construction of the expression vector pES-Ptrp2-P3H
重组质粒pES-Ptrp2-P3H经EcoRI和BamHI双酶切后,回收Ptrp2-P3H片段,将该片段分别连接到pUC19、pET21a和pET28a质粒上,构建不同的重组质粒pUC19-Ptrp2-P3H、pET21a-Ptrp2-P3H和pET28a-Ptrp2-P3H。对重组质粒酶切验证正确后转化至E.coli BL21(DE3)、E.coli JM109。
1.2.3 重组大肠杆菌的培养 重组大肠杆菌培养在含有相应抗生素的平板上,37℃培养约10 h后长出单菌落,挑取单菌落,接种到含有相应抗生素的30 mL(250 mL摇瓶)种子培养基LB中,220 r/min、37℃培养8 h,再按4%的接种体积分数接种到30 mL(250 mL摇瓶)的初始发酵培养基中,于220 r/min、30℃培养12 h,测定发酵液中顺式-3-羟脯氨酸的质量浓度。
1.2.4 蛋白质表达分析 取1 mL发酵液,8 000 g离心2 min,去上清液,用100 μL的去离子水重悬细胞。取上述细胞悬浮液10 μL,加入5×上样缓冲液,混匀后,于沸水中煮约10 min,使细胞充分破碎,破碎的细胞在12 000 r/min离心2 min,取10 μL样品进行SDS-PAGE分析。
1.2.5 全细胞酶活测定 取发酵液离心2 min(4℃、8 000 g),取10 g/dL细胞悬浮于5 mL、50 mmol/ L磷酸盐缓冲液(pH 7.9)中,细胞悬浮液加入到50 mL的酶反应液 (5 mmol/L L-抗坏血酸,1 mmol/L FeSO4·7H2O,90 mmol/L 2-酮戊二酸,90 mmol/L L-脯氨酸)中,30℃培养30 min后,转移到100℃水浴中加热2 min终止酶反应,测定顺式-3-羟脯氨酸的质量浓度。
一个酶活单位 (U)定义为每分钟催化得到1 nmol顺式-3-羟脯氨酸的酶量。全细胞酶活是每毫克干菌体的酶活,单位为U/g,其中细胞干重DCW(g/L)=0.54×OD600。
1.2.6 发酵优化单因素实验 按照1.2.3培养方法,对培养基的成分进行优化。优化的培养基的成分包括:底物L-脯氨酸添加质量浓度(1、5、10、20、40 g/L),不同有机氮源(酵母提取物、胰蛋白胨和玉米浆,质量浓度分别为4、8、12、16、20 g/L),碳源(葡萄糖质量浓度为10、15、20、25、30 g/L;甘油浓度为1、1.25、2.5、5 g/L),亚铁离子质量浓度(0、1、5、10 mmol/L)以及镁离子质量浓度(0.1、0.5、1、2 g/dL)。不同因素间进行单独研究,不考虑不同成分之间的交互影响。
1.2.7 顺式-3-羟脯氨酸浓度测定 通过2,4-二硝基氟苯(DNFB)柱前衍生法[11]测定顺式-3-羟脯氨酸的质量浓度。发酵液离心后取上清液作为样品。标准品或样品用衍生缓冲液溶解,取待测样品2 mL于10 mL棕色容量瓶中,加入1 mL衍生试剂,60℃避光水浴1 h,冷却至室温后用平衡缓冲液定容至10 mL。用0.45 μm的水系滤膜过滤。
HPLC系统包括:日立HPLC系统(输液泵、紫外检测器,柱温箱,进样器,数字记录及处理装置),安捷伦ZORBA SB-Aq(150 mm×4.6 mm,5 μm),操作时柱温控制在27℃。流动相A:乙酸钠缓冲液(pH 6.5~6.8),流动相B:50%的乙腈水溶液。洗脱过程采用梯度洗脱:0~6 min,16%的 B相;6~7 min,40%的B相;7~15 min,100%的B相;15~16 min,40%的B相,16~25 min,16%的B相。
2 结果与分析
2.1 脯氨酸-3-羟化酶基因的优化设计和合成
在大肠杆菌中进行异源蛋白表达时,同义密码子的使用频率与基因的异源表达水平相关[15]。因此,首先通过基因优化策略,将稀有密码子替换为大肠杆菌常用密码子,控制GC含量及脯氨酸-3-羟化酶基因mRNA二级结构,设计合成了一个适合在大肠杆菌中表达的脯氨酸-3-羟化酶基因,进而确保脯氨酸-3-羟化酶的表达效率。脯氨酸-3-羟化酶基因序列的原始序列见GenBank:AF003371.1,脯氨酸-3-羟化酶基因全长873 bp,编码290个氨基酸。在优化脯氨酸-3-羟化酶基因前,通过Codon Usage Database数据库对其进行密码子使用频率分析,并比较其与大肠杆菌密码子的使用频率。结果显示,来源于链霉菌TH1的脯氨酸-3-羟化酶基因部分密码子使用频率在大肠杆菌中都有不同程度的降低,如起始密码子后的CGC,在链霉菌TH1中的使用频率为34.4%,在大肠杆菌中的使用频率为18.8%;TCG在链霉菌TH1中的使用频率为13.7%,在大肠杆菌中的为 11.4%;CAC在链霉菌 TH1中为41.2%,在大肠杆菌中为7.2%。并且从5′端开始就出现了密码子使用频率差异较大的情况,不利于脯氨酸-3-羟化酶基因序列的翻译表达。数据库的分析结果还显示,脯氨酸-3-羟化酶基因的GC含量为64.83%,高于大肠杆菌的GC含量(50.80%)。
基因优化结果见表1。首先,通过同义替换的方法改变了稀有密码子,脯氨酸-3-羟化酶基因的GC含量从64.83%降低到51.78%,更接近大肠杆菌的GC含量。在蛋白质的表达过程中,基因序列5′末端的二级结构会对蛋白质的翻译产生影响[12],同时RNA 5′末端形成二级结构所需要的能量也影响基因产物的产量。因此利用RNA二级结构预测软件RNAstructure 5.3对其二级结构进行预测,发现脯氨酸-3-羟化酶基因的mRNA5′末端会形成茎环结构,不利于翻译的进行。通过同义替换改变27个密码子,使得脯氨酸-3-羟化酶基因的mRNA5′末端呈打开状态,见图2。自由能ΔG由开始的-243.5 kcal/ mol降低到-230.5 kcal/mol,促进核糖体结合到mRNA上,并且顺利地进行翻译。经过优化,共改变了187个脯氨酸-3-羟化酶的碱基,172个密码子发生了变化,GC含量从64.83%降低到49.31%,更接近于大肠杆菌的GC含量。图3为链霉菌TH1的脯氨酸-3-羟化酶基因序列与优化后的脯氨酸-3-羟化酶基因序列的对比结果。

表1 脯氨酸-3-羟化酶基因优化结果Table 1 Codon optimization process
2.2 重组大肠杆菌的构建
2.2.1 组成型色氨酸串联启动子的引入 目前,顺式-3-羟脯氨酸微生物合成过程用到的启动子为IPTG诱导型启动子,这不利于顺式-3-羟脯氨酸作为前体用于合成药物蛋白产品。因此,作者尝试采用引入了一个强的启动子 (色氨酸串联启动子)来提高mRNA产量,该策略避免使用有毒诱导剂IPTG同时,也有助于降低生产成本。作者所在实验室设计合成的色氨酸串联启动子Ptrp2全长237 bp,5′端为EcoRI酶切位点,3′端为HindⅢ酶切位点。将色氨酸串联启动子Ptrp2插入到目的基因的上游后,转化至E.coli JM109中,提取重组质粒pES-Ptrp2-P3H。Ptrp2重组质粒pES-Ptrp2-P3H经EcoRI和BamHI双酶切后,得到1 117 bp和2 716 bp两个片段,电泳结果见图4。
经DNA测序后,序列结果正确。

图2 脯氨酸-3-羟化酶基因mRNA 5’末端二级结构预测结果Fig.2 Potential mRNA secondary structures around the ATG start codon of the unadjusted gene and the adjusted gene

图3 脯氨酸-3-羟化酶基因优化前(上)与优化后(下)的序列比对Fig.3 Alignment of nucleotide sequences between wild-type gene(upper)and the synthetic optimized(lower)

图4 pES-Ptrp2-P3H双酶切电泳结果Fig.4 EcoRI-BamHI Double digestion of pES-Ptrp2-P3H
2.2.2 重组大肠杆菌的构建 外源基因在原核生物中高效表达除了要有合适的启动子外,合适的质粒也是影响蛋白质表达的一个重要因素。为了得到高产顺式-3-羟脯氨酸重组大肠杆菌,将连有色氨酸串联启动子的脯氨酸-3-羟化酶基因片段分别连接到质粒pUC19、pET21a、pET28a上,构建不同的重组质粒pUC19-Ptrp2-P3H、pET21a-Ptrp2-P3H、pET28a-Ptrp2-P3H,然后将重组质粒转化至E.coli BL21中,构建不同的重组大肠杆菌。重组大肠杆菌经过一段时间的发酵后,取上清液进行SDS-PAGE分析,结果见图5。在约33 500的位置出现了目的条带,表明在重组大肠杆菌中该酶得到了表达。
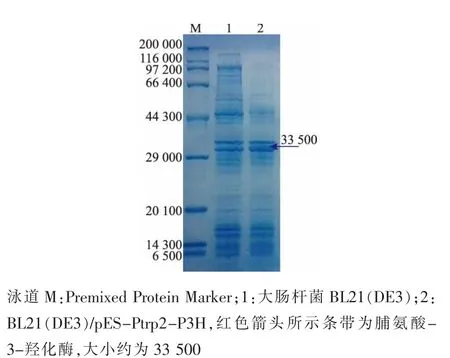
图5 SDS-PAGE结果Fig.5 SDS-PAGE
2.2.3 质粒载体的优化 宿主菌细胞类型对质粒稳定性有一定影响,质粒的稳定性又直接影响目的蛋白质的表达。因此合适的质粒是实现目的蛋白质高效表达的一个重要因素。构建4种不同的重组大肠杆菌,通过比较它们酶活高低,寻找到合适的宿主菌与质粒的搭配。取发酵后的菌体,离心后收集菌体,在酶反应缓冲液中30℃反应30 min,测定4种不同重组大肠杆菌的酶活,结果见表2。从表2可以看出,重组大肠杆菌BL21/pET21a-Ptrp2-P3H的酶活最高,达到了722.807 U/g,与H Mori[8]等人的研究结果相比,酶活提高了约7倍。

表2 不同重组菌脯氨酸-3-羟化酶全细胞活性Table 2 Whole cell enzyme activity of different recombinant strains
2.3 重组菌一步法生产顺式-3-羟脯氨酸的摇瓶发酵
2.3.1 重组大肠杆菌生长曲线的测定 种子培养是为了获得足够多生长代谢旺盛的活菌体。在本研究中,以酶活最高的重组大肠杆菌BL21(DE3)/ pET21a-Ptrp2-P3H为出发菌株,挑取一环单菌落接种于LB中,按1.2.3所述方法进行种子培养。横坐标为种子的培养时间,纵坐标为种子液OD600,生长曲线见图6。

图6 重组大肠杆菌BL21(DE3)/pET21a-Ptrp2-P3H生长曲线Fig.6 Growth curve of recombinant E.coli BL21(DE3)/ pET21a-Ptrp2-P3H
从图6可以看出,菌种接入种子培养基LB中4 h前后,开始进入对数期,6~10 h为种子的对数期。一般在对数生长期内菌体细胞的代谢活性、酶活性高而稳定,因而对数生长期中后期的菌种为最佳。此后的发酵摇瓶试验,均选择种龄为8 h的菌种接入发酵培养基。
2.3.2 摇瓶发酵单因素优化 细菌的生长需要碳源、氮源、无机盐等营养物质。葡萄糖为菌体细胞的快速碳源,它的过量会形成TCA流溢现象,导致乙酸的过量累积[13],抑制大肠杆菌的生长。同时碳源和氮源的比例[14]也会影响细胞生长和蛋白质表达,最终影响顺式-3-羟脯氨酸的产量。此外,各种离子的浓度对菌体生长、酶的表达都有不同的影响,顺式-3-羟脯氨酸的产量还会随着培养条件的变化而变化。因此,必须重视培养基各组分的含量。图7为各单因素优化结果。
其中图7(a)为对底物L-脯氨酸优化结果,结果显示,当底物在1~10 g/L的范围内时,顺式-3-羟脯氨酸的产量随着底物质量浓度的升高而升高,但当继续增加底物时,顺式-3-羟脯氨酸增幅明显减小,因此底物适宜的添加量为10 g/L。
图7(b)为氮源的种类和质量浓度的优化结果。结果显示,以胰蛋白胨为有机氮源时,顺式-3-羟脯氨酸产量高于其他两组有机氮源,其中16 g/L胰蛋白胨为最优,继续增加胰蛋白胨质量浓度,顺式-3-羟脯氨酸质量浓度反而下降。
图7(c)为葡萄糖质量浓度的优化结果。当葡萄糖质量浓度低于15 g/L时,顺式-3-羟脯氨酸的产量随着葡萄糖质量浓度的增加而增加;当葡萄糖质量浓度大于15 g/L时,顺式-3-羟脯氨酸的积累量开始下降。与葡萄糖相比,甘油的运输速度更低,使葡萄糖降解过程中碳通量降低,乙酸生成量大幅度降低。因此通过加入迟效氮碳源能够达到既保证重组菌的生长速度,又高效控制目的蛋白质的表达。以10 g/L的葡萄糖质量浓度为速效碳源,对甘油质量浓度进行优化,结果见图7(d)。可以看出,当甘油添加量为1.25 g/L时,顺式-3-羟脯氨酸的累积量最大。

图7 单因素优化结果Fig.7 Optimization of the concentration of L-proline,nitrogen sources,carbon source,glycerinum,ferrous ion and magnesium ion
由于脯氨酸-3-羟化酶要发挥羟基化活性需要一种重要的离子作为酶的辅助因子,即亚铁离子,因此对亚铁离子的浓度进行优化,结果见图7(e)。当发酵液中不添加亚铁离子时,顺式-3-羟脯氨酸的累积量能达到约250 mg/L左右,可能是由于胰蛋白胨中含有一定浓度的Fe2+。随着Fe2+浓度的升高,顺式-3-羟脯氨酸的累积量不断升高,当Fe2+浓度为1 mmol/L时,顺式-3-羟脯氨酸的质量浓度最高,继续增加Fe2+浓度,顺式-3-羟脯氨酸累积量逐渐减小。
重组大肠杆菌的发酵曲线表明,顺式-3-羟脯氨酸的产量与菌体的浓度偶联,适当浓度的镁离子能明显促进菌体的生长。因此,在重组大肠杆菌发酵过程中,补充适当浓度的镁离子对顺式-3-羟脯氨酸的累积非常重要。镁离子的浓度优化结果见图7(f)。镁离子质量浓度在0.01~0.05 g/dL间,顺式-3-羟脯氨酸的质量浓度随镁离子质量浓度的增加而增加,当镁离子质量浓度大于0.5 g/dL时,产酸随着镁离子质量浓度的增加而减小。
优化的培养基为:葡萄糖1 g/dL,甘油0.125 g/dL,胰蛋白胨 1.6 g/dL,(NH4)2SO40.5 g/dL,K2HPO40.1 g/dL,NaCl 0.2 g/dL,FeSO41 mmol/L,MgSO40.5 g/dL,CaCl20.015 g/dL,脯氨酸10 g/L。
2.3.3 重组大肠杆菌发酵生产顺式-3-羟脯氨酸按上述培养基对重组大肠进行摇瓶发酵,以时间为横坐标,产酸和OD600为纵坐标绘制曲线,见图8。可以看出,发酵24 h顺式-3-羟脯氨酸能够累积约0.80 g/L,产量提高了约2倍。

图8 重组大肠杆菌发酵曲线Fig.8 Fermentation process curve of recombinant E.coli
3 结语
为了生产适用于药物蛋白合成的顺式-3-羟脯氨酸,作者通过引入色氨酸串联启动子成功构建了一株高产顺式-3-羟脯氨酸的重组大肠杆菌。该菌在初步优化培养基(葡萄糖1 g/dL,甘油0.125 g/dL,胰蛋白胨1.6 g/dL,(NH4)2SO40.5 g/dL,K2HPO40.1 g/dL,NaCl 0.2 g/dL,FeSO41 mmol/L,MgSO40.5 g/dL,CaCl20.015 g/dL,脯氨酸 10 g/L,pH 7.5)上能一步法原位合成顺式-3-羟脯氨酸,摇瓶发酵24 h顺式-3-羟脯氨酸0.80 g/L,比优化前发酵产量提高一倍以上,实现了“一锅法”直接生产顺式-3-羟脯氨酸,具有较好的工业化生产前景。
[1]BACH T M H,TAKAGI H.Properties,metabolisms,and applications of L-proline analogues[J].Appl Microbiol Biotechnol,2013,97:6623-6634.
[2]WENG Lushui,CHEN Fen,XIAO Guoying.Optimization and functionalverification ofCry2Aa gene[J].Journal of Agricultural Biotechnology,2013,21(11):1261-1269.(in Chinese)
[3]SHIBASAKI T,MORI H,OZAKI A.Cloning of an isozyme of proline 3-hydroxylase and its purification from recombinant Escherichia coli[J].Biotechnology Letters,2000,22:1967-1973.
[4]KALAMKAR N B,KASTURE V M,DHAVALE D D.Total synthesis of natural cis-3-hydroxy-L-proline from D-glucose[J]. Tetrahedron Letters,2010,51:6745-6747.
[5]JOHNSTON R M,CHU L N,LIU M,et al.Hydroxylation of L-proline to cis-3-hydroxy-L-proline by recombinant Escherichia coli expressing a synthetic L-proline-3-hydroxylase gene[J].Enzyme and Microbial Technology,2009,45:484-490.
[6]KLEINlein C,HUTTEL W.A simple procedure for selective hydroxylation of L-proline and L-pipecolic acid with recombinantly expressed proline hydroxylases[J].Advanced Synthesis&Catalysis,2011,353:1375-1383.
[7]GORRES K L,RAINES R T.Prolyl 4-hydroxylase[J].Critical Reviews in Biochemistry and Molecular Biology,2010,45(2):106-124.
[8]MORIori H,SHIBASAKI Y,OCHIAI K,et al.Detection of novel proline 3-hydroxylase activities in streptomyces and Bacillus spp.by regio-and stereospecific hydroxylation of L-proline [J].Applied and Environmental Microbiology,1996,62:1903-1907.
[9]MORI H,SHIBASAKI Y,YANO K.Purification and cloning of a proline 3-hydroxylase,a novel enzyme which hydroxylates free L-proline to cis-3-hydroxy-L-proline[J].Journal of Bacterilogy,1997,179:5677-5683.
[10]MIROUX B,WALKER J E.Over-production of proteins in Escherichia coli:mutant hosts that allow synthesis of some membrane proteins and globular proteins at high levels[J].Journal of Molecular Biology,1996,260(3):289-298.
[11]LI Dong,SUN Jiayi.Determination of 18 kinds of amino acids by HPLC with precolumn 2,4-dinitrofluorobenzene derivatization [J].Chemical Analysis and Meterage,2004,13(1):289-298.(in Chinese)
[12]ZHENG Zhongcheng.RNA secondary structure prediction algorithms[J].Chemical of Life,2000,20(4):176-178.(in Chinese)
[13]HAN K,LIM H C,HONG J.Acetic acid formation in Escherichia coli fermentation[J].Biotechnology and Bioengineering,1992,39(6):663-671.
[14]CHEN G,STREVETT K A.Impact of carbon and nitrogen condition on E.coli surface thermodynamics[J].Colloids and Surfaces B:Biointerfaces,2003,28(2-3):135-146.
Construction of Recombinant Escherichia coli Strains Producing cis-3-Hydroxyproline and Preliminary Optimization of the Fermentation Conditions
YAO Xuena1,2,3, ZHANG Zhenyu*1,2,3, SUN Fubao1,2,3, CHEN Chang1,2,3, HUANG Jianhua1,2,3, SHEN Song1,2,3
(1.SchoolofBiotechnology,Jiangnan University,Wuxi214122,China;2.Key Laboratory ofIndustrial Biotechnology,Jiangnan University,Wuxi 214122,China;3.Key Laboratory of Carbohydrate Chemistry and Biotechnology,Ministry of Education,Wuxi 214122,China)
The cis-3-hydroxy-L-proline can be used to synthesize many anticancer drugs with important commercial value.At present,cis-3-hydroxyproline is produced with IPTG-inducible recombinants in two steps.The subject of this study is to construct a recombinant with high proline-3-hydroxylase activity and generate cis-3-hydroxyproline without adding IPTG which is expensive and toxic.We constructed the recombinant plasmid pES-Ptrp2-P3H and transformed E.coli BL21 (DE3)successfully.Compared with the original gene sequence of proline 3-hydroxylase,168 nucleotides were changed and the GC percentage was reduced from 64.83%to 49.31%.The preliminarily optimized medium was 1 g/dL glucose,0.125 g/dL glycerinum,1.6 g/dLtryptone,0.5 g/dL(NH4)2SO4,0.1 g/dL K2HPO4,0.2 g/dL NaCl,1 mmol/L FeSO4,0.5 g/dL MgSO4,0.015 g/dL CaCl2,10 g/L L-proline,and pH valve at 7.5.At shaking flask level,cis-3-hydroxyproline was accumulated to about 0.8 g/L in 24 h,which was one times higher than before.It provides the basis for the industrialization of cis-3-hydroxyproline bioproduction.
proline-3-hydroxylase,cis-3-hydroxyproline,codon optimization,construction of recombinant Escherichia coli,fermentation optimize
Q 815
A
1673—1689(2017)03—0243—09
2015-02-15
国家自然科学基金项目(30800018;30970058);江苏省自然科学基金项目(BK2012554);高等学校博士学科点专项科研基金项目(200802951036);工业生物技术教育部重点实验室主任基金项目(KLIB-ZR200801)。
*通信作者:张震宇(1976—),男,江苏张家港人,理学博士,教授,硕士研究生导师,主要从事微生物产品的制备技术和发酵工艺方面的研究。E-mail:zhangzy@jiangnan.edu.cn
姚雪娜,张震宇,孙付保,等.产3-羟脯氨酸重组菌的构建及发酵优化[J].食品与生物技术学报,2017,36(03):243-251.

