副溶血弧菌TDH的原核表达及单克隆抗体的制备
黎晶晶, 黎珊珊, 于艳丽
(1.浙江医药高等专科学校 生物与制药学院,浙江 宁波 315000;2.天津市河北区疾病防疫控制中心,天津300100;3.浙江大学明州医院,浙江 宁波315000)
副溶血弧菌TDH的原核表达及单克隆抗体的制备
黎晶晶1, 黎珊珊2, 于艳丽3
(1.浙江医药高等专科学校 生物与制药学院,浙江 宁波 315000;2.天津市河北区疾病防疫控制中心,天津300100;3.浙江大学明州医院,浙江 宁波315000)
为实现副溶血性弧菌tdh基因的原核表达,采用TCBS选择培养基从贝类中筛选副溶血性弧菌疑似菌株;根据GenBank上已有的tdh基因序列,设计并人工合成引物,通过PCR技术鉴定副溶血性弧菌并扩增tdh基因;酶切后定向插入到pET-28a表达载体中,构建重组表达质粒pET-28a-tdh,转入E.coli Rosetta中,在IPTG诱导下进行TDH蛋白表达。为制备耐热直接溶血毒素TDH单克隆抗体,用纯化的蛋白作为免疫原免疫BALB/c小鼠,成功用原核载体表达的TDH蛋白为免疫原,制得一株能稳定分泌单克隆抗体的杂交瘤细胞,命名为T9N10。获取腹水并经Ni-NTA Resin亲和柱纯化,其稳定分泌的单克隆抗体经鉴定为IgG1,相对分子质量约为146 000,并表现出较强的特异性。本研究为开发副溶血弧菌免疫学快速检测和深入的研究奠定良好的物质基础。
副溶血性弧菌;耐热直接溶血毒素;原核表达;单克隆抗体;制备
近年来,由感染引起的食物中毒已经成为了严重的食源性公共卫生问题。副溶血性弧菌(Vibrio Parahaemolyticus,VP)是一种嗜盐性细菌,主要存在于近海岸的鱼类、贝类等海产品中,人食用污染有该致病菌的海产品后可引起胃肠炎,严重时还会引起败血症[1]。沿海地区检测出多起由VP引起的食物中毒事件[2-5]。浙江沿海地区海水养殖的大量鱼、虾、贝类,副溶血性弧菌也是主要病原,每年由此菌引起的弧菌病给养殖业也造成严重的损失[6-7]。
溶血毒素是副溶血性弧菌致病的主要原因。研究表明,副溶血弧菌的溶血毒素主要有耐热直接溶血毒素(TDH)、相对耐热直接溶血毒素(TRH)和不耐热溶血毒素(TLH)。研究者发现,TDH几乎全部由临床分泌株分泌,只有5%的环境分离株能产生TDH[8]。已发现宁波地区引起感染性腹泻的副溶血性弧菌,tdh基因携带率达到98.59%[9],TDH可以作为副溶血性弧菌毒性的标志。目前,国内外针对TDH检测副溶血性弧菌的研究,大多采用PCR技术[10-11],利用免疫学法的研究较少。因此,建立一种副溶血性弧菌TDH快速、灵敏的免疫学检测技术,对环境监测与食品安全检测具有重要的意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和细胞株 副溶血性弧菌VP1-3:分离自宁波地区菜市场购买海产品;大肠杆菌(Escherichia coli)、枯草杆菌(Bacillus subtilis)、金黄葡萄球菌(Staphylococcus aureus):作者所在实验室保存;副溶血性弧菌ATCC 33846、非致病性副溶血性弧菌:浙江大学明州医院馈赠;E.Coli DH5α、E. Coli Rosetta、pET-28a质粒和小鼠骨髓瘤SP/20细胞:中国药科大学微生物与生化药学实验室馈赠。
1.1.2 培养基、试剂 DNA提取试剂盒(140711):北京博凌科为生物科技有限公司;TCBS琼脂:北京陆桥生物有限公司;HRP标记二抗、OPD、HAT、HT选择培养基、抗体类型试剂盒、IPTG、无血清DMEM等:南京建成生物工程研究所。BamHI和EcoRI限制性内切酶、DNA Marker DL2000、DL15000、蛋白质相对分子质量Marker、T4 DNA连接酶、SDS、PAGE、Ni-NTA Resin亲和柱等:宝生物工程(大连)有限公司。
1.1.3 试验动物 8周BALB/c清洁级雌性小鼠:上海莱克斯实验动物有限公司。
1.2 方法
1.2.1 副溶血性弧菌的分离和培养 参照国家标准GM/T4789.7-2008《食品卫生微生物学检验副溶血弧菌检验》方法处理贝类[12]。从平板上挑取有特征的单克隆菌落再接种于TCBS琼脂平板上,37℃培养24 h。挑取19株疑似菌落接种于5 mL牛肉浸膏培养基中,37℃、180 r/min培养12 h后,做下一步鉴定。
1.2.2 PCR检测
1)细菌总DNA提取:按照DNA提取试剂盒说明书操作。
2)PCR检测:从GenBank上获得副溶血弧菌tdh基因的 DNA序列 (GenBank accession no. M10069),应用Premier 5.0软件设计了一对引物如下:
R1:5’-GCGGATCCATGAAACACCAATATTTT GC-3’(含BamHI酶切位点)
R2:5’-CGGAATTCTTATTTTTATTGTTGATGT-3’(含EcoRI酶切位点)
以21株疑似细菌基因组DNA为模板,通过PCR扩增tdh基因片段。反应程序:95℃预变性5 min,94℃变性 30 s,55℃退火 45 s,72℃延伸 1 min,重复35个循环,72℃保持10 min。产物用1 g/dL琼脂糖凝胶电泳进行检测,DNA回收试剂盒回收目的片段。
1.2.3 TDH蛋白在大肠杆菌中的诱导表达
1)tdh基因原核表达载体的构建及鉴定:将载体pET-28a分用限制性内切酶(BamHI和EcoRI)进行酶切,用T4-DNA连接酶与目的片段在16℃连接,构建表达载体pET-28a-tdh,将连接产物转化至大肠杆菌DH5α感受态细胞中,用LB琼脂平板(含kanamycin 100 μg/mL)筛选。筛选阳性克隆,提取质粒DNA,用BamHI和EcoRI双酶切后送上海生工生物工程有限公司测序鉴定。
2)pET-28a-tdh在大肠杆菌Rosetta中的诱导表达:将构建的重组表达质粒pET-28a-tdh转入大肠杆菌Rosetta中,挑取阳性克隆接种于LB液体培养基(含kanamycin 100 μg/mL)中,37℃、180 r/min摇床培养至OD600nm为0.4~0.6后,加入IPTG(终浓度为0.5 mmol/L)进行诱导表达,3~6 h后收集菌体,按文献[13]表达蛋白质的SDS-PAGE电泳操作进行分析。
1.2.4 重组TDH的纯化 按1.2.3方法,加入IPTG诱导,至OD600nm值最大时收集菌体沉淀,沉淀加入含尿素的缓冲液,超声20 min,于4℃、12 000 r/min离心20 min,收集上清液,经0.45 μm微孔滤膜过滤,滤液按照ProteinPure-Ni-NTA Resin亲和柱的操作手册,蛋白质纯化后进行SDS-PAGE电泳分析。
1.2.5 免疫动物 免疫8周龄BALB/c小鼠,取纯化的TDH 10 μg与弗氏完全佐剂充分混合后,通过腹腔注射进行首次免疫,隔周用5 μg TDH加强免疫,3次后取小鼠尾静脉血用间接ELISA法作抗体效价测试,呈明显阳性的小鼠5 μg TDH加强免疫,3 d后取脾细胞作细胞融合。
1.2.6 细胞融合 融合前1周复苏冻存的小鼠骨髓瘤SP2/0细胞。取小鼠脾细胞,置于无菌筛网上,充分研磨脾脏,收集脾细胞。取SP/20细胞与脾细胞(1∶5),用无血清的DMED培养液清洗,1 000 r/min离心5 min后,弃上清液。沉淀中加入1 mL PEG1500溶液,充分混匀;静置10 min后加入25 mL无血清DMED培养液以终止PEG作用;1 000 r/min离心5 min,弃上清液;沉淀用含15%胎牛血清的HAT选择培养液混匀,转移至96孔板中,每孔加样100 μL,置37℃细胞培养箱中培养。
1.2.7 杂交瘤细胞的筛选与克隆 按文献[14]方法筛选阳性杂交瘤细胞。保存对目标抗原具有特异性的阳性杂交瘤细胞株。
1.2.8 腹水的制备与纯化 选取8周大小的BALB/c小鼠,每只腹腔注射300 μL液体石蜡,5 d后腹腔注射阳性杂交瘤细胞,每只小鼠注射1×106个细胞,8~10 d后收集腹水。抗体的纯化采用辛酸硫酸铵沉淀法[15-16],用SDS-PAGE分析获得抗体的纯度。
1.2.9 间接ELISA检测单克隆抗体特异性 将大肠杆菌、金黄葡萄球菌、沙门杆菌和非致病性副溶血性弧菌进行液体增菌培养,37℃、24 h后分别吸取菌液上清液100 μL包被96孔板,用PBS作空白对照;以待检测杂交瘤细胞上清液为一抗进行单克隆抗体特异性鉴定。
2 结果与分析
2.1 副溶血性弧菌的分离与培养
副溶血性弧菌疑似株在TCBS选择培养基上培养24 h后,菌落呈蓝绿色、边缘整齐、湿润有黏性、半透明的菌落,直径约2~4 mm,共分离出19株疑似菌株。
2.2 副溶血弧菌的PCR鉴定
分别以19株疑似菌株DNA为模板,以R1、R2为引物进行PCR扩增,电泳结果见图1。共有3个样品在570 bp附近有条带,与tdh基因大小相符,命名为VP1-3,检出率为15.79%。

图1 19株疑似菌株tdh基因PCR扩增结果Fig.1 PCR amplification products of tdh gene from 19 suspected strains
2.3 TDH蛋白在大肠杆菌中的诱导表达和纯化
将胶回收的PCR产物及表达载体pET-28a经BamHI和EcoRI双酶切,连接、转化至大肠杆菌5Hα感受态细胞。提取质粒,质粒再经双酶切后经鉴定出现两条带,一条约5 300 bp,另一条约为570 bp,结果见图2。测序结果表明,该质粒中含有目的基因片段,且读码框正确,获得重组表达质粒pET-28a-tdh。
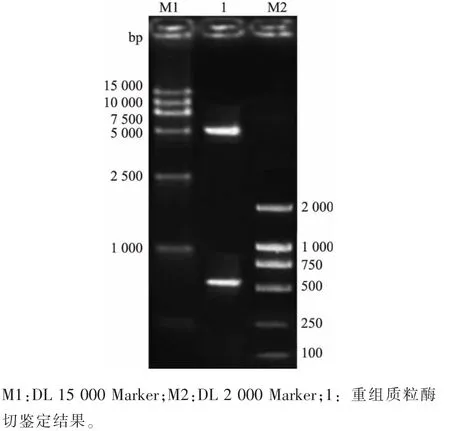
图2 重组质粒pET-28a-tdh的酶切鉴定结果Fig.2 Restriction enzyme analysis of pET-28a-tdh
获得的pET-28a-tdh重组质粒转化到大肠杆菌DH5α感受态细胞,经IPTG诱导培养,经SDSPAGE电泳发现,诱导菌体在约23 000处出现了一条蛋白质带,分别取上清液和沉淀进行SDS-PAGE检测,结果显示目的蛋白质主要在沉淀中,说明目的蛋白质呈包涵体表达。表达产物经ProteinPure-Ni-NTAResin亲和柱纯化后得到纯化蛋白质,见图3。
2.4 TDH单克隆抗体的制备与鉴定
经过3次免疫后的小鼠血清进行间接ELISA测定,1号和4号小鼠的血清抗体效价均在1∶105以上,均可选择其脾细胞进行下一步细胞融合。选择1号和4号小鼠脾细胞与SP2/0骨髓瘤细胞融合后,经选择培养和间接ELISA筛选,获得3株具有抗体分泌能力的杂交瘤细胞,经3次有限稀释亚克隆及扩大培养后,获得能稳定分泌的杂交瘤细胞1株,经小鼠单克隆抗体亚型快速鉴定试剂盒检测为IgG1,轻链属Kappa型,命名为T9N10。
利用腹水制备抗体,收集到的腹水通过ELISA法进行效价检测,效价大于1∶105。采用辛酸硫酸铵沉淀法纯化抗体,SDS-PAGE电泳结果见图4。纯化效果良好,抗体重链大约为50 000,轻链约为25 000。

图3 pET-28a-tdh表达产物的SDS-PAGE分析Fig.3 Analysis of pET-28a-tdh products by SDS-PAGE

图4 小鼠腹水纯化电泳图Fig.4 SDS-PAGE figure for purification of ascites from BALB/c mice
2.5 单抗的特异性分析
用大肠杆菌、金黄葡萄球菌、枯草杆菌、非致病性副溶血性弧菌(无TDH)和ATCC33846的菌液包被96孔板,同时用TDH做阳性对照,结果见表1。间接ELISA结果表明,T9N10只与TDH反应呈阳性,与其他菌液都呈现阴性,不发生交叉反应,故判断T9N10具有良好的抗体特异性。
3 结语
国家食源性疾病监测网显示,副溶血性弧菌引起的食物中毒,居卫生性食物中毒首位。浙江沿海地区尤为突出,目前研究认为副溶血性弧菌产生的耐热性溶血毒(TDH)是主要的致病因子[18],因此制备出特异性针对副溶血性弧菌TDH的单克隆抗体有助于开发免疫学快速检测方法。

表1 单抗的特异性试验结果Table 1 Specific test results of monoclonal antibodies
作者利用PCR技术从实验室筛得的疑似副溶血性弧菌的基因组DNA中成功克隆了tdh基因序列,并成功构建了pET-28a-tdh原核表达的载体;经IPTG诱导,外源基因可在原核生物中表达,SDSPAGE分析证实重组蛋白的相对分子质量约为23 000,与推测的理论产物大小一致。外源基因在原核表达系统中以融合蛋白的形式表达,避免了细菌蛋白酶降解;同时运用pET-28a表达载体,表达产物中含有6×His标签,利用Ni-NTA Resin亲和柱与His结合的特异性可直接纯化目的蛋白。
用本实验室制备的TDH蛋白制备的单克隆抗体即可以特异性识别纯化的TDH蛋白,也可识别副溶血性弧菌分泌的TDH蛋白,具有良好的免疫特异性,为后续建立免疫学检测方法和深入的研究奠定良好的物质基础。
[1]ALTEKRUSE S F,BISHOP R D,BALDY L M,et al.Vibrio gastroenteritis in the US gulf of mexico region:the role of raw ostrea [J].Epidemiol Infect,2000,124:489-495.
[2]ZHOU Xiaohong,HE Yufang,XI Shengjun,et al.Investigation of food poisoning caused by vibro O4K8[J].Zhejiang Preventive Medicine,2011,23(1):52-55.
[3]WU Kui,WU Qingping,ZHANG Jumei,et al.Genetic diversity and pathogenicity research on Vibrio parahaemolyticus strains isolated from pearl river delta district[J].Modern Food Science and Technology,2015,31(7):283-293.(in Chinese)
[4]ZHAO Yanrong,WANG Zhen,LIU Biyao,et al.Epidemiology of food poisoning in Zhejiang province,2006-2011[J].Disease Surveillance,2012,27(4):307-310.(in Chinese)
[5]ZHENG Wenlong,WANG Zhuo,DONG Jie,et al.Vibrio parahaemolyticus contamination and pathogenicity in aquatic products in Tianjin:a cross-sectional study[J].Journal of Environment and Health,2015,32(6):540-543.(in Chinese)
[6]MAO Zhijuan,LIU Guoyong,CHEN Changfu.Isolation and identification of phthogenic bacteria causing ulcerosis in large yellow craker(Pseudosciaena crocea)[J].Journal of Anhui Agricultural University,2002,29(2):178-181.(in Chinese)
[7]LI Xiangping,MAO Zhijuan,HU Dayan,et al.Isolation and identification vibrio parahaemolyticus in mariculture seashells from Ningbo area[J].Journal of Huazhong Agricultural University,2008,27(2):273-278.(in Chinese)
[8]LI Yi,ZHU Xinqiang.The research of Vibrio parahaemolyticus and its hemolytic toxin[J].Chinese Journal of Health Laboratory Technology,2008,18(12):2835-2849.(in Chinese)
[9]XIE Hongyi,ZHOU Fangman,HAN Dongsheng,et al.Phenotypic and molecular characteristics of Vibrio parahaemolyticus associated with acute diarrhea in Ningbo,Zhejiang province,China[J].Chinese Journal of Clinical Laboratory Science,2013,31(10):792-794.(in Chinese)
[10]RIZVI A V,BEJ A K.Multiplexed real-time PCR amplification of tld,tdh and trh genes in Vibrio parahaemolyticus and its rapid detection in shellfish and gulf of Mexico water[J].Antonie Van Leeuwenhoek,2010,98(3):279-290.
[11]GONG Yujiao,HE Zheng,CHEN Jiandong,et al.Detection of viable but non-culturable Vibrio parahaemolyticus in frozen food by reverse transcription PCR[J].China Preventive Medicine,2010,11(10):988-990.(in Chinese)
[12]ZHANG Junxian,GUO Ailing,ZHANG Huaying.Investigation on contamination of Vibrio parahaemolyticus in aquatic products in Wuhan city[J].Chinese Journal of Health Laboratory Technology,2011,21(3):718-719.(in Chinese)
Expression of TDH from Vibrio parahaemolyticus and Preparation of Monoclonal Antibody against TDH
LI Jingjing1, LI Shanshan2, YU Yanli3
(1.Biology and Pharmaceutical Department,Zhejiang Pharmaceutical School,Ningbo 315000,China;2.Tianjin Hebei Center for Disease Control and Prevention,Tianjin 300100,China;3.Zhejiang University Mingzhou Hospital,Ningbo 315000,China)
To express of tdh gene in E.coli,TCBS medium was used to select the suspected strains of Vibrio parahaemolyticus(VP).Primers were designed and synthesized to identify VP and amplify tdh gene based on the gene sequence from GenBank.The PCR gene product was ligated into prokaryotic expression vector pET-28a,and then the recombinant plasmids pET-28a-tdh was transformed into E.coli Rosetta.TDH protein was expressed by IPTG induction.To prepare monoclonal antibody against TDH (thermostable direct hemolysin)produced by VP,the purified TDH was used to immune BALB/c mice.The hybrid tumor cells named as T9N10 were prepared to secrete monoclonal antibodies by conventional prepared techniques.The secreted monoclonalantibodies are IgG1,which was 146 000 weight,and showed strong specificity.Results provide new insights to immunological rapid detection and research.
Vibrio parahaemolyticus,VP,TDH (thermostabledirecthemolysin),prokaryotic expression,monoclonal antibody,preparation
R 392.12
A
1673—1689(2017)03—0331—05
2015-03-22
浙江医药高等专科学校教学科研项目(2012024)。
黎晶晶(1981—),女,内蒙古呼伦贝尔人,微生物与生化药学专业博士研究生。E-mail:pingljj@126.com
黎晶晶,黎珊珊,于艳丽.副溶血弧菌TDH的原核表达及单克隆抗体的制备[J].食品与生物技术学报,2017,36(03):331-335.

