新型雌激素受体GPR30激活HER2-ERK1/2促进乳腺癌MCF-7细胞迁移和侵袭*
阮姝琴,代晓燕
(1.重庆市人民医院肿瘤血液科 400013;2.第三军医大学大坪医院野战外科研究所肿瘤科实验室,重庆 400042)
论著·基础研究
新型雌激素受体GPR30激活HER2-ERK1/2促进乳腺癌MCF-7细胞迁移和侵袭*
阮姝琴1,代晓燕2△
(1.重庆市人民医院肿瘤血液科 400013;2.第三军医大学大坪医院野战外科研究所肿瘤科实验室,重庆 400042)
[摘要] 目的 探讨G蛋白耦联受体30 (GPR30)受体在低表达表皮生长因子受体2(HER2)的乳腺癌MCF-7细胞中激活HER2的分子机制和生物学意义。方法 用Western blot的方法检测17-β-雌二醇(E2)、三苯氧胺(TAM)的活性代谢产物(4-OHT)或GPR30激动剂(G-1)作用于乳腺癌MCF-7细胞后HER2和下游信号分子ERK1/2磷酸化水平的变化。在MCF-7细胞被不同的抑制剂GPR30拮抗剂(G-15)、EGFR酪氨酸激酶抑制剂(AG1478)、HER2酪氨酸激酶抑制剂(AG825)、Src家族激酶抑制剂(PP2)或MMP抑制剂(GM6001)预处理2 h后,再次检测HER2和ERK1/2的磷酸化水平变化。最后用Transwell方法检测G-1引起的MCF-7细胞迁移和侵袭能力的变化。结果 MCF-7细胞在用E2、4-OHT和G-1处理后,HER2和ERK1/2的磷酸化水平增加,该变化在用G-15、AG1478、AG825、PP2或GM6001预处理后受到抑制。而G-1引起的MCF-7细胞迁移和侵袭能力的增强也能被G-15、AG1478、AG825、PP2或GM6001抑制。结论 GPR30通过激活HER2-ERK1/2信号转导途径可促进MCF-7细胞的迁移和侵袭。
乳腺肿瘤;G蛋白耦联受体30;表皮生长因子受体2;细胞运动;侵袭
乳腺癌是全世界女性发病率第一的恶性肿瘤。内分泌治疗是雌激素受体(estrogen receptor,ER)阳性乳腺癌患者的主要治疗手段之一,三苯氧胺(tamoxifen,TAM)是绝经前此类患者的最常用药物,但其中约一半的患者最终对TAM耐药,研究发现ER和表皮生长因子受体(epidermal growth factor receptor,EGFR/ErbB/HER)信号系统之间的相互作用参与了耐药机制的形成[1]。ErbBs系统包括配体和受体两大部分,受体部分即ErbBs受体家族,目前成员包括:EGFR/ErbB1、HER2/ErbB2、HER3/ErbB3、HER4/ErbB4。其中HER2在25%~30%的乳腺癌存在过表达,该类乳腺癌表现为更具侵袭性且对内分泌治疗反应差。已有研究发现较长时间使用TAM后,乳腺癌细胞发生HER2过表达且对TAM发生耐药[2]。
G蛋白耦联受体30 (G protein-coupled receptor 30,GPR30)属于GPCR家族成员,由G蛋白耦联雌激素受体(G protein-coupled estrogen receptor,GPER)基因编码,因其与雌激素有高度亲和力而被归类为新型ER[3]。有研究发现,GPR30和EGFR之间存在信号的正反馈,导致乳腺癌的恶性表型增加且对内分泌治疗耐药[4-5]。GPR30和HER2之间相关性的研究仍少见报道,仅在对乳腺癌组织样本的免疫组织化学研究中发现二者的表达存在正相关[6]。本课题组前期研究发现,HER-3的配体heregulin-β1增加了GPR30的表达并通过激活HER2/HER3-MAPK/ERK途径促进乳腺癌细胞的迁移和侵袭,并且这种效应不依赖于ER的表达状态[7-8]。本研究将探讨在非过表达HER2的乳腺癌MCF-7细胞中激活GPR30后,HER2及其下游信号分子的变化,并进一步检测MCF-7细胞迁移和侵袭能力的改变,旨在为乳腺癌转移及内分泌耐药的形成机制提供新的解释。
1 材料与方法
1.1 材料 (1)细胞株:人乳腺癌细胞株MCF-7购自中国科学院典型培养物保藏委员会细胞库,使用添加10%胎牛血清(FBS)的MEM培养液,培养于含5%CO2的饱和湿度37 ℃恒温培养箱中,每隔2~3 d传代。(2)主要试剂:MEM培养液购自GIBCO。GPR30兔抗人多克隆抗体和ERK2兔抗人多克隆抗体购自ABCAM公司,HER2兔抗人单克隆抗体、磷酸化Erk1 (pT202/pY204)/Erk2 (pT185/pY187) 兔抗人单克隆抗体、磷酸化EGFR (pY1068) 兔抗人单克隆抗体购自Epitomics公司,磷酸化HER2兔抗人单克隆抗体(pY1221/pY1222)购自CST公司。EGFR兔抗人多克隆抗体购自Biovision;α-tublin鼠抗兔单克隆抗体购自Beyotime。17-β-雌二醇(E2)、TAM的活性代谢产物(4-OHT)、HER2酪氨酸激酶抑制剂(AG825)、Src家族激酶抑制剂(PP2)、MMP抑制剂(GM6001) 购自Sigma-Aldrich;EGFR酪氨酸激酶抑制剂(AG1478) 购自CST;GPR30激动剂(G-1) 和抑制剂GPR30拮抗剂(G-15)购自Merck。M-PER哺乳动物蛋白提取试剂盒和BCA蛋白分析试剂盒购自Thermo scientific,毛细管电泳-电化学发光法(EZ-ECL)检测试剂盒(ECL A液+ECL B液)购自Bioind,Transwell小室购自Millipore,Matrigel购自BD。
1.2 方法
1.2.1 Western blot法检测蛋白表达 按说明书提取各细胞株总蛋白,按照BCA蛋白定量试剂盒操作说明测定蛋白浓度,样品均定量为5 g/L,每条泳道上样60 μg 蛋白,经12% 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电压80 V经80 min电转移至PVDF膜。5% 脱脂奶粉封闭120 min,加入一抗,4 ℃ 孵育过夜。TBST(Tris-Buffered Saline and Tween 20)洗膜后,用二抗室温孵育90 min,TBST清洗,ECL发光并以凝胶显像仪显像。
1.2.2 Transwell法检测细胞迁移和侵袭能力 细胞用只含1% FBS的无酚红培养基培养24 h后,再换用加入处理药物的无酚红无血清培养基培养24 h。接下来,细胞被胰酶消化,磷酸盐缓冲液(PBS)清洗并用相应的含有1%牛血清清蛋白(BSA)的培养基重悬。以总细胞数1×105的200 μL并含有处理药物的培养基加于Transwell小室的上室,下室也加入含有10%FBS的400 μL无酚红培养基,并在37 ℃ 5%CO2的条件下孵育48 h。侵袭实验与迁移实验不同之处在于上室的聚碳酸酯膜上表面预先用40 μL Matrigel(以matrigel∶培养基为1∶3的比例配制)包被。在孵育48 h后,先将上室的多余培养基小心吸出,然后将上室浸入4%多聚甲醛固定20 min,再浸入0.1% 结晶紫内染色30 min,接着用小棉签小心擦净上室膜上表面,而下表面附着的细胞则为穿膜的细胞。再在倒置显微镜下选择8个视野计数,取其平均数进行分析。
1.2.3 不同药物处理后MCF-7细胞的HER2磷酸化水平检测 (1)分别用10 nmol/L E2、100 nmol/L TAM代谢活性产物4-OHT及1 μmol/L GPR30特异性激动剂G-1,1 μmol/L GPR30的特异性拮抗剂G-15处理MCF-7细胞,48 h后检测HER2磷酸化水平;(2)先用G-15预处理2 h后,再加入E2、4-OHT或G-1处理MCF-7细胞,48 h后检测HER2磷酸化水平;(3)先用10 μmol/L的AG1478、AG825、PP2或GM6001预处理2 h后,再加入G-1处理MCF-7细胞,48 h后检测EGFR、HER2和ERK1/2的磷酸化水平;(4)用G-1处理MCF-7细胞,在0、10、20、30、45、60 min后分别检测EGFR、HER2和ERK1/2的磷酸化水平。

2 结 果
2.1 GPR30信号在乳腺癌细胞MCF-7中反式激活HER2 MCF-7细胞同时表达经典ER和GPR30,但不过表达HER2,用10 nmol/L E2,100 nmol/L TAM代谢活性产物4-OHT,以及1 μmol/L GPR30特异性激动剂G-1处理MCF-7细胞后,HER2磷酸化水平均增加,但是1 μmol/L GPR30的特异性拮抗剂G-15并没有引起这种变化(图1)。在用G-15预处理2 h后,加入4-OHT或G-1均未引起HER2磷酸化增加,而E2引起的HER2磷酸化也被部分抑制,见图2。
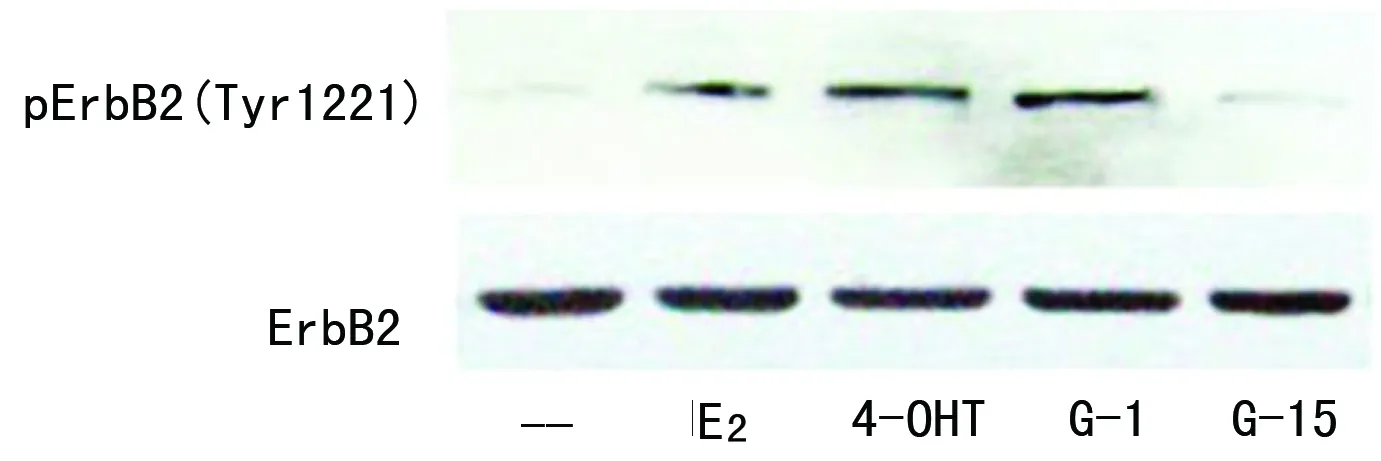
图1 不同药物处理48 h后HER2磷酸化水平

图2 G-15预处理后再用不同药物处理48 h后的HER2磷酸化水平

1:标记物;2:G-1;3:AG825;4:AG1478;5:PP2;6:GM6001。
2.2 EGFR参与了GPR30反式激活HER2的机制 EGFR酪氨酸激酶抑制剂AG1478不仅抑制了G-1引起的EGFR激酶活性及其下游的ERK1/2激活,同时也部分抑制了G-1引起的HER2磷酸化。而HER2酪氨酸激酶抑制剂AG825虽然明显抑制了HER2的激活,但仅部分抑制了G-1引起的EGFR和ERK1/2磷酸化。实验还发现Src家族激酶抑制剂PP2或MMP抑制剂GM6001不仅部分抑制了G-1引起的EGFR酪氨酸激酶磷酸化,也部分抑制了G-1引起的HER2激活(图3)。而G-1引起EGFR、HER2和ERK1/2的持续激活,在加入G-1后10 min即能检测到并维持至少2 h。GPR30信号在MCF-7细胞引起EGFR、HER2、ERK1/2 的持续激活,见图4。
2.3 GPR30信号对HER2的激活促进MCF-7细胞的迁移和侵袭 G-1能明显促进MCF-7细胞的迁移和侵袭(P<0.05);而用G-15、AG1478、AG825、PP2或 GM6001预处理2 h后,G-1促进MCF-7细胞迁徙和侵袭的能力受到部分抑制(P<0.05),见图5、6。

图4 GPR30 信号在MCF-7细胞引起EGFR、HER2、ERK1/2 的持续激活

图5 G-1和各种信号通路抑制剂对MCF-7细胞迁移和侵袭能力的影响
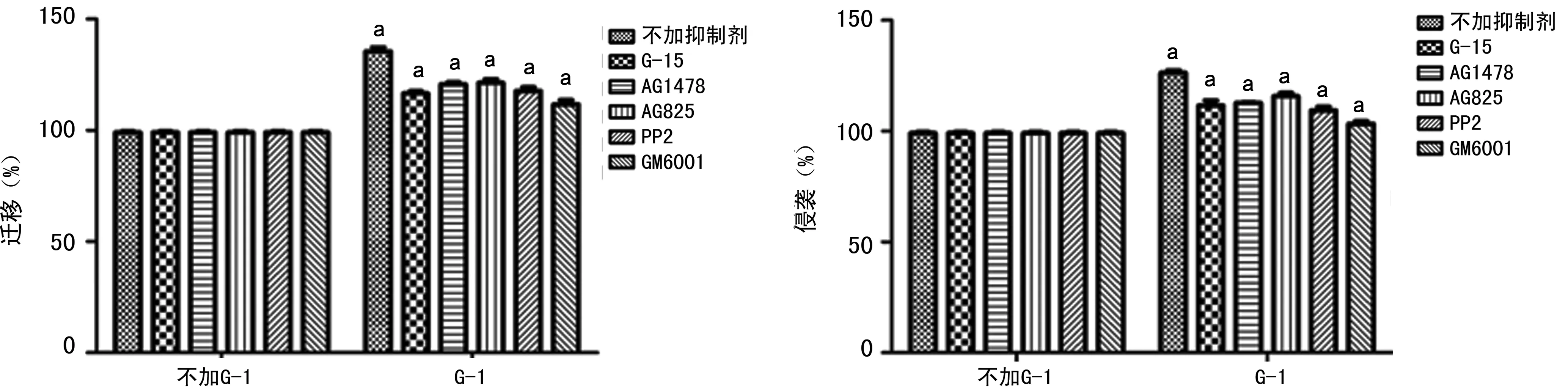
a:P<0.05,与不加G-1比较。
3 讨 论
GPR30属于GPCR,雌激素或其他配体与其结合后,后者被激活并活化其耦联G蛋白,解离出αβγ亚基进而激活Src相关酪氨酸激酶,接着活化基质金属蛋白酶(MMPs)促使肝素结合表皮生长因子(HB-EGF)释放,后者反式激活EGFR,随后快速活化MAPKs-ERK1/2和PI3K/Akt途径,继而参与细胞的增殖、迁移和分化等[9]。已有研究在宫颈癌和乳腺癌细胞中发现EGFR的配体EGF、转化生长因子(TGF)-α能通过EGFR-MAPK信号途径上调GPR30的表达[4]。本课题组前期研究证实HER3的配体heregulinβ-1能通过HER2/HER3-MAPK/ERK通路上调GPR30表达[7-8]。本研究中进一步发现GPR30不仅能反式激活EGFR,也能在EGFR参与下激活HER2及其下游MAPK/ERK信号途径。因此,在EGFR系统和GPR30之间存在信号的正反馈,不断放大下游信号。大量的文献已经证明雌激素能激活EGFR和HER2[1]。与经典ER不同的是,E2和TAM都是GPR30的激动剂,因此在表达GPR30的ER阳性的乳腺癌细胞,TAM作为ER的拮抗剂仍然可以激活GPR30,导致雌激素相关的信号应答,从而对TAM耐药[10-11]。
HER2的配体迄今为止还未被发现,仍是孤儿受体。在HER2过表达的细胞,HER2能自身形成同二聚体激活下游信号途径。在非过表达HER2的细胞,HER2也能和其他HER家族成员形成功能性的异二聚体[12]。如为了获得完全的癌基因能力,HER2可以和EGFR形成异二聚体发生相互作用从而激活下游信号途径[13]。有研究发现,让MCF-7细胞过表达HER2后,ER和EGFR(或HER2)受体间的相互激活增加从而导致了下游信号途径的进一步激活,最终对TAM抑制作用的应答减少[11]。本研究结果提示,在HER2并不过表达的乳腺癌细胞,GPR30信号引起的HER-2磷酸化需要EGFR激酶活性的参与。
有研究表明,GPCR可以调节HER2表达导致HER2激活增加。在人乳腺癌组织中,HER2表达和GPR30呈正相关[6]。本课题组前期研究结果表明,HER2上调GPR30表达与ER状态无关。在本研究中,GPR30信号并不上调HER2表达,但能激活HER2。过去的研究主要集中于HER表达水平改变的生物学意义,但HER酪氨酸激酶磷酸化才是该类受体活化并发挥生物学功能的信号标志,因此活化形式的受体比受体本身的表达水平能传达更多的信息。如磷酸化形式的人类EGFR可能与乳腺癌患者预后有潜在的作用。单因素分析研究发现,磷酸化的EGFR(pEGFR)、HER2和HER3与较差的无病生存率呈正相关[14]。在HER2阴性和HER2阳性患者中比较,磷酸化HER2与总生存期显著负相关。在淋巴结阳性患者中,磷酸化的HER2对预后判断也有价值[13]。因此,GPR30信号激活HER2应该对乳腺癌的生物学行为的影响具有更重要的意义。本课题前期对乳腺癌术后病理组织的研究,揭示GPR30与磷酸化HER2的表达呈强相关性,且GPR30和磷酸化HER2表达在淋巴结转移组明显高于淋巴结未转移组[15]。本研究发现在MCF-7细胞中,GPR30信号引起EGFR、HER2及ERK1/2持久的激活,并促进了MCF-7细胞的迁移和侵袭。
因此,雌激素信号系统和ErbBs之间存在复杂的反馈机制,本研究将有助于理解两个系统之间的相互作用现象和乳腺癌内分泌治疗耐药机制,并为建立新的乳腺癌治疗方法和途径提供新的理论基础。
[1]Osborne CK,Schiff R.Mechanisms of Endocrine Resistance in Breast Cancer[J].Annu Rev Med,2011,62(1):233-247.
[2]Cui JJ,Germer K,Wu TY,et al.Cross-talk between HER2 and MED1 regulates tamoxifen resistance of human breast cancer cells[J].Cancer Res,2014,21(72):5625-5634.
[3]Zimmerman MA,Budish RA,Kashyap S,et al.GPER-novel membrane oestrogen receptor[J].Clin Sci (Lond),2016,130(12):1005-1016.
[4]Lappano R,De Marco P,De Francesco EM,et al.Cross-talk between GPER and growth factor signaling[J].J Steroid Biochem,2013,137(18):50-56.
[5]Sjostrom M,Hartman L,Grabau D,et al.Lack of G protein-coupled estrogen receptor(GPER) in the plasma membrane is associated with excellent long-term prognosis in breast cancer[J].Brest Cancer Res Tr,2014,145 (1):61-71.
[6]Filardo EJ,Graeber CT,Quinn JA,et al.Distribution of GPR30,a seven membrane-spanning estrogen receptor,in primary breast cancer and its association with clinicopathologic determinants of tumor progression[J].Clin Cancer Res,2006,12(21):6359-6366.
[7]Ruan SQ,Wang ZH,Wang SW,et al.Heregulin-β1-induced GPR30 upregulation promotes the migration and invasion potential of SkBr3 breast cancer cells via ErbB2/ErbB3-MAPK/ERK pathway[J].Biochem Biophys Res Commun,2012,420(2):385-390.
[8]Ruan SQ,Wang SW,Wang ZH,et al.Regulation of HRG-β1-induced proliferation,migration and invasion of MCF-7 cells by upregulation of GPR30 expression[J].Mol Med Rep,2012,6(1):131-138.
[9]Filardo EJ,Quinn JA,Bland KI,et al.Estrogen-induced activation of Erk-1 and Erk-2 requires the G protein-coupled receptor homolog,GPR30,and occurs via trans-activation of the epidermal growth factor receptor through release of HB-EGF[J].Mol Endocrinol,2000,14(10):1649-1660.
[10]Marjon NA,Hu C,Hathaway HJ,et al.G protein-coupled estrogen receptor regulates mammary tumorigenesis and metastasis[J].Mol Cancer Res,2014,12(11):1644-1654.
[11]Shou J,Massarweh S,Osborne CK,et al.Mechanisms of tamoxifen resistance:increased estrogen receptor-HER2/neu cross-talk in ER/HER2-positive breast cancer[J].J Natl Cancer I,2004,12(96):926-935.
[12]Johnston S,Basik M,Hegg R,et al.Inhibition of EGFR,HER2,and HER3 signaling with AZD8931 in combination with anastrozole as an anticancer approach:Phase Ⅱ randomized study in women with endocrine-therapy-naive advanced breast cancer[J].Breast Cancer Res Treat, 2016,160(1):91-99.
[13]DeFazio-Eli L,Strommen K,Trang DP,et al.Quantitative assays for the measurement of HER1-HER2 heterodimerization and phosphorylation in cell lines and breast tumors:applications for diagnostics and targeted drug mechanism of action[J].Breast Cancer Res,2011,2(13):1-18.
[14]Frogne T,Laenkholm AV,Lyng MB,et al.Determination of HER2 phosphorylation at tyrosine 1221/1222 improves prediction of poor survival for breast cancer patients with hormone receptor-positive tumors[J].Breast Cancer Res,2009,11(1):1-14.
[15]阮姝琴,李刚,王善伟,等.乳腺癌GPR30、HRG1和HER2表达与淋巴结转移关系的研究[J].重庆医学,2015,44(7):878-880.
GPR30 promotes MCF-7 breast cancer cell migration and invasion by activating HER2-ERK1/2 signaling pathway*
RuanShuqin1,DaiXiaoyan2△
(1.DepartmentofOncologyandHematology,ChongqingMunicipalPeople′sHospital,Chongqing400013,China; 2.LaboratoryRoom,DepartmentofOncology,DapingHospital,ResearchInstituteofFieldSurgery,ThirdMilitaryMedicalUniversity,Chongqing400042,China)
[Abstract] Objective To study the molecular mechanism and biological significance of GPR30 activating HER2 in MCF-7 breast cancer cells with low expresses HER2.Methods Western blot was adopted to examine the phosphorylation of HER2 and the downstream signaling molecular ERK1/2 after 17-β-estradiol(E2),4-OHT(the active metabolite of tamoxifen) or G-1(the GPR30 agonist) treatment in MCF-7 cells.After different inhibitors such as G-15(the GPR30 antagonist),AG1478(EGFR tyrosine inhibitor),AG825 (HER2 tyrosine inhibitor),PP2 (Src family kinase inhibitor)or GM6001 (MMP inhibitor) pretreated for 2 h,the phosphorylation of HER2 and ERK1/2 were further analyzed.Finally,the altered migration and invasive capability of MCF-7 cells were detected by Transwell method.Results HER2 and ERK1/2 were activated in MCF-7 cells after E2,4-OHT or G-1 treatment and these changes could be inhibited by G-15,AG1478,AG825,PP2 or GM6001 pretreatment.The enhancement of G-1-induced migration and invasion ability in MCF-7 cells could also be inhibited by those inhibitors too.Conclusion GPR30 promotes the migration and invasion of MCF-7 cells through activating HER2-ERK1/2 signal transduction pathway.
breast neoplasms;G protein-coupled receptor 30;human epidermal growth factor receptor-2;cell movement;invasion
10.3969/j.issn.1671-8348.2017.09.005
2013年重庆市卫生局医学科研资助项目(2013-2-111);2013年重庆市渝中区科技计划项目(20130144)。 作者简介:阮姝琴(1978-),副主任医师,博士,主要从事恶性肿瘤发病机制和个体化治疗的研究。△
,E-mail:sqruan@163.com。
R737.9
A
1671-8348(2017)09-1168-04
2016-08-18
2016-11-01)

