食管癌术后肠内、肠外营养支持临床疗效比较
薛 冰(河北省邢台市第九医院胸外科,河北 邢台 055250)
·论 著·
食管癌术后肠内、肠外营养支持临床疗效比较
薛 冰
(河北省邢台市第九医院胸外科,河北 邢台 055250)
目的比较早期肠内营养(enteral nutrition,EN)支持与肠外营养(parenteral nutrition,PN)支持对食管癌术后患者的临床疗效。方法选取食管癌根治术后患者52例,依据随机数字表法分为2组各26例,2组术后分别采取EN和PN支持,术前1 d和术后1、7 d检测所有患者营养指标、肠屏障功能指标、免疫及炎性指标,同时比较2组肠功能恢复时间、术后相关并发症、术后住院时间。结果2组前白蛋白呈先下降后升高趋势,血清白蛋白和转铁蛋白呈下降趋势,时点间差异有统计学意义(P<0.05)。2组血浆内毒素、人血清肠型脂肪酸结合蛋白、D-乳酸均呈先升高再下降趋势;人血清肠型脂肪酸结合蛋白在EN组变化幅度较大,组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05);内毒素、D-乳酸时点间、组间·时点间交互作用差异有统计学意义(P<0.05)。2组肿瘤坏死因子α、C反应蛋白呈先升高后下降趋势,EN组变化幅度较大,组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05);自然杀伤细胞、CD4+/CD8+呈先下降后升高趋势,自然杀伤细胞时点间、组间·时点间交互作用差异有统计学意义(P<0.05),CD4+/CD8+时点间差异有统计学意义(P<0.05)。EN组肠功能恢复时间和术后住院时间明显短于PN组,差异有统计学意义(P<0.05)。2组术后各并发症发生率差异无统计学意义(P>0.05)。结论食管癌术后早期应用EN支持治疗,与PN支持治疗比较,可明显改善机体的营养状态、提高细胞的免疫功能,从而改善预后、降低并发症发生率、减少住院时间。
食管肿瘤;肠内营养;肠外营养
恶性肿瘤是严重威胁人类健康和生命的疾病[1]。食管癌作为胸外科比较常见的消化道恶性肿瘤,手术是最佳的治疗方法,然而由于根治手术创伤大,术后机体应激反应极为强烈,再加上患者术前即存在不同程度的营养不良、长期禁食营养摄入不足,所以患者术后普遍伴有较为严重的营养不良,因此临床常给予短期内的营养支持,而选用正确的营养支持方式对预防感染、减少并发症发生率、改善预后、促进患者早日康复都具有重要意义[2-3]。食管外科曾一度把肠外营养(parenteral nutrition,PN)作为对食管癌患者营养支持的标准方式,然而对食管癌患者进行大量长期的PN会导致肠黏膜的功能及结构受损。近年来,与人体正常生理途径相符合的肠内营养(enteral nutrition,EN)具有能迅速恢复食管癌患者术后免疫功能和肠道功能、减轻不良反应、改善患者预后等优点而备受临床医师青睐。本研究对52例食管癌患者分别采用早期EN支持与PN支持,对比观察2种营养支持方式对食管癌术后患者的疗效,旨在为食管癌患者术后寻找最佳临床营养支持方式提供依据。现报告如下。
1 资料与方法
1.1 一般资料 选取2014年11月—2016年5月我院胸外科收治的食管癌患者52例。纳入标准[4]:①经病理学与影像学检查均确诊为食管癌且未经手术治疗患者;②脏器功能均正常,无内分泌和免疫系统疾病患者;③患者或家属均已签署知情同意书。按照随机数字表法将52例食管癌根治术后患者随机分为EN组(26例)和PN组(26例),2组性别、年龄、手术时间及术中失血量等差异均无统计学意义(P>0.05),具有可比性,见表1。

表1 2组一般资料比较 (n=26,±s)
1.2 营养支持方法EN组术中均经鼻于患者屈氏韧带远端位置放置复尔凯螺旋形十二指肠营养管[药(械)准字:国食药监械(进)字2007第2662192号,购自纽迪希亚出口有限公司],同时留置胃管于胃中用于胃肠减压,于术后12h经营养管缓慢滴入250mL5%葡萄糖盐液,控制滴速为25~50滴/h;24h后若患者无腹胀继续滴注能全力营养液[国药准字H20010284,纽迪希亚制药(无锡)有限公司生产]500mL,速度为100~125mL/h;随后依据患者耐受程度,逐渐增加滴入量,直到热卡达到,即全量1 500~2 000mL;待患者肠功能恢复(以肛门通气为标准)后,逐步对其给予半流质饮食,并依据患者进食量的增加逐渐减少能全力营养液的滴入量。PN组术后24h后通过中心静脉给予等热量全能营养液(20%脂肪乳、复方氨基酸、葡萄糖、电解质、微量元素、维生素等);依据患者病情,给予热量供给1 500~2 000kcal/d,热氮比140∶1;术后第7~10天逐步变为经口流质或半流质进食。
1.3 观察指标 观察2组患者术前1d及术后1、7d的营养指标[前白蛋白(prealbumin,PA)、血清白蛋白(serumalbumin,ALB)、转铁蛋白(transferrin,TF)]、肠屏障功能指标[血浆内毒素(endotoxin,ET)、人血清肠型脂肪酸结合蛋白(intestinalfattyacidbindingprotein,I-FABP)、D-乳酸(D-Lactate,D-Lac)]、免疫及炎性指标[自然杀伤(naturalkiller,NK)细胞及CD4+/CD8+、肿瘤坏死因子α(tumornecrosisfactor-α,TNF-α)、血清C反应蛋白(C-reactiveprotein,CRP)]。比较2组肠功能恢复时间、并发症(如吻合口并发症、肺部并发症、乳糜胸、消化道并发症等)发生情况和术后住院时间。
1.4 统计学方法 应用SPSS19.0统计软件包处理数据。计量资料比较分别采用t检验和重复测量的方差分析;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1EN组与PN组手术前后营养指标比较 2组PA呈先下降后升高趋势,ALB和TF呈下降趋势,时点间差异有统计学意义(P<0.05),而组间、组间·时点间交互作用差异无统计学意义(P>0.05),见表2。

表2 EN组与PN组手术前后营养指标比较 (n=26,±s)
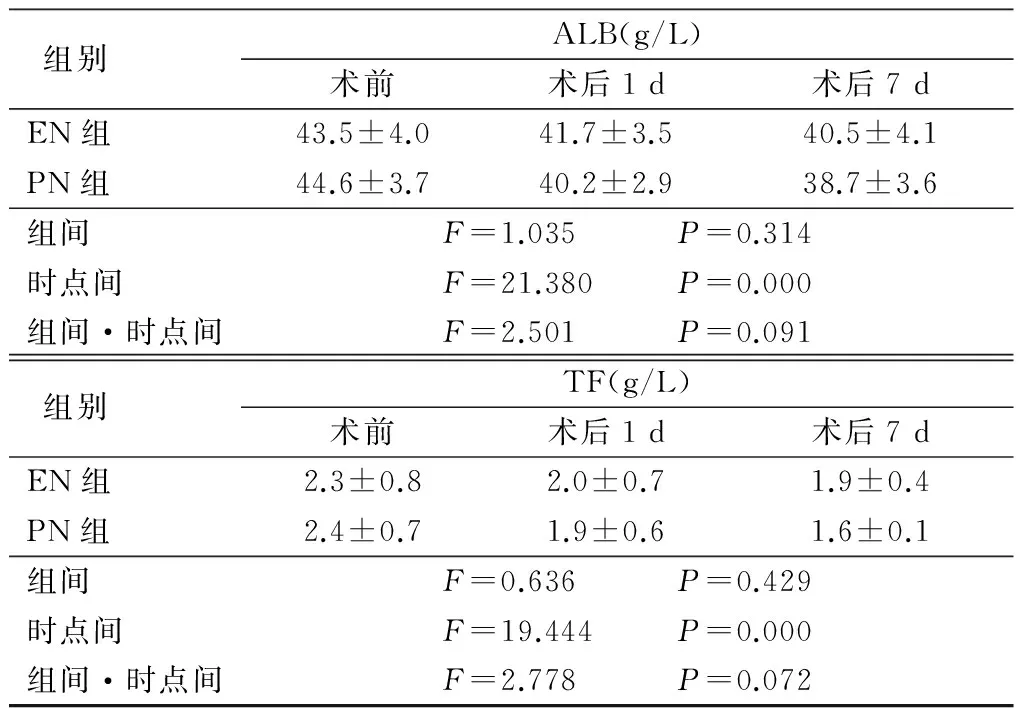
表2 (续)
2.2 EN组与PN组手术前后肠屏障功能指标比较 2组ET、I-FABP、D-Lac均呈先升高再下降趋势;EN组I-FABP变化幅度较大,组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05),ET、D-Lac时点间、组间·时点间交互作用差异有统计学意义(P<0.05),而组间差异无统计学意义(P>0.05)。见表3。

表3 EN组与PN组手术前后肠屏障功能指标比较 (n=26,±s)
2.3EN组与PN组手术前后免疫及炎性指标比较 2组TNF-α、CRP呈先升高后下降趋势,EN组变化幅度较大,组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05)。NK细胞、CD4+/CD8+呈先下降后升高趋势,NK细胞时点间、组间·时点间交互作用差异有统计学意义(P<0.05),组间差异无统计学意义(P>0.05);CD4+/CD8+时点间差异有统计学意义(P<0.05),组间、组间·时点间交互作用差异无统计学意义(P>0.05)。见表4。
2.4EN组与PN组肠功能恢复时间、术后并发症、术后住院时间比较EN组肠功能恢复时间和术后住院时间明显短于PN组,差异有统计学意义(P<0.05);2组术后各并发症发生率差异无统计学意义(P>0.05)。见表5。

表4 EN组与PN组手术前后免疫及炎性指标比较 (n=26,±s)
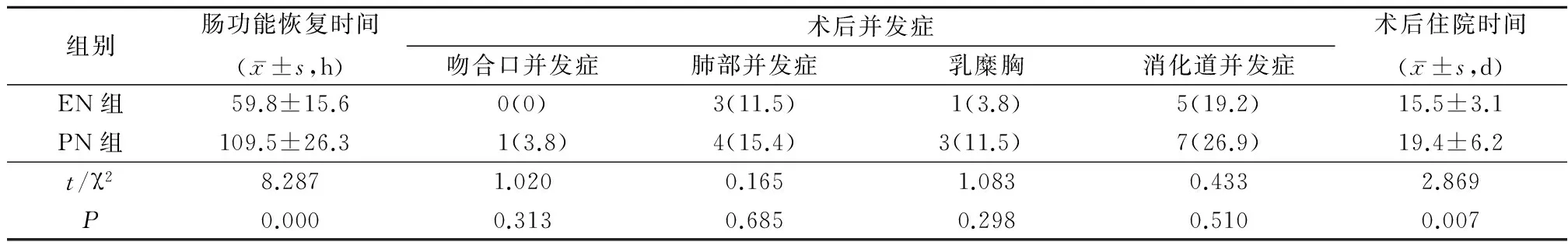
表5 EN组与PN组肠功能恢复时间、术后并发症、住院时间比较 (n=26,例数,%)
3 讨 论
食管癌患者术前由于食道阻塞、吞咽困难即存在不同程度的营养不良,并引起消瘦、贫血、相关器官和系统功能减退、抗病能力减弱等一系列对机体不利的改变,手术治疗已成为临床治疗食管癌的首选方案,然而手术创伤大[5],常引起胃肠道正常功能紊乱和免疫应激反应,致使患者长期不能进食,加剧营养不良、免疫力降低,从而导致术后感染及相关器官衰竭,严重影响患者预后并增加患者住院时间及费用[6-8]。因此,对食管癌患者来说,术后给予合理、足够的营养补充应当被视为治疗食管癌的重要组成部分。
PN支持方案于1967年在临床开始应用,普遍推广后其弊端也不断暴露,长期PN支持会导致消化系统缺少食物刺激,引起肠黏膜进行性萎缩、肠道功能异常,抑制肠黏膜保护屏障功能等[7];另外,长期PN支持价格昂贵。近来,相关临床研究显示EN较PN支持方式更具优势[9-10]:①营养物质与消化系统可直接接触,能够刺激到内脏神经使消化道产生较好的消化功能;②患者静脉输液量有所减少,减轻了患者经济与心理的双重负担;③食管癌患者在进行手术后的24 h左右是其外周血内毒素浓度最高的时间,若能及时给予患者EN支持可有效降低其内毒素水平,有效避免内毒素对肠黏膜的损害,从而进一步保护患者的肠屏障功能。
本研究用PA、ALB、TF水平评价2种支持方式对患者的营养支持效果;用NK细胞、CD4+/CD8+、TNF-α、CRP水平以及术后并发症发生情况评价患者的免疫功能恢复情况。结果显示, 2组PA呈先下降后升高趋势,TF、ALB呈下降趋势,PN组变化幅度较大,EN组术后7 d的TF、ALB及PA均显著高于PN组,说明EN支持方式更利于改善患者的机体营养状况。可能是由于外源营养物质经PN未通过肝脏的特殊处理,无选择地直接进入到了全身的血液循环,同时高糖、高渗透压对肝肾功能也会产生伤害[9-11]。EN外源营养物质通过肠道进入,可对营养物质进行选择性吸收,营养物质可通过门静脉系统于肝脏处加工处理后形成有利于机体吸收和利用的物质,更能促进患者对蛋白质的合成及身体营养状态的恢复。组内比较,术后1、7 d 2组ET、I-FABP、D-LAC均高于同组术前水平;组间比较,EN组术后7 d的ET、I-FABP、D-LAC水平均显著低于PN组,表明EN可有效改善和维持肠道黏膜细胞结构与功能的完整性,发挥正常屏障功能,利于免疫力的恢复[12-19]。EN组住院时间短于PN组,表明EN更有利于肠功能的恢复。
总之,EN支持已成为临床对食管癌术后患者的重要辅助治疗,不仅可以改善患者营养不良,还可以提高免疫力,减少感染,改善患者预后,同时减少患者住院时间和费用,值得在临床推广应用,但EN支持的途径选择有待进一步研究[20-23]。
[1] 刘彩萍,胡皓,张嫣平,等.2012年银川市居民恶性肿瘤死亡状况分析[J].医学动物防制,2015,31(1):35-38.
[2] 徐聪,陈渊,董尚文,等.食管癌术后患者早期肠内、全肠外营养对比观察[J].山东医药,2014,54(11):56-58.
[3] 魏飞.肠内营养与肠外营养在食管癌患者术后的应用探讨[J].当代医学,2014,20(36):83,84.
[4] 殷静静,林玉芬.营养支持治疗在食管癌术后的应用价值[J].中华消化外科杂志,2015,14(11):953-956.
[5] 钱斌,王道猛,吴俊,等.县级医院行微创食管癌根治术84例手术并发症临床分析[J].河北医科大学学报,2016,37(1):80-82.
[6] Wang WP,Yan XL,Ni YF,et al. Effects of lipid emulsion in parenteral nutrition of esophageal cancer surgical patients receiving enteral nutrition:a comparative analysis[J]. Nutrirnts,2014,6(1):111-123.
[7] 龙晓静,孙德强,曾英,等.食管癌术后早期肠内营养联合肠外营养与全肠外营养支持的临床疗效比较[J].中国医药导报,2016,13(5):126-129.
[8] 杨博,靳红义,王卫杰,等.肠内免疫营养对老年食管癌病人术后免疫水平的影响[J].肠外与肠内营养,2015,22(4):213-216.
[9] 赵淑萍.早期肠内营养支持在食管癌术后的应用[J].宁夏医科大学学报,2015,37(7):828-831.
[10] 王赟,谷建钟,傅婷,等.肠内免疫营养对食管癌化疗病人营养状况、血液毒性和免疫功能影响的临床研究[J].肠外与肠内营养,2014,21(2):76-79.
[11] 祝冒善.61例食管癌患者术后短期内行不同营养支持方法的临床效果研究[J].中外医学研究,2013,11(36):37,38.
[12] 李磊.食管癌患者术后早期肠内营养与肠外营养应用比较[J].泰山医学院学报,2014,35(5):377-379.
[13] 宋延堂.食管癌术后不同途径肠内营养的效果比较[J].临床合理药,2014,7(4):93.
[14] 何磊,金辉,吴留广,等.肠道营养支持在食管癌术后吻合口瘘的应用[J].中外医疗,2015,40(13):42-43.
[15] Zhu XH,Wu YF,Qiu YD,et al. Effect of early enteral combined with parenteral nutrition in patients undergoing pancreaticoduodenectomy[J]. World J Gastroenterol,2013,19(35):5889-5896.
[16] 杨孝清,邱维成,朱良纲,等.肠内与肠外营养在老年食管癌病人围手术期应用的比较[J].肠外与肠内营养,2013,20(1):8-11,14.
[17] Marano L,Porfidia R,Pezzella M,et al. Clinical immunological impact of early postoperative enteral immunonutrition after total gastrectomy in gastric cancer paitents: a prospective randomized study[J]. Ann Surg Oncol,2013,20(12):3912-3918.
[18] Mabvuure NT,Roman A,Khan OA. Enteral immunonutition versus standard enteral nutrition for patients undergoing oesophagogastric resection for cancer[J]. Surg,2013,11(2):122-127.
[19] 姚俊英,薛梅,范旻,等.联合肠外营养与肠内营养治疗在食管癌术后的应用[J].中国医师杂志,2016,18(1):8-10.
[20] 赵霖,莫伟民,吴琼.食管癌术后维生素D联合肠内免疫营养对患者免疫功能调节的影响[J].海南医学,2016,27(8):1239-1242.
[21] 陈先凯,李印,刘先本,等.加速康复外科在胸腹腔镜食管癌术中的临床应用[J].中华消化外科杂志,2015,14(12):987-992.
[22] 谭维静,刘发惠.食管癌合并糖尿病术后早期肠内营养效果分析[J].现代医药卫生,2015,21(15):2313-2315.
[23] 孙健,胡世杰,孔国平,等.食管癌高发区围手术期患者营养风险筛查和营养支持应用[J].临床荟萃,2012,27(24):2130-2132,2135.
(本文编辑:赵丽洁)
2016-08-23;
2016-09-26
薛冰(1973-),男,河北巨鹿人,河北省邢台市第九医院主治医师,医学学士,从事胸外科疾病诊治研究。
R735.1
B
1007-3205(2017)04-0464-05
10.3969/j.issn.1007-3205.2017.04.023

