大鼠脑出血后72 h脑组织的定量蛋白质组学分析
李晓芳,杨国锋,刘 丽,王鲁宁
大鼠脑出血后72 h脑组织的定量蛋白质组学分析
李晓芳,杨国锋,刘 丽,王鲁宁
目的鉴定大鼠脑出血(intracerebral hemorrhage,ICH)后的差异蛋白,分析它们在ICH中的病理生理机制,为进一步筛选特异性功能相关蛋白和药物靶点提供线索。方法制作大鼠ICH模型,应用双向凝胶电泳和基质辅助激光解析/电离飞行时间串联质谱技术和Western Blot法,鉴定大鼠ICH后72 h脑组织和正常脑组织的差异蛋白并进行验证。结果在18次重复实验中,共鉴定出39种差异蛋白,其中上调蛋白15种、下调蛋白24种。应用Western Blot法对其中2种关键性蛋白进行了验证。这些差异蛋白涉及细胞骨架、能量代谢酶类、细胞凋亡等方面。结论细胞骨架蛋白与ICH的发病机制密切相关,为探索ICH的病理生理过程和治疗靶点提供关键信息和理论依据。
脑出血;蛋白质组学;质谱;细胞骨架蛋白;大鼠
原发性脑出血(intracerebral hemorrhage,ICH)是一种导致高病死率和高致残率的脑血管病。仅美国每年就有80 000人受到此类疾病困扰,其中只有不到1/3的患者可以恢复正常[1],中国人口患ICH的比例更高[2]。但目前对于ICH的治疗仍无突破性的进展,所以研究ICH的病理生理机制对于寻找行之有效的治疗方法就显得尤为重要。ICH对脑组织的损害大致分为2个阶段:第一阶段是血液从破裂的血管溢出,对原本正常的脑组织形成机械挤压并升高局部的颅内压[3];第二阶段是基于颅内血肿的存在而引起的一系列相应的病理生理过程的损害[4]。目前,应用蛋白质组学方法分析ICH后生物标志物及蛋白的变化而明确其病理生理机制及寻找有效治疗药物的研究很有限。Ren等[5]采用液相色谱法-质谱联用的方法对比大鼠ICH和脑梗死后3 h的蛋白质的动态变化,鉴定出86种蛋白,揭示了ICH早期血肿周围蛋白的变化。Chiu等[6]应用双向凝胶电泳和质谱法分析检测了大鼠ICH模型的血糖正常组和高血糖组,共发现8种差异蛋白,其中白蛋白在ICH急性期的保护作用与血糖水平相关;血糖正常组白蛋白广泛上调表达,但在高血糖组未发现此蛋白。Walsh等[7]采集ICH、脑梗死患者发病12 h内的血液样本,并设置正常对照组,发现载脂蛋白A-1和对氧磷酶1在脑梗死组降低,且两者在脑梗死和ICH组有不同表达。但是有关ICH后第二阶段血肿周围脑组织中蛋白的变化有待进一步探索。本研究采用双向凝胶电泳和基质辅助激光解吸/电离飞行时间串联质谱(matrix-assisted laser desorption/ionization time-of-flight/time-of-flightmass spectrometry,MALDI-TOF/TOFMS)的定量蛋白质组学方法,对大鼠ICH后72 h血肿周围脑组织与正常脑组织进行对比分析,研究血肿周围脑组织蛋白的动态变化情况,旨在发现ICH急性期脑组织损害的关键性蛋白,探讨ICH后第二阶段的病理生理过程,为寻找有效治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级健康雄性Wistar大鼠12只,体重(300±10)g,由军事医学科学院实验动物中心提供[SCXK-(军)-2012-0004],分为ICH后72 h组(ICH组)和正常对照组,每组6只。
1.1.2 主要仪器及试剂 307-6型台式牙钻车(上海医疗器械有限公司齿科医械厂);立体定向仪(SN-2,日本Narishige公司);Ettan IPGphor 3等电聚焦电泳系统(瑞典Pharmacia公司);MALDI-TOF/ TOF质谱仪UltraFlex(德国Bruker公司);ImageMaster 2D Elite图像分析软件(瑞典Amersham Pharmacia Biotech公司);pH值3~10非线性24 cm固相pH梯度预制干胶条(瑞典Pharmacia公司);三氟乙酸(色谱纯,美国Aldrich Chemical公司);乙腈、甲醇等试剂(美国Fisher公司);蛋白质定量试剂盒(美国GE公司);α-烯醇化酶兔单克隆抗体(美国Santa Cruz公司);丝切蛋白-1山羊多克隆抗体(美国Santa Cruz公司);鼠抗β-actin单克隆抗体(杭州联科生物公司)。
1.2 方法
1.2.1 动物模型制备 ICH组大鼠应用7%水合氯醛腹腔注射麻醉,生效后将大鼠俯卧位固定于立体定向仪上,消毒后头部正中皮肤切开长约1 cm的纵切口,暴露前囟即Bregma点。中线右侧旁开3 mm、向后1.2 mm,垂直进针6 mm,即为大鼠尾壳核区。调整立体定向仪,使其上的微量注射器尖端移至大鼠尾壳核区,用牙科钻钻孔,直径约1 mm。用微量注射器抽取尾动脉血50μL,注入大鼠右侧尾壳核区,注射时间约10 min、留针约10 min,缓慢退针后缝合头部切口。术后大鼠恢复正常进食后,采用Longa评分法对大鼠行为学进行评分。正常对照组不予处理。在处理后72 h,处死2组动物,取血肿周边脑组织和正常对照组的对应部位,用磷酸盐缓冲液清洗后,冻存-80℃冰箱保存备用。
1.2.2 蛋白质组学分析
1.2.2.1 提取脑组织蛋白 称重脑组织,通过细胞裂解液、匀浆、超声、离心等方法提取得到脑组织蛋白的上清液,然后用蛋白质定量试剂盒测蛋白浓度[8]。
1.2.2.2 双向电泳 主要参考Sultana等[9]和Wang等[10]的方法和Ettan IPGphor 3等电聚焦电泳系统操作指南进行。共做了18次ICH组与正常对照组独立生物重复并行双向凝胶电泳比较,通过Perseus软件计算皮尔逊相关系数。然后将凝胶固定过夜、染色2~3 h、脱色液脱色,直至凝胶背景清晰为止。
扫描双向电泳凝胶,以ImageMaster 2D Elite软件进行图像分析,得出代表蛋白含量的数值。用Perseus软件(版本1.5.2.6)对所有批次实验数据进行t检验,将表达量差异在2倍以上或0.5倍以下的蛋白点作为差异蛋白。
1.2.2.3 质谱鉴定肽段、蛋白以及生物数据库检索从凝胶上切下蛋白质点,处理成凝胶颗粒,然后对其进行脱色、脱水、酶解、抽提,并将多肽抽提液冷冻抽干。用4μL 0.1%三氟乙酸溶液溶解抽干的多肽,振荡离心后,取2μL点于靶板上,用MALDI-TOF/ TOF质谱仪检测,得到肽质量指纹图谱。使用Mascot搜索引擎进行蛋白质鉴定(http://www.matrixscience.com)。检索结果中得分在51分以上的蛋白被检索软件认为可信[11]。应用 Ingenuity Pathway Analysis软件对差异蛋白进行功能、细胞定位及相互作用分析。
1.2.3 Western Blot法验证丝切蛋白-1和α-烯醇化酶的表达含量 提取等量的ICH组血肿周边脑组织和正常对照组大鼠相应部位的脑组织蛋白,分别做12.5%聚丙烯酰胺凝胶电泳。转至聚偏二氟乙烯膜,将转好的膜放在含0.05%Tween-20的磷酸缓冲液配5%脱脂奶粉的封闭液10 mL中,室温放置4 h或4℃过夜。分别加入一抗[丝切蛋白-1抗体(1∶500)、α-烯醇化酶抗体(1∶1 000)、β-actin抗体(1∶1 000)]和二抗孵育,然后显影、定影、凝胶扫描。应用图像分析软件ImageJ对Western Blot法条带进行分析,根据蛋白的含量作出柱状图。
1.2.4 生物功能分析 通过UniProt(http://www. uniprot.org)对结果进行分析,查找与整个蛋白组表达量变化最相关的通路。用Ingenuity Pathway Analysis软件分析差异表达蛋白。
2 结果
2.1 动物模型评分 ICH组6只大鼠手术后约1.5 h,意识恢复,可以正常进食,且均出现不同程度的左侧前爪不能伸展,行走时向左侧转圈,Longa评分法评分为2分。
2.2 双向电泳显示的蛋白质表达谱全貌 大鼠ICH组与正常对照组脑组织蛋白质的双向凝胶电泳图谱得到39种差异表达的蛋白。其中上调蛋白15种,H3、H4为同一种蛋白:血清白蛋白;H11和H13为同一种蛋白:神经胶质纤维酸性蛋白。下调蛋白24种,其中L4和L20为同一种蛋白:磷酸甘油酸变位酶-1(图1)。39种蛋白的名称、相对分子质量、亚细胞定位等见表1。通过Perseus软件计算皮尔逊相关系数为0.93(图2)。蛋白点L4经质谱鉴定为磷酸甘油酸变位酶-1,3D模拟图见图3。ICH组与正常对照组表达量差异为0.495,即在ICH组中表达下调。

图1 大鼠脑组织蛋白质的双向凝胶电泳图谱
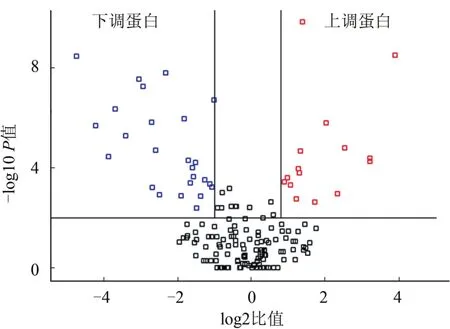
图2 18次重复实验结果的火山图
图3 磷酸甘油酸变位酶-1的3D模拟图
2.3 Western Blot法验证2种蛋白表达含量差异验证丝切蛋白-1、α-烯醇化酶的Western Blot法得到柱状图,ICH组和正常对照组差异有统计学意义(P<0.01,图4)。
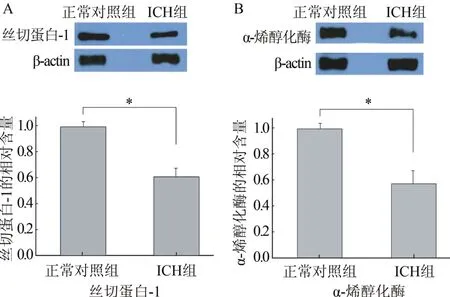
图4 丝切蛋白-1和α-烯醇化酶的Western Blot法验证
2.4 生物功能 ICH后72 h血肿周围脑组织的蛋白质主要涉及细胞骨架蛋白、物质代谢以及抗氧化作用、细胞凋亡等相关功能。其中差异表达的22种蛋白在细胞中的定位及相互作用网络图见图5。
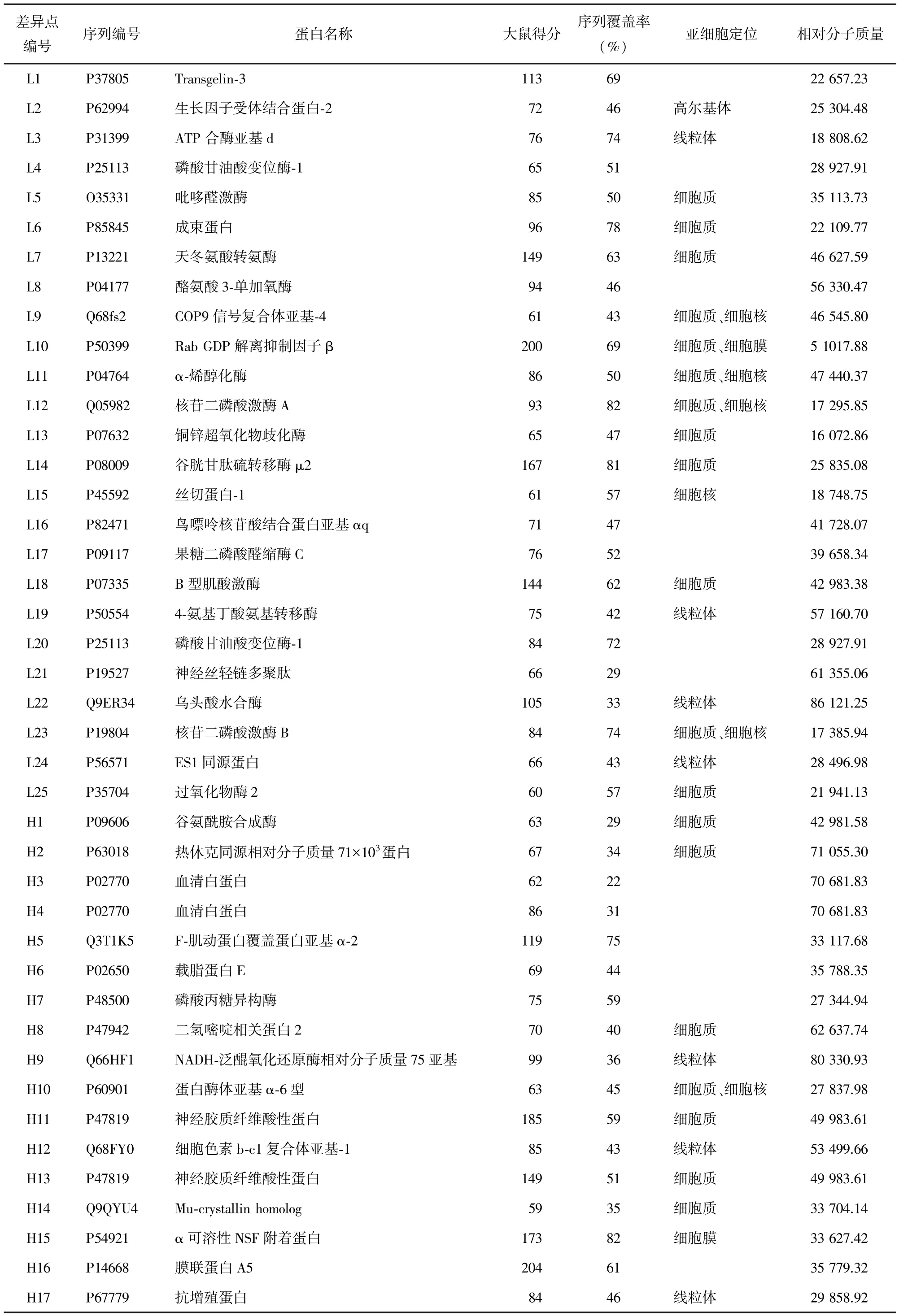
表1 通过MALDI-TOF/TOFMS鉴定出的大鼠ICH组和正常对照组的差异蛋白
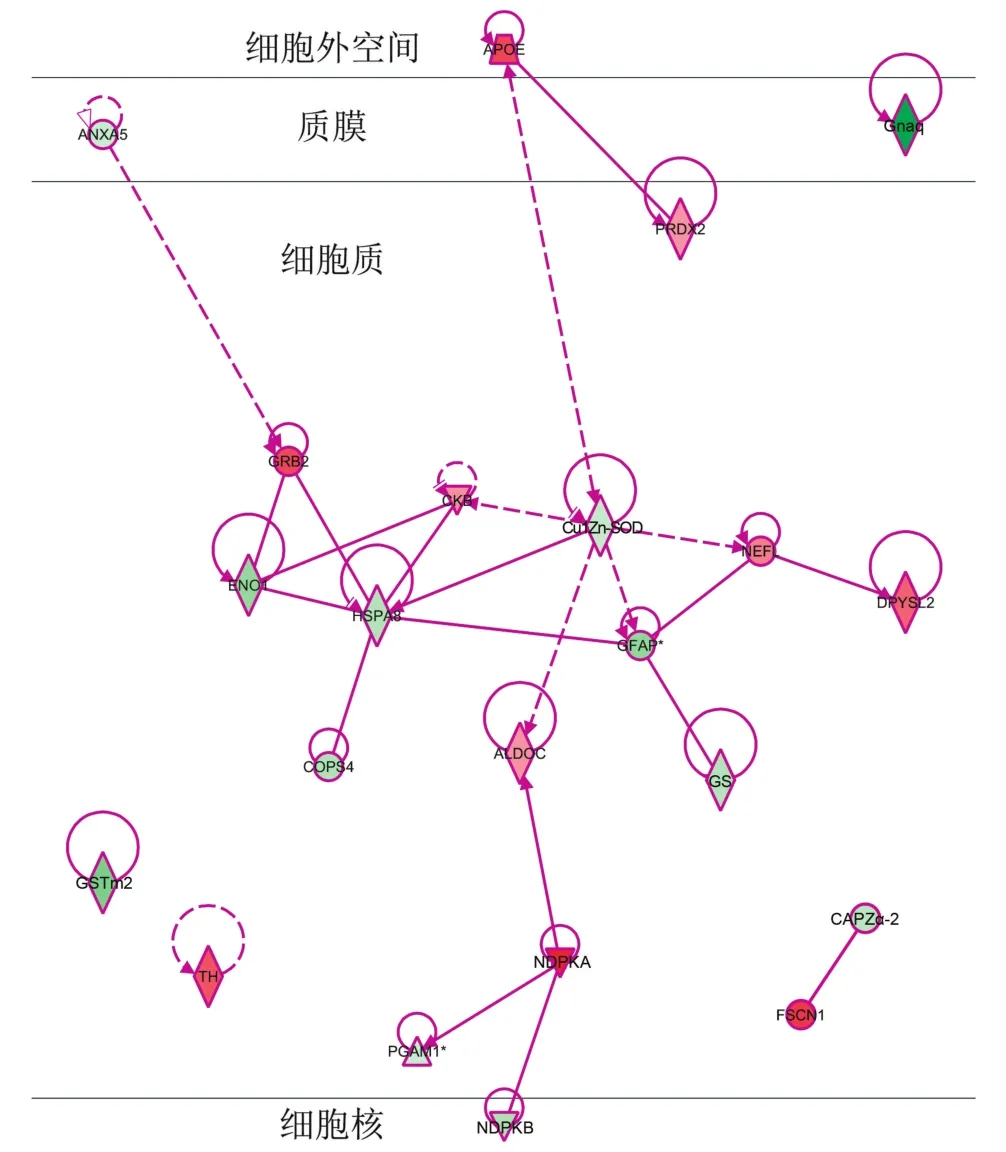
图5 22种差异蛋白在细胞中的定位及相互作用
3 讨论
ICH对脑组织的第二阶段的损害是瀑布级联反应式的,脑组织水肿、细胞凋亡、坏死以及炎症细胞的释放等都可能进一步加重脑组织的损害[12]。本研究发现ICH后72 h血肿周围脑组织有一组差异表达蛋白,这些差异蛋白主要存在于细胞质中,它们功能体现集中在细胞骨架蛋白、能量代谢酶类、细胞凋亡、抗氧化蛋白、神经递质代谢酶类等方面。讨论重点分析细胞骨架蛋白。
细胞骨架主要由微管、微丝和中间纤维组成。微丝主要由肌动蛋白组成。肌动蛋白以球状肌动蛋白和纤维状肌动蛋白2种形式存在。肌动蛋白解聚因子/丝切蛋白家族都属于肌动蛋白结合蛋白,主要作用是通过解聚和分离纤维状肌动蛋白从而维持球状肌动蛋白的重复利用。细胞骨架蛋白不仅与神经元形态密切相关,而且参与神经元的运动、轴浆运输、信息传递及细胞分裂、分化、基因表达等多种功能。本研究发现4种细胞骨架蛋白表达量发生变化,其中成束蛋白、丝切蛋白-1和神经丝轻链多聚肽蛋白表达下降,神经胶质纤维酸性蛋白表达上调。丝切蛋白-1属于肌动蛋白解聚因子/丝切蛋白家族,在脑组织表达。研究表明,ICH的氧化应激作用可能是丝切蛋白-1活化和氧化的主要机制,而丝切蛋白-1氧化可导致细胞凋亡[13]。在缺血和缺氧的原代小鼠的皮质神经元,Madineni等[14]应用丝切蛋白小干扰RNA使得丝切蛋白-1表达减少,发现减少了其到线粒体的移位和含半胱氨酸的天冬氨酸蛋白水解酶3的活化,同时提高了神经元的生存能力。丝切蛋白还可以抑制凋亡前蛋白Bax从而阻止少突胶质前体细胞的凋亡。而在ICH的第二阶段,谷氨酸盐的兴奋性毒性会阻碍丝切蛋白的这种抗凋亡作用,从而诱发了少突胶质前体细胞的凋亡[15]。此外,血脑屏障破坏的基本机制考虑与丝切蛋白的活化和紧密连接蛋白的重新分配有关[16]。大鼠脑梗死后4 h,缺血半暗带区的大脑皮质中发现丝切蛋白是过表达的[17]。而本研究中,大鼠ICH后72 h,即ICH的第二阶段,丝切蛋白-1表达下降,影响肌动蛋白的动力学,破坏细胞骨架,考虑进一步加重了细胞结构及功能的损害,推测丝切蛋白-1的修复可能会稳定细胞骨架结构,有利于脑功能的恢复及ICH的预后,有望成为ICH治疗的靶点。我们将进一步对丝切蛋白进行深入研究。
成束蛋白是由成束基因(该基因定位于7p22,长约13.8 kb,包括5个外显子和4个内含子)编码的产物,相对分子质量55×103、能与F-肌动蛋白结合成平行的束状结构的细胞骨架蛋白,含493个氨基酸,由4个β-折叠组成,其N端11~50之间的氨基酸残基高度保守;其中,第39位的丝氨酸为蛋白激酶C的磷酸化位点,该位点的磷酸化可调节成束蛋白与F-肌动蛋白的结合活性以及细胞膜表面丝状伪足和微棘,与细胞的运动、黏附及癌细胞的转移有密切关系[18]。目前有关成束蛋白与脑血管病的研究很少。本研究中,发现成束蛋白表达下调,提示成束蛋白与ICH有一定关系,但具体机制仍需进一步的实验和研究。
本研究发现,在大鼠ICH后72 h脑组织的一系列蛋白表达发生变化,提示在ICH后脑组织内细胞网络间发生复杂的多种代谢通路的变化,其中以细胞骨架蛋白表达异常最为显著,有望成为ICH治疗的潜在靶点,为今后ICH治疗提供理论基础及研究方向。
致谢感谢北京大学纪建国教授提供蛋白质双向电泳分离质谱鉴定平台
[1]Lei B,JamesML,Liu J,etal.Neuroprotective pentapeptide CN-105 improves functional and histological outcomes in a murine model of intracerebral hemorrhage[J].Sci Rep,2016,6:34834.
[2]TsaiCF,Thomas B,Sudlow CL.Epidemiology of stroke and its subtypes in Chinese vs white populations:a systematic review[J].Neurology,2013,81(3):264-272.
[3]Qureshi AI,Mendelow AD,Hanley DF.Intracerebral haemorrhage[J].Lancet,2009,373(9675):1632-1644.
[4]Aronowski J,Zhao X.Molecular pathophysiology of cerebral hemorrhage:secondary brain injury[J].Stroke,2011,42(6):1781-1786.
[5]Ren C,Guingab-Cagmat J,Kobeissy F,et al.A neuroproteomic and systems biology analysis of rat brain post intracerebral hemorrhagic stroke[J].Brain Res Bull,2014,102:46-56.
[6]Chiu CD,Chen TY,Chin LT,et al.Investigation of the effect of hyperglycemia on intracerebral hemorrhage by proteomic approaches[J].Proteomics,2012,12(1):113-123. [7]Walsh KB,Hart K,Roll S,et al.Apolipoprotein A-Ⅰ and paraoxonase-1 are potential blood biomarkers for ischemic stroke diagnosis[J].J Stroke Cerebrovasc Dis,2016,25 (6):1360-1365.
[8]Wang Q,Zhao X,He S,etal.Differential proteomics analysis of specific carbonylated proteins in the temporal cortex of aged rats:the deterioration of antioxidant system[J].Neurochem Res,2010,35(1):13-21.
[9]Sultana R,Boyd-Kimball D,Cai J,et al.Proteomics analysis of the Alzheimer’s disease hippocampal proteome[J].J Alzheimers Dis,2007,11(2):153-164.
[10]Wang Q,Liu Y,Zou X,et al.The hippocampal proteomic analysis of senescence-accelerated mouse:implications of Uchl3 and mitofilin in cognitive disorder and mitochondria dysfunction in SAMP8[J].Neurochem Res,2008,33(9): 1776-1782.
[11]An M,Dai J,Wang Q,et al.Efficientand clean charge derivatization of peptides for analysis by mass spectrometry [J].Rapid Commun Mass Spectrom,2010,24(13):1869-1874.
[12]Qureshi AI,Ali Z,Suri MF,et al.Extracellular glutamate and other amino acids in experimental intracerebral hemorrhage:an in vivo microdialysis study[J].Crit Care Med,2003,31(5):1482-1489.
[13]Klamt F,Zdanov S,Levine RL,et al.Oxidant-induced apoptosis ismediated by oxidation of the actin-regulatory protein cofilin[J].Nat Cell Biol,2009,11(10):1241-1246.
[14]Madineni A,Alhadidi Q,Shah ZA.Cofilin inhibition restores neuronal cell death in oxygen-glucose deprivation model of ischemia[J].Mol Neurobiol,2016,53(2):867-878.
[15]Simonishvili S,Jain MR,Li H,et al.Identification of Baxinteracting proteins in oligodendrocyte progenitors during glutamate excitotoxicity and perinatal hypoxia-ischemia[J]. ASN Neuro,2013,5(5):e00131.
[16]Tominaga N,Kosaka N,Ono M,et al.Brain metastatic cancer cells release microRNA-181c-containing extracellular vesicles capable of destructing blood-brain barrier[J].Nat Commun,2015,6:6716.
[17]Demyanenko S,Uzdensky A.Profiling of signaling proteins in penumbra after focal photothrombotic infarct in the rat brain cortex[J].Mol Neurobiol,2016[Epub ahead of print].
[18]Adams JC,Clelland JD,CollettGD,etal.Cell-matrix adhesions differentially regulate fascin phosphorylation[J].Mol Biol Cell,1999,10(12):4177-4190.
Quantitative proteom ic analysis of rat brain tissue at 72-hour after intracerebral hemorrhage
LIXiaofang1,2,YANGGuofeng2,LIU Li3,WANG Luning4
(1.Department of Neurology,Kailuan General Hospital,Tangshan Hebei 063000,China;2.Department of Neurology,the Second Hospital of HebeiMedical University,Shijiazhuang Hebei 050000,China;3.Medical Center of Navy Aviator Enlistment,Navy General Hospital,Beijing 100048,China;4.Department of Neurology,Chinese PLA General Hospital,Beijing 100853,China)
ObjectiveTo identify the differentially expressed proteins in rat intracerebral hemorrhage(ICH)and analyze the related physiopathologic mechanism to pave the way for screening special function related proteins and drug targets.M ethodsWe made a rat ICH model and then used two-dimensional gel electrophoresis(2-DE)andmatrix-assisted laser desorption ionization-time of flight/time of flightmass spectrometry(MALDI-TOF/TOF MS)to identify the differentially expressed proteins between the 72-hour after ICH group and the normal control group,and then used Western Blot to validate.ResultsIn total,39 proteins differentially expressed were identified in 18 replicated experiments,among which 15 proteins are up-regulated and 24 proteinswere down-regulated.Then,2 key proteins were validated by Western Blot.These differentially expressed proteins include energymetabolic enzymes,antioxidants proteins,apoptosis related proteins cytoskeleton proteins and other proteins.ConclusionCytoskeleton proteins were closely related to pathogenesis of ICH.Thesemay provide the key information and theoretical clue for exploring the ICH physiopathologic process and would be potential therapeutic targets in ICH.
Intracerebral hemorrhage(ICH);Proteomics;Mass spectrometry;Cytoskeleton proteins;Rat
R743.34-332;Q51
A
2095-3097(2017)02-0074-06
10.3969/j.issn.2095-3097.2017.02.003
2016-09-28 本文编辑:徐海琴)
国家自然科学基金面上项目(31270872)
063000河北 唐山,开滦总医院神经内科(李晓芳);050000河北石家庄,河北医科大学第二医院神经内科(李晓芳,杨国锋);100048北京,海军总医院海空勤体检中心(刘 丽);100853北京,解放军总医院神经内科(王鲁宁)
杨国锋,E-mail:yang-guofeng@163.com

