Ras同源物基因家族成员B对肾透明细胞癌细胞生长及迁移能力的影响
陈伟浩,徐衍盛,欧阳昀,王希友,吴意光,张新宇,王 毅,周茂军,赵豫波,关维民,刘萃龙
Ras同源物基因家族成员B对肾透明细胞癌细胞生长及迁移能力的影响
陈伟浩,徐衍盛,欧阳昀,王希友,吴意光,张新宇,王 毅,周茂军,赵豫波,关维民,刘萃龙
目的研究干扰Ras同源物基因家族成员B(Ras homolog gene familymember B,RhoB)表达后对肾透明细胞癌(renal clear cell carcinoma,RCCC)细胞生长及迁移能力的影响。方法检测RhoB在RCCC细胞中的蛋白表达水平,采用脂质体转染方法转染RhoB真核表达载体pcDNA3.0-Flag-RhoB和沉默RhoB的小干扰RNA(small interfering RNA,siRNA)即si-RhoB序列及相应空载体和对照序列,应用Western Blot法检测转染后RhoB的蛋白表达情况,通过3-(4,5-二甲基吡啶-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺苯基)-2H-四唑[3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium,MTS]法、平板克隆和Transwell小室细胞迁移实验检测细胞生长和细胞迁移能力的变化。结果RhoB在RCCC细胞中表达降低。与转染空载体组比较,转染pcDNA3.0-Flag-RhoB重组质粒组RhoB的蛋白表达水平明显上调;与转染对照组比较,si-RhoB转染组RhoB的蛋白表达水平明显下调。在RCCC细胞786-O和Caki-1中,上调RhoB的表达后,在4、5、6 d经MTS法测定光密度值明显降低(P<0.05);在786-O细胞中上调RhoB表达后细胞克隆数明显减少;转染48 h后Transwell细胞迁移数明显减少(P<0.05)。而下调RhoB表达后,细胞生长和Transwell细胞迁移数没有明显变化。在相对高表达RhoB的正常人肾小管上皮细胞中下调RhoB表达后细胞生长和细胞迁移数明显增多。结论 过表达RhoB后明显抑制RCCC细胞生长和迁移能力。
Ras同源物基因家族成员B;肾透明细胞癌;细胞生长;迁移
肾细胞癌(renal cell carcinoma,RCC)是泌尿系统最常见的恶性肿瘤之一,其发病率仅次于膀胱癌,其中60%~85%的病理分型为肾透明细胞癌(renal clear cell carcinoma,RCCC)[1]。Ras同源物基因家族成员B(Ras homolog gene familymember B,RhoB)是Rho亚家族中一个较为独特的分子,是细胞信号转导通路中的重要因子,通过调节细胞骨架、细胞间黏附及细胞的转化等活动,进而在调节肿瘤的增殖、凋亡、侵袭和迁移等方面发挥重要作用[2]。目前,RhoB在RCCC的生物学功能鲜见报道。作者通过干扰RhoB在RCCC细胞中的表达水平,初步探讨RhoB对RCCC细胞生长及迁移的影响。
1 材料与方法
1.1 材料 正常人肾小管上皮细胞(human kideny tubular epithelial cell,HKC)和 RCCC细胞 786-O、769-P、Caki-1均为解放军总医院泌尿外科实验室保存。10%胎牛血清、无血清Opti-Mem培养基(伊格尔最低限度必需介质培养基改良型)购自美国Gibco公司;达尔伯克改良伊格尔培养基(Dulbecco’s modified Eagle’smedium,DMEM)、洛斯维-帕克纪念研究所(Royal Park Memorial Institute,RPMI)1640培养基购自美国Hyclone公司;蛋白裂解液试剂盒、二辛可宁酸蛋白定量试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶制备试剂盒(北京索莱宝生物科技有限公司);聚偏二氟乙烯膜(美国Bio-Rad公司);封闭用脱脂奶粉(北京普利莱基因技术有限公司);化学发光底物试剂盒(美国Invitrogen公司);沉默RhoB的小干扰RNA(small interfering RNA,siRNA)即si-RhoB序列和对照序列为上海吉玛公司合成;脂质体Lipofectamine 2000TM(美国Invitrogen公司);磷酸盐缓冲液、Tris缓冲液(Tris buffered saline,TBS)/0.1% Tween-20(TBST)及辣根过氧化物酶标志的兔抗羊免疫球蛋白G(北京中杉金桥公司);兔抗人RhoB (武汉三鹰公司);3-(4,5-二甲基吡啶-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺苯基)-2H-四唑[3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium,MTS]试剂盒(美国Promega公司);Transwell小室(美国Corning公司)。
1.2 方法
1.2.1 细胞转染 RhoB重组质粒pcDNA3.0-Flag-RhoB为前期实验室构建并保存。si-RhoB序列:上游引物5′-ACGUCAUUCUCAUGUGCUUTT-3′、下游引物5′-AAGCACAUGAGAAUGACGUTT;对照序列:上游引物5′-UUCUCCGAACGUGUCACGUTT-3′、下游引物5′-ACGUGACACGUUCGGAGAATT-3′。培养细胞处于增殖期时,以每孔2 000个细胞的密度平铺于6孔板培养皿上,至细胞覆盖率达到70%~80%时开始转染。转染按照Lipofectamine 2000TM说明书分别将pcDNA3.0-Flag-RhoB及空载体和si-RhoB及对照序列储存液与Lipofectamine 2000TM混合于Opti-Mem中制成转染液,最后分别将各组混合好的转染液按分组加入6孔板培养皿,每次处理重复3次。
1.2.2 Western Blot法检测 转染48 h后收集细胞,使用蛋白裂解液试剂盒,按照说明书提取细胞总蛋白,采用二辛可宁酸法测定蛋白浓度。提取蛋白经沸水煮10 min加热变性后,按蛋白量为每孔50 μg加样,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离(12%分离胶、5%浓缩胶),将蛋白转移至聚偏二氟乙烯膜上。5%脱脂奶粉室温封闭1 h后,加入一抗兔抗人RhoB(1∶1 000稀释),4℃封闭过夜;TBST洗膜3次,每次10 min,再加入1∶3 000稀释的辣根过氧化物酶标志的二抗及β-actin室温孵育1 h;应用TBST洗膜3次,每次10 min,然后加入化学发光底物,暗室中用X线片曝光后,经英国Uvitec公司凝胶成像系统摄像;采用Image-Pro Plus 7.0软件分析条带的灰度值,以RhoB/β-actin代表 RhoB的相对表达量。
1.2.3 MTS法和平板克隆实验检测转染后细胞生长能力 实验分为转染pcDNA3.0-Flag-RhoB的重组质粒组、空载体组,si-RhoB组及对照组,每组各设6个复孔,收集对数期生长的细胞,按照每孔5 000个细胞密度接种于96孔培养板中,在37℃、5% CO2孵育,1、2、3、4、5、6 d后每孔加20μL MTS溶液,继续培养2 h。酶标仪上选择490 nm波长测定各孔光密度值。计算6孔平均值,以时间为横坐标,光密度值为纵坐标绘制细胞生长曲线。取对数生长期的各组细胞,分别用0.25%胰蛋白酶消化并吹打成单个细胞,并将细胞悬液在10%胎牛血清的RPMI 1640培养基中备用。将各组细胞按照每孔400个细胞密度接种于培养皿中,置于37℃、5%CO2及饱和湿度的细胞培养箱中培养2~3周;当培养皿中出现肉眼可见的克隆时终止培养,弃去上清液,用磷酸盐缓冲液小心浸洗2次,加4%多聚甲醛固定细胞;然后弃去固定液,加适量基姆萨染色10~30 min;最后用流水缓慢洗去染色液,空气干燥。显微镜下进行阳性克隆计数(超过50个克隆细胞)。所有实验重复3次。
1.2.4 Transwell小室实验检测转染后细胞迁移能力 实验按分组,各组细胞转染48 h后,细胞计数后用含1%胎牛血清的DMEM重悬,调整细胞至2 000/mL,每组加100μL细胞悬液(含2×104个细胞)在Transwell小室,下室加入含10%胎牛血清的DMEM 500μL作为趋化因子,在37℃、5%CO2培养箱培养。24 h后取出Transwell小室吸干其中的液体,4%多聚甲醛固定30 min后用结晶紫染色;用棉签擦净小室底部,将小室倒过来背朝上晾干后于显微镜下拍照,随机取10个视野,统计每个随机视野中的细胞数,计算平均值。实验重复3次。
1.3 统计学处理 应用SPSS 13.0软件,计量资料以均数±标准差(¯x±s)表示,2组比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 RhoB在RCCC细胞中的蛋白表达 与HKC比较,RhoB在RCCC细胞中的蛋白表达明显降低(图1)。
2.2 RhoB对RCCC细胞生长的影响 与转染空载体组比较,RhoB在重组质粒组中的蛋白表达明显上调(图2A);与对照组比较,RhoB在si-RhoB组中的蛋白表达明显下调(图2B)。与转染空载体组比较,转染重组质粒组在转染后4、5、6 d经MTS法测定光密度值明显降低;而下调RhoB的表达后786-O、Caki-1细胞的生长没有明显变化(图2C、D)。在HKC中下调RhoB的表达后,可促进HKC的生长能力(图2E)。过表达RhoB后重组质粒组细胞的克隆数较空载体组明显减少(P<0.05,图2F)。
2.3 RhoB对RCCC细胞迁移能力的影响 转染pcDNA3.0-Flag-RhoB的重组质粒组的细胞迁移数较转染空载体组明显减少,而在转染si-RhoB组及转染对照组的细胞迁移数没有明显变化(图3A)。在HKC中下调RhoB的表达,si-RhoB组的细胞迁移数明显增多(图3B)。
3 讨论
RCC是泌尿系统常见的恶性肿瘤之一,占成人恶性肿瘤的2%~3%,其中RCCC是肾癌中最常见的一种病理分型,恶性程度比较高,容易发生远处转移[3]。肾癌早期无明显临床症状,目前临床诊断主要依靠B超、CT或磁共振等影像学检测,缺乏有效的肿瘤标志物用于早期诊断。由于RCC对放疗和化疗不敏感,其主要治疗方式为根治性肾切除,但术后仍有部分患者出现远处转移。而近年来应用于临床的靶向药物也暴露出一些问题,如费用较高、易产生耐药性、不良反应较多等[4]。因此,寻找能够早期诊断、治疗及预测预后的RCCC的分子标志物,是目前亟待解决的问题。
Rho家族属于小G蛋白家族成员,相对分子质量为(20~25)×103。RhoB是Rho家族中的一个较为独特的分子,虽然与RhoA、RhoC有高度的同源性,但在细胞定位、细胞表达及功能等方面有较大差异[5]。研究发现,RhoB在肺癌、胃癌、膀胱癌等多种恶性肿瘤中表达降低或缺失[6-8];在卵巢癌中过表达RhoB可通过激活内在凋亡级联效应诱导癌细胞发生凋亡,而且明显抑制卵巢癌移植瘤的生长[9]。研究表明,下调RhoB的表达可通过磷脂酰肌醇3-激酶/蛋白激酶信号通路促进人支气管细胞的迁移和侵袭[10],而在未分化甲状腺癌中再激活RhoB的表达是抑制肿瘤生长的关键环节[11]。说明RhoB在恶性肿瘤的发生、发展中作为抑癌基因发挥重要作用。
本研究首先检测RhoB在RCCC细胞中的蛋白表达,发现与正常HKC相比,RhoB在肾癌细胞中的表达明显降低,这与RCCC组织中的表达相一致。选用RCCC细胞786-O和Caki-1,通过转染RhoB真核表达载体及si-RhoB序列上调和下调RhoB的表达,采用MTS法、细胞平板克隆方法和Transwell小室方法检测干扰RhoB的表达后肾癌细胞生长和迁移能力的变化,发现上调RhoB的表达后抑制肾癌细胞的生长和迁移能力,而下调RhoB的表达对肾癌细胞的细胞生长和迁移能力没有明显影响。作者认为RhoB在RCCC细胞中表达极低,降低RhoB的表达后对其生物学行为没有明显影响。因此,在相对高表达RhoB的HKC中下调RhoB的表达,观察细胞生长和迁移的变化,结果显示下调RhoB的表达后促进HKC的生长和迁移能力。本研究显示过表达RhoB后明显抑制肾癌细胞的细胞生长和细胞迁移能力,说明RhoB在肾癌的发生和发展中可能发挥负性调节作用,但具体分子机制还有待进一步深入研究。
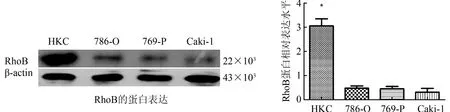
图1 RhoB在RCCC细胞中的蛋白表达
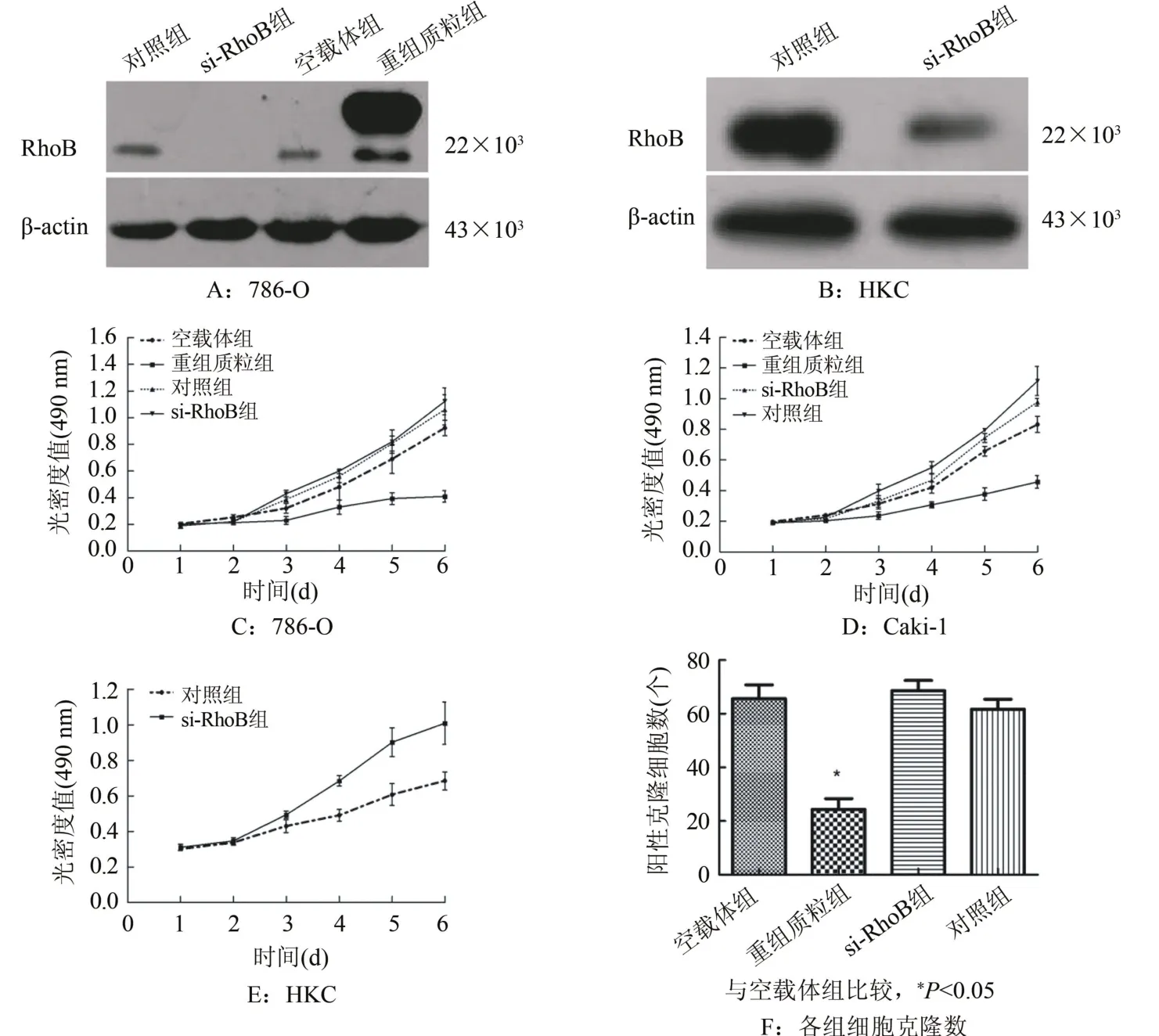
图2 RhoB对RCCC细胞生长的影响
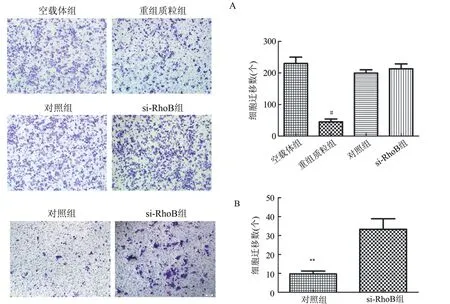
图3 RhoB对RCCC细胞迁移能力的影响
[1]那彦群,叶章群,孙颖浩,等.中国泌尿外科疾病诊断治疗指南(2014版)[M].北京:人民卫生出版社,2014:3-4.
[2]Vega FM,Thomas M,Reymond N,et al.The Rho GTPase RhoB regulates cadherin expression and epithelial cell-cell interaction[J].Cell Commun Signal,2015,13:6.
[3]Garcia JA,Rini BI.Recent progress in themanagement of advanced renal cell carcinoma[J].CA Cancer JClin,2007,57(2):112-125.
[4]Ni D,Ma X,Li HZ,et al.Downregulation of FOXO3a promotes tumor metastasis and is associated with metastasisfree survival of patients with clear cell renal cell carcinoma[J].Clin Cancer Res,2014,20(7):1779-1790.
[5]Ridley AJ.RhoA,RhoB and RhoC have different roles in cancer cellmigration[J].JMicrosc,2013,251(3):242-249.
[6]Bousquet E,Calvayrac O,Mazieres J,et al.RhoB loss induces Rac1-dependentmesenchymal cell invasion in lung cells through PP2A inhibition[J].Oncogene,2016,35(14): ses of propofol and midazolam for nausea and vomiting during spinal anesthesia for cesarean section[J].Anesth Pain Med,2014,4(4):e19384.
[10]Borgeat A,Stirnemann HR.Antiemetic effect of propofol[J]. Anaesthesist,1998,47(11):918-924.
[11]DiFlorio T.Is propofol a dopamine antagonist?[J].Anesth Analg,1993,77(1):200-201.
[12]Cechetto DF,Diab T,Gibson CJ,et al.The effects of propofol in the area postrema of rats[J].Anesth Analg,2001,92(4):934-942.
[13]Collins GG.Effects of the anaesthetic 2,6-diisopropylphenol on synaptic transmission in the rat olfactory cortex slice[J].Br JPharmacol,1988,95(3):939-949.
[14]Ersoy A,Kara D,Ervatan Z,et al.Sedation in hypoalbuminemic geriatric patients under spinal anesthesia in hip surgery.Midazolam or Propofol?[J].SaudiMed J,2015,36 (10):1191-1198.
[15]Elvir Lazo OL,White PF,Tang J,etal.Propofol versusmidazolam for premedication:a placebo-controlled,randomized double-blinded study[J].Minerva Anestesiol,2016,82 (11):1170-1179.
[16]Nitsun M,Szokol JW,Saleh HJ,et al.Pharmacokinetics of midazolam,propofol,and fentanyl transfer to human breast milk[J].Clin Pharmacol Ther,2006,79(6):549-557.
[17]Sigalas J,Galazios G,Tsikrikoni I,et al.The influence of themode of anaesthesia in the incidence of neonatalmorbidity after an elective caesarean section[J].Clin Exp Obstet Gynecol,2006,33(1):10-12.1760-1769.
[7]Zhou J,Zhu Y,Zhang G,et al.A distinct role of RhoB in gastric cancer suppression[J].Int JCancer,2011,128(5): 1057-1068.
[8]Volanis D,Zaravinos A,Kadiyska T,et al.Expression profile of Rho kinases in urinary bladder cancer[J].JBUON,2011,16(3):511-521.
[9]Liu Y,Song N,Ren K,etal.Expression loss and revivification of RhoB gene in ovary carcinoma carcinogenesis and development[J].PLoSOne,2013,8(11):e78417.
[10]Bousquet E,Mazieres J,Privat M,et al.Loss of RhoB expression promotesmigration and invasion of human bronchial cells via activation of AKT1[J].Cancer Res,2009,69(15):6092-6099.
[11]Marlow LA,Reynolds LA,Cleland AS,et al.Reactivation of suppressed RhoB is a critical step for the inhibition of anaplastic thyroid cancer growth[J].Cancer Res,2009,69 (4):1536-1544.
(收稿日期:2016-10-08 本文编辑:徐海琴)
The effect of Ras homolog gene fam ily member B on cell grow th activity and m igration of renal clear cell carcinoma
CHENWeihao,XU Yansheng,OUYANG Yun,WANG Xiyou,WU Yiguang,ZHANG Xinyu,WANG Yi,ZHOU Maojun,ZHAO Yubo,GUANWeimin,LIU Cuilong
(Department of Urology,Navy General Hospital,Beijing 100048,China)
ObjectiveTo study the effect of Ras homolog gene familymember B(RhoB)on cell growth activity and migration of renal clear cell carcinoma(RCCC).M ethodsThe protein expression of RhoB was detected in RCCC cell lines.Liposome-mediated method was used to transfect pcDNA3.0-Flag-RhoB vector or pcDNA3.0-Flag empty vector,and small interfering RNA(siRNA) targeting RhoB or negative control oligo into the clear cell renal cell carcinoma cell line 786-O and Caki-1 cells.RhoB protein expression levels after transfection were detected by Western Blot.3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium(MTS),cell plate colony and Transwell assayswere used to detect changes in cell growth and cellmigration.ResultsRhoB was low-expression in RCCC cell lines.Compared to empty vector group and siRNA control group,the protein levels of pcDNA3.0-Flag-RhoB and siRNA RhoB group were significantly upregulated and down regulated(P<0.05)respectively.In the groups of 786-O and Caki-1 cells,MTS assay showed the absorbance was significantly decreased respectively in pcDNA3.0-Flag-RhoB group at time of the 4,5,6 day after transfection,and the cell colony number was remarkably decreased after upregulation of RhoB in 786-O cells.Transwell assay showed the cellmigration numbers in pcDNA3.0-Flag-RhoB group were significantly decreased after 48-hour transfection(P<0.05). By contrast,the cells transfected with si-RhoB didn’t differ in terms of cell growth and cellmigra-tion.In the relative high expression RhoB of the human kideny tubular epithelial cell cells,down regulation of RhoB significantly promoted the cell growth and cellmigration ability.ConclusionOverexpression of RhoB remarkably inhibited the cancer cell proliferation and also reduced themigration ability of RCCC.
Ras homolog gene family member B(RhoB);Renal clear cell carcinoma (RCCC);Cell growth;Migration
R737.11;Q51
A
2095-3097(2017)02-0080-05
10.3969/j.issn.2095-3097.2017.02.004
2016-12-10 本文编辑:张在文)
海军总医院创新培育基金(CXPY201423)
100048北京,海军总医院泌尿外科(陈伟浩,徐衍盛,欧阳昀,王希友,吴意光,张新宇,王 毅,周茂军,赵豫波,关维民,刘萃龙)
王希友,E-mail:510198870@qq.com
——一道江苏高考题的奥秘解读和拓展

