泽泻提取物对油酸诱导建鲤脂肪肝细胞损伤中生化指标及CYP1A蛋白表达的影响
[KH-*D]杜金梁,曹丽萍,贾睿,徐跑,*,殷国俊,*
(1.中国水产科学研究院淡水渔业研究中心农业部淡水渔业和种质资源利用重点实验室,江苏无锡214081;2.中国水产科学研究院淡水渔业研究中心农业部鱼类免疫药理学国际联合实验室,江苏无锡214081;3.南京农业大学无锡渔业学院,江苏无锡214081)
泽泻提取物对油酸诱导建鲤脂肪肝细胞损伤中生化指标及CYP1A蛋白表达的影响
[KH-*3D]杜金梁1,2,曹丽萍1,2,贾睿3,徐跑1,2,3*,殷国俊1,2,3*
(1.中国水产科学研究院淡水渔业研究中心农业部淡水渔业和种质资源利用重点实验室,江苏无锡214081;2.中国水产科学研究院淡水渔业研究中心农业部鱼类免疫药理学国际联合实验室,江苏无锡214081;3.南京农业大学无锡渔业学院,江苏无锡214081)
为了研究中药泽泻提取物对油酸诱导建鲤脂肪肝变性细胞的保护作用,本实验以0.4 mmol·L-1油酸来构建建鲤原代脂肪肝细胞损伤模型,然后用不同浓度的泽泻提取物处理肝细胞24和48 h后,分别收集细胞和细胞培养液,然后测定谷丙转氨酶(GPT)、谷草转氨酶(GOT)、乳酸脱氢酶(LDH)、甘油三酯(TG)、总胆固醇(TC)、碱性磷酸酶(AKP)、胆碱酯酶(CHE)、细胞色素酶P4501A1(CYP1A1)和细胞色素酶P4502E1(CYP2E1)的含量等生化指标以及CYP1A的蛋白表达情况。结果显示,0.4 mmol· L-1的油酸与原代肝细胞共培养48 h可以显著提高肝细胞培养上清中GPT、GOT、TG、TC、AKP、CHE、LDH、CYP1A1和CYP2E1的含量(P<0.01或者P<0.05),可以诱导肝细胞中CYP1A的蛋白表达。将不同浓度的泽泻提取物(0、1、5、10、20、50 μg·mL-1)与脂肪肝细胞共培养24~48 h发现,泽泻提取物能不同程度抑制油酸诱导的GOT、GPT、TG、TC、LDH、AKP、CHE水平和CYP1A1、CYP2E1含量的升高(P<0.01或者P<0.05),不同程度降低肝细胞中CYP1A蛋白表达,以作用时间48 h效果较好。研究证实了泽泻提取物对油酸诱导的鱼类脂肪肝细胞损伤具有保护作用,而泽泻提取物作为鱼类脂肪肝的防治药物还需要进一步的在体研究。
建鲤;肝细胞;油酸;泽泻提取物
随着养殖规模的不断扩大,脂肪肝类疾病在鱼类养殖中普遍发生,有报道称此病不仅仅在淡水鱼类中发生,也存在于海水养殖鱼类中,给养殖户造成了很大困扰[1]。发生脂肪肝疾病鱼类,其肌肉当中脂肪含量也会升高,影响了鱼类肉质品质,如果此病发生在夏季,还会造成鱼类的死亡,给养殖户造成不小的经济损失,影响了水产养殖业的健康发展[2]。国内外关于鱼类脂肪肝疾病有了一定数量的研究报道,在治疗和预防脂肪肝方面也取得了一定成效[3-5],但是,到目前为止还没有发现有效的治疗药物,因此,探寻治疗鱼类脂肪肝疾病的有效药物成为研究者面临的主要挑战。
由于离体培养的原代肝细胞具有培养条件易控制且可以精确模拟在体肝脏生理活动等特点,被广泛应用于药物代谢、脂质代谢、肝癌研究等方面[6-7]。关于原代肝细胞在鱼类上面应用[8-9],还主要是用于药理学方面,也就是通过用化学药物建立肝细胞损伤模型来进行后续筛选保肝药物研究。如曹丽萍等利用四氯化碳构建原代肝细胞损伤来筛选保肝中药[10],卢荣华等用脂肪乳剂来构建草鱼脂肪肝脂变模型[11],而关于利用原代培养的鱼类肝细胞来构建脂肪肝变性模型,尤其是鲤鱼方面还未见相关报道。在本实验中,选用原代培养的建鲤肝细胞作为实验材料有助于研究肝细胞内脂质代谢过程及保肝药物的筛选。
近年来,通过临床试验以及药理学研究,已经筛选了一大批具有保肝作用的中药[12],泽泻提取物就是其中一种。有报道称泽泻提取物具有很好的降血脂作用和保护肝脏的功效[13-14]。在哺乳动物中,泽泻提取物对于化学药物引起的肝损伤具有一定的治疗效果,如朱深银报道泽泻提取物对二甘醇致小鼠肝脏损伤具有明显的保护作用[15]。王振海等报道泽泻对DL-乙硫氨酸引起的大鼠急性肝损伤也具有明显的保护作用[16]。但对于泽泻提取物对水产动物脂肪肝疾病方面的研究还鲜有报道。本实验利用油酸诱导建鲤原代肝细胞脂肪变性,通过western blotting方法检测CYP4501A蛋白表达和一些生化指标的变化来探讨泽泻提取物对建鲤脂肪肝细胞变性的保护作用,为水产保肝药物的筛选提供依据。
1 材料与方法
1.1 试验材料
1.1.1 实验供试鱼建鲤(Cyprinus carpio var.Jian)来自于中国水产科学院淡水渔业研究中心渔场,体质健康无病,取回后饲养于循环水系统中一周,水温设定为27℃,每天投喂2次商品饲料。
1.1.2 药品和试剂L-15培养基、二甲基亚砜(DMSO,细胞级)、0.4%台盼蓝染液、链霉素/青霉素(Streptomycin/penicillin)、0.25%胰蛋白酶及PBS缓冲液购自于Sigma公司(美国);新生胎牛血清(FCS)购自于杭州四季青生物工程材料有限公司公司(中国杭州);谷丙转氨酶(glutamatepyruvate transaminase,GPT)、谷草转氨酶(glutamate oxalate transaminase,GOT)、碱性磷酸酶(alkaline phosphatase,AKP)、乳酸脱氢酶(lactate dehydrogenase,LDH)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、胆碱酯酶(cholinesterase,CHE)等试剂盒购自于南京建成生物工程研究所科技有限公司(中国南京);CYP2E1、CYP1A1试剂盒购自上海酶联生物研究所(中国上海);细胞裂解液及免疫印迹(Western blotting)所需试剂购自于碧云天生物技术研究所(中国南通);泽泻提取物购自南通四海植物提取有限公司(中国南通)。
1.2 试验方法
1.2.1 建鲤原代肝细胞的分离和培养无菌条件下于超净台内取建鲤肝脏,用含双抗的PBS缓冲液进行漂洗,修剪,加入浓度为0.125%的胰蛋白酶消化液,27℃水浴条件下消化10~15 min。过滤,滤液用PBS缓冲液洗3次,采用梯度离心法进行离心5 min,离心转数分别为1100、900和800 r·min-1。离心结束后弃上清,用含有10%新生小牛血清(FCS)的L-15培养基制成细胞悬液,台盼蓝染色法进行细胞存活率检测,计数结束后将细胞接种于24孔培养板中,27℃条件下培养。
1.2.2 泽泻提取物处理脂肪变性肝细胞实验组分别设定空白对照组、模型组、泽泻提取物对照组以及泽泻提取物处理组。用L-15培养基将泽泻提取物稀释为0、1、5、10、20、50 μg·mL-1等浓度,具体分组情况如下。
(1)空白对照组:不添加任何药物处理肝细胞,直接用L-15培养基培养24和48 h后,分别收集24和48 h 2个时间段细胞及培养上清液。
(2)油酸造模组:用含浓度为0.4 mmol·L-1油酸的L-15培养基培养48 h,培养结束后收集细胞及培养上清液。
(3)泽泻提取物对照组:将生长状态良好的肝细胞换用含质量浓度50 μg·mL-1泽泻提取物的L-15培养基培养24和48 h,然后分别收集2个时间段细胞及培养上清液。
(4)泽泻提取物处理组:先将贴壁生长良好的肝细胞与0.4 mmol/L油酸共培养48 h造成脂肪肝变性细胞后,再加入含浓度分别为0、1、5、10、20、50 μg·mL-1泽泻提取物的L-15培养基培养24和48 h,培养结束后分别收集2个时间段细胞及上清培养液。
以上每个试验组均设6个重复孔。收集各组上清液及细胞用于后续生化指标检测及蛋白表达研究。
1.2.3 肝细胞上清培养液中生化指标测定GOT、GPT、TG、TC等试剂盒的测定参照南京建成科技有限公司说明书进行操作。
1.2.4 Elisa法测定肝细胞培养液中CYP2E1、CYP1A1含量水平采用双抗体夹心法测定鱼肝脏中CYP2E1、CYP1A1水平。分别设定空白孔、标准孔、待测样品孔。所加样品要加于酶标孔板底部,尽量不触及孔壁,轻轻晃动均匀。经过孵育、洗涤、加酶标试剂、显色、终止等步骤后,以空白孔调零,450 nm波长处测定各孔吸光度值,然后通过标准曲线计算样品中CYP2E1、CYP1A1含量。
1.2.5 Western blotting方法检测泽泻提取物对脂肪变性肝细胞CYP1A蛋白表达的影响将培养结束后的肝细胞先用PBS清洗后,加入细胞裂解液,震荡混匀,冻融(-20℃),12 000 r·min-1离心10 min,吸取上清液,用于后续免疫印迹实验研究。将待测样本取出后,用双蒸水稀释到相同浓度,然后加入5×蛋白上样缓冲液,于95℃变性仪上变性5 min,冷却后备用。
12%SDS-PAGE胶进行电泳,电泳结束后用Bio-Rad半干转膜仪进行转膜,将转印好的NC膜放入封闭液中4℃过夜,加入一抗CYP1A孵育2 h,洗涤液洗涤3次,每次10 min,然后加入含有碱性磷酸酶标记的二抗继续孵育2 h,结束后洗涤液洗涤3次,每次10 min,NBT/BCIP显色。
1.2.6 数据分析所有数据均用SPSS16.0软件包进行处理。采用One-Way ANOVA检验法进行显著性分析,结果以平均值±标准误表示,以P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 泽泻提取物对建鲤肝细胞培养液中GOT、GPT、LDH、AKP活性的影响
如图1所示,油酸与原代肝细胞共培养后发现,GOT、GPT、LDH和AKP几个经典酶学指标活性值与空白对照组相比,差异极显著(P<0.01)。经过药物泽泻提取物处理后,几个药物浓度组均可以不同程度降低GOT、GPT、LDH和AKP酶的活性值,效果以处理48 h为最佳。泽泻提取物对照组与空白对照组相比,无统计学意义。
2.2 泽泻提取物对建鲤肝细胞中TG和TC含量的影响
由图2所示,油酸作用于肝细胞48 h,肝细胞中TG、TC含量明显升高,与空白对照组相比,差异极显著(P<0.01)。经泽泻提取物作用24和48 h后,TG、TC含量得到不同程度抑制,治疗效果以48 h为佳。其中,泽泻提取物浓度在5 μg·mL-1时降低TC含量,泽泻提取物浓度在20 μg·mL-1时降低肝细胞中TC含量较好。泽泻提取物对照组与空白对照组相比,无差异显著性。
2.3 泽泻提取物对建鲤肝细胞培养液中CHE活性的影响
由图3所示,油酸处理后的肝细胞内CHE活性与空白对照组相比,差异极显著(P<0.01)。加入泽泻提取物与肝细胞共培养后发现,各处理组泽泻提取物均可不同程度降低其活性值,但以作用48 h效果较好。泽泻提取物与空白对照组相比无统计学意义。
2.4 泽泻提取物对建鲤肝细胞培养液中CYP1A1含量的影响
由图4所示,油酸与肝细胞共培养后发现,肝细胞内CYP1A1含量显著升高,与空白对照组相比,差异显著(P<0.05)。加入泽泻提取物处理肝细胞后,各浓度处理组在24 h可以降低肝细胞内CYP1A1含量,但与空白对照组相比,无统计学意义。泽泻提取物处理48 h,浓度为10、20、50 μg· mL-1时,可以显著降低CYP1A1含量,但与空白对照组相比,差异显著(P<0.05)。泽泻提取物对照组与空白对照组相比无明显变化。
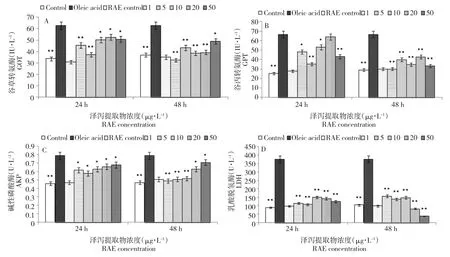
图1 泽泻提取物对油酸致建鲤肝细胞培养液中GOT(A)、GPT(B)、LDH(C)和AKP(D)活性的影响Fig.1Effects of RAE on the activities of GOT(A),GPT(B),LDH(C)and AKP(D)in primary hepatocytes culture medium of Jian Carp
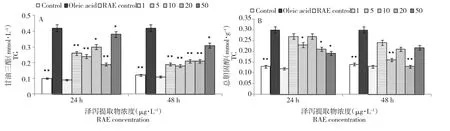
图2 泽泻提取物对油酸致建鲤肝细胞中TG和TC含量的影响Fig.2Effects of RAE on the contents of TG(A)and TC(B)in primary hepatocytes culture medium of Jian carp
2.5 泽泻提取物对建鲤肝细胞培养液中CYP2E1含量的影响
由图5所示,经过油酸处理后,建鲤肝细胞内CYP2E1含量明显升高,与空白对照组相比,差异极显著(P<0.01)。加入泽泻提取物与肝细胞共培养后发现,各浓度处理组均可不同程度降低CYP2E1含量,以作用时间48 h效果最好。泽泻提取物对照组与空白对照组相比无明显变化。
2.6 泽泻提取物对建鲤肝细胞CYP1A蛋白表达的影响
由图6所示,加入不同浓度的泽泻提取物处理脂肪肝变性细胞24 h,CYP1A蛋白表达随着药物浓度的增加减弱,在浓度为10 μg·mL-1时,明显降低。泽泻提取物作用48 h,浓度为在1、5、10 μg· mL-1时,CYP1A表达明显降低。
3 讨论与结论
3.1 利用鱼类肝细胞进行抗脂肪肝药物筛选研究
鱼类脂肪肝的发生原因比较复杂,饲料中营养失衡、抗生素药物的滥用等均可导致本病的发生[17-18]。鱼类脂肪主要蓄积在皮下、肝脏等部位,当肝脏不能够及时将多余脂肪转运出去,就会造成肝脏的代谢功能出现紊乱,引起鱼类脂肪肝疾病的发生。发生脂肪肝疾病的鱼肉品质以及在高温季节鱼类的抗应激能力都会出现下降,严重影响到了鱼类养殖户的效益以及养殖业的健康发展[19],因此,鱼类脂肪肝的防治研究引起了广泛关注。利用原代培养的肝细胞来模拟鱼类脂肪肝损伤,具有很多优点,如细胞的培养条件可控、实验周期短、成本低、能有效避免外界因素对实验所造成的影响,而且可以比较准确模拟在体鱼生理状态。在国内外关于药物筛选以及动物发病机制方面研究,细胞培养得到了广泛应用[20-23]。本实验旨在利用油酸作为脂肪肝细胞变性诱导剂,探究泽泻提取物对原代脂肪肝细胞变性的保护作用。
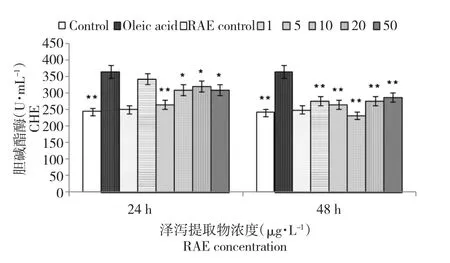
图3 泽泻提取物对油酸致建鲤肝细胞培养液中CHE活性的影响Fig.3Effects of RAE on the activity of CHE in primary hepatocytes culture medium of Jian carp
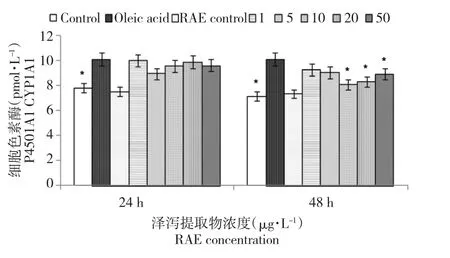
图4 泽泻提取物对油酸致建鲤肝细胞培养液中CYP1A1含量的影响Fig.4Effects of RAE on the amounts of CYP1A1 in primary hepatocytes culture medium of Jian Carp
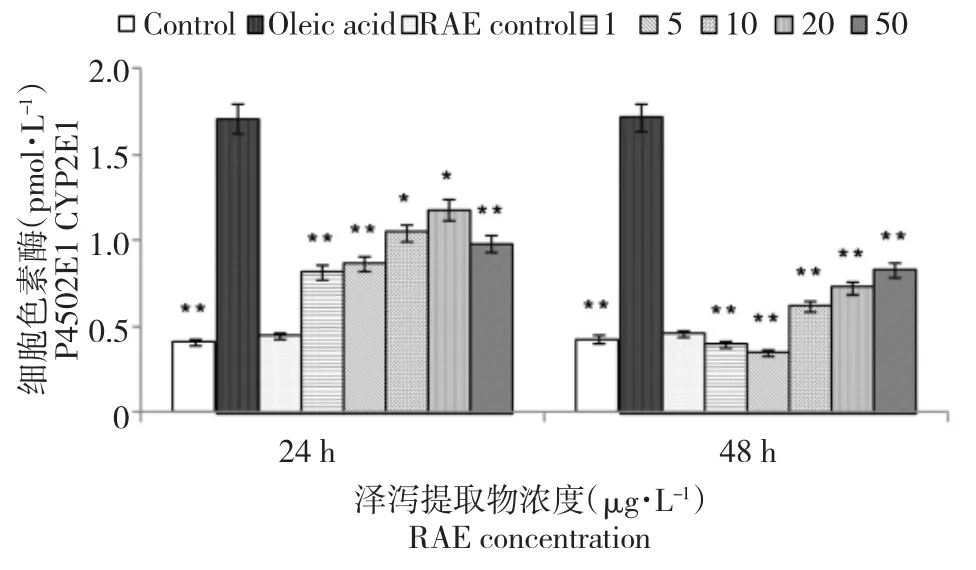
图5 泽泻提取物对油酸致建鲤肝细胞培养液中CYP2E1含量的影响Fig.5Effects of RAE on the amounts of CYP2E1 in primary hepatocytes culture medium of Jian Carp
3.2 泽泻提取物对原代肝细胞GPT、GOT、LDH、AKP活性的影响
GOT、GPT、LDH、AKP是肝脏疾病检查过程中常用指标,正常情况下,其活性值很低,当肝脏呈现病理状态时,肝细胞膜的通透性就会增加,这几个酶指标就会从肝细胞分泌出来[24-25]。由于肝细胞膜受损,细胞膜的正常功能受到影响,细胞内电解质失衡,尤其是细胞内钙离子失衡,钙离子在肝细胞过多聚集,导致了肝细胞的脂肪变性,甚至坏死的发生。在本实验中,经油酸作用后,肝细胞上清培养液中GOT、GPT、LDH、AKP4种酶活性值显著升高,说明油酸成功诱导了脂肪肝细胞变性。加入泽泻提取物后,四种酶活性值升高趋势得到抑制。类似结果在大鼠中也有相关报道,王振海等[16]在研究泽泻对DL-乙硫氨酸引起大鼠肝脏损伤的保护作用中发现,泽泻可以降低肝细胞中转氨酶的升高。这说明泽泻提取物可以提高肝微粒体膜的活性,修复受损伤的肝细胞膜,恢复细胞膜的正常功能。
3.3 泽泻提取物对原代肝细胞TG、TC含量的影响
肝脏是脂质代谢的重要场所,能够合成和储存各种脂类,满足机体需要。在哺乳动物脂肪肝研究方面,有研究证明,动物脂肪肝疾病发生,主要是由于体内脂质代谢失衡导致大量甘油三酯在肝脏内聚集而发病[26]。将肝细胞中TG、TC含量测定作为油酸诱导脂肪肝细胞变性以及药物治疗脂肪肝疗效判定的指标,可直接反映脂类物质在肝脏内代谢、沉积的情况,通过观察这两个指标可以客观、合理地反映出泽泻提取物对油酸诱导的脂肪肝细胞变性真实的保护作用效果。在本实验中,油酸与肝细胞共培养后,肝细胞TG、TC含量与空白对照组相比差异极显著(P<0.01)。加入泽泻提取物后,泽泻提取物可以不同程度降低肝细胞内TG、TC含量,这说明泽泻提取物在降低血脂和治疗脂肪肝变性方面具有较好的效果。其具体保护作用机制可能与其含有的胆碱以及卵磷脂等成分有关系[27]。
3.4 泽泻提取物对原代肝细胞CHE含量的影响
胆碱酯酶(cholinesterase)是一类由肝脏合成而分泌入血的糖蛋白,主要分为乙酰胆碱酯酶和羟基胆碱酯酶。在临床中,测定血清中胆碱酯酶活性是诊断和评估肝实质细胞损害的重要手段,发生脂肪肝疾病会使乙酰胆碱在肝脏内过多聚集,导致胆碱酯酶水解乙酰胆碱出现障碍[28]。有报道称,脂肪肝患者CHE平均水平较正常对照组比较显著升高,是脂肪肝患者又一突出的生化指标[29]。在本实验中,油酸处理后的肝细胞胆碱酯酶水平较空白对照组相比极显著升高,与前人报道结果相同。加入中药泽泻提取物后48 h,肝细胞内胆碱酯酶水平出现了显著下降。这说明泽泻提取物恢复了胆碱酯酶活性,抑制了乙酰胆碱在肝细胞内的聚集。

图6 泽泻提取物对肝细胞中CYP1A蛋白表达的影响Fig.6CYP1A expression in primary hepatocytes of Jian Carp induced by RAE
3.5 泽泻提取物对原代肝细胞CYP1A1和CYP2E1含量及CYP1A1蛋白表达的影响
细胞色素酶P450是存在于肝脏内重要的药物代谢酶,主要参与了内源性物质和外源性物质在肝脏内的代谢,在新药研发方面发挥着重要作用,而CYP1A1和CYP2E1其中2个主要的亚型[30-31]。有国内外文献报道称,在非酒精性脂肪肝发病过程中CYP1A1经游离脂肪酸诱导活性会有升高趋势[32];有文献报道称,发生肝脏损伤和脂肪肝疾病时,CYP2E1的表达与活性会发生相应的变化[33],这说明CYP1A1和CYP2E1参与了脂肪肝疾病的形成。有研究表明脂肪肝的形成主要是由于机体内氧化应激和脂质过氧化过程的影响,CYP450酶系统参与了此过程,抑制抗氧化酶系发挥保护作用[34]。在本实验中,油酸处理过后的CYP1A1和CYP2E1含量显著升高,CYP1A1蛋白表达也相应增强,这说明油酸诱导脂肪肝损伤后,导致了细胞色素酶P450含量的增加。加入泽泻提取物后,CYP1A1和CYP2E1含量以及CYP1A1蛋白表达,均不同程度出现了降低现象,这说明药物抑制了机体内氧化应激产物以及脂质过氧化物的产生,保护肝脏受到外界物质的损害。
当前,鱼类脂肪肝疾病是我国水产养殖业多发病之一,是我国水产科技工作者面临的一项重要课题。本研究利用油酸成功复制了脂肪肝细胞损伤模型,并以此模型开展了抗脂肪肝药物筛选工作,经泽泻提取物处理后,肝脏中转氨酶指标、甘油三酯、总胆固醇以及细胞色素酶P450含量及蛋白表达均出现不同程度升高或降低,以48 h处理效果最佳,分析其保护机制可能与其调节肝微粒体膜活性,修复油酸对肝细胞膜造成的损害,调节药物代谢酶P450水平,使肝细胞恢复对脂肪的代谢功能等有关,关于中药泽泻提取物的具体保护机制还有待于进一步研究。
[1]王兴强,段青源,麦康森,等.养殖鱼类脂肪肝研究概况[J].海洋科学,2002,26(7):36-39.
[2]黄春红,肖调义,胡毅,等.养殖鱼类脂肪肝研究现状分析[J].动物营养学报,2014,26(7):1715-1722.
[3]张水波.鱼类脂肪肝的成因及防治对策[J].中国水产,2011,(2):55.
[4]杨鸿昆,黄凯,阮栋俭,等.养殖鱼类脂肪肝及防治研究进展[J].水利渔业,2007,27(1):4-6.
[5]Du ZY,Clouet P,Degrace P,et al.Hypolipidaemic effects of fenofibrate and fasting in the herbivorous grass carp(Ctenopharyngodon idella)fed a high-fat diet[J].The British Journal of Nutrition,2008,100(6):1200-12.
[6]罗丹,刘华钢.原代肝细胞的分离培养及其在药物研发中的应用[J].广西科学,2006,13(4):334-337,341.
[7]牟卉卉,胡康洪.原代肝细胞分离培养技术现状及展望[J].世界华人消化杂志,2009,17(21):2164-2170.
[8]贾睿,曹丽萍,丁炜东,等.鱼类肝细胞分离、原代培养与应用研究综述[J].江西农业大学学报,2012,34(1):147-157.
[9]于淼,管华诗,郭华荣,等.鱼类细胞培养及其应用[J].海洋科学,2003,27(3):4-8.
[10]曹丽萍,贾睿,丁炜东,等.建鲤体内外急性肝损伤模型的建立[J].安徽农业大学学报,2012,39(6):885-889.
[11]卢荣华,梁旭方,孙君君,等.草鱼肝细胞脂变模型的建立及脂代谢基因表达分析[J].中国水产科学,2015(1):24-32.
[12]韩景兰,李晓萍,刘翠红,等.保肝中药研究进展[J].中医药信息,2001,18(2):22-23.
[13]尹仁杰,吴继洲.泽泻的研究进展[J].医药导报,2003,22(5): 295-296.
[14]李淑子,金在久,张善玉,等.泽泻不同提取物对高脂血症小鼠血脂及脂质过氧化的影响[J].中国实用医药,2008,32(3):7-9.
[15]朱深银,周远大,杜冠华,等.大黄和泽泻提取物对二甘醇致小鼠肝脏损伤的保护作用[J].重庆医科大学学报,2009,34(2): 212-215.
[16]王振海,安锡忠,任增超,等.泽泻对大鼠急性肝脏损伤的保护作用[J].中国动物检疫,2010,27(9):56-57.
[17]张强,杨帆.鱼类脂肪肝成因[J].饲料广角,2012(4):43-46.
[18]肖培弘.鱼类脂肪肝的成因及防治对策[J].河北渔业,2005,(2):44-45.
[19]宋萍.鱼类营养性疾病[J].科学养鱼,2013(3):90.
[20]Ma Y,Sachdeva K,Liu J,et al.Desmethoxyyangonin and dihydromethysticin are two major pharmacological kavalactones with marked activityon the induction of CYP3A23[J].Drug metabolism and disposition:the biological fate of chemicals,2004,32(11):1317-24.
[21]Yin G J,Wang J H,Cao L P,et al.In vitro protective effect of Schisandra chinensis extract against carbon tetrachloride-induced hepatotoxicity in common carp(Cyprinus carpio)[J].African Journal of Pharmacy and Pharmacology,2013,7(33):2313-2320.
[22]Weiss J,Sauer A,Frank A,et al.Extracts and kavalactones of Piper methysticum G.Forst(kava-kava)inhibit P-glycoprotein in vitro[J].Drug metabolism and disposition:the biological fate of chemicals,2005,33(11):1580-1583.
[23]贾袁媛,沈钰明,伍义行,等.基于鸭胚原代肝细胞的抗乙肝病毒药物评价模型的建立[J].安徽农业科学,2013(14):6276-6279.
[24]Liu Y J,Cao L P,Du J L,et al.Protective effects of Lycium barbarum polysaccharides against carbon tetrachloride-induced hepatotoxicity in precision-cut liver slices in vitro and in vivo in common carp(Cyprinus carpio L.)[J].Comparative Biochemistry and Physiology C-Toxicology&Pharmacology,2015,169:65-72.
[25]Jia R,Du J L,Cao L P,et al.Hepatoprotective and antioxidant effects of phyllanthin against carbon tetrachloride-induced liver injury in Cyprinus carpio[J].Aquaculture International,2015,23:883-89.
[26]王卓然,张秀英.非酒精性脂肪肝细胞损伤机制的研究进展[J].中国兽医杂志,2012,48(1):50-52.
[27]付涛.泽泻汤降血脂、抗氧化及保肝作用有效部位的研究[D].湖北中医药大学,2012:18-28.
[28]周林华,段慧英,邓德耀,等.血清前清蛋白和胆碱酯酶在肝损伤中的临床价值[J].检验医学与临床,2009,6(19):1639-1640.
[29]张立辉,杨黎明.血清胆碱酯酶(CHE)在肝功测定中的应用[J].黑龙江医药,2001,14(4):329.
[30]Shizu R,Numazawa S,Yoshida T.Involvement of miroRNA in the induction of drug-metabolizing enzymes[J].Yakugaku zasshi-Journal of the Pharmaceutical Society of Japan,2012,132(3):311-318.
[31]Mrozikiewicz P M,Grzeskowiak E,Seremak-Mrozikiewicz A.Importance of CYP1A1 polymorphism and its transcriptional regulation in ovarian and endometrial cancer[J].Ginekologia Polska.,2011,82 (12):925-932.
[32]谭丽.CYP1A1及相关因子与脂肪肝发病的可能关系及维生素E、亚硒酸钠干预作用的探讨[D].重庆医科大学,2007:28-32.
[33]史洪涛,陈东风,李陶,等..非酒精性脂肪肝大鼠肝细胞色素P4502E1基因及表达变化的意义[J].中华肝脏病杂志,2005,13(2):154-155.
[34]Yang S Q,Zhu H,Li Y.Mitochondrial adaptation to obesity related oxidant stress[J].Archives of Biochemistry and Biophysics,2000,378(2):259-268.
(责任编辑 李洁)
Effects of Rhizoma Alismatis Extract on Biochemical Index and CYP1A Protein Expression of Hepatocyte Steatosis Injury Induced by Oleic Acid in Jian Carp(Cyprinus carpio var.Jian)
DU Jin-liang1,2,CAO Li-ping1,2,JIA Rui3,XU Pao1,2,3*,YIN Guo-jun1,2,3*
(1.Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization,Ministry of Agriculture,Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences,Jiangsu Wuxi 214081,China;2.International Joint Research Laboratory for Fish Immunopharmacology,Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences,Jiangsu Wuxi 214081,China;3.Wuxi Fisheries College,Nanjing Agricultural University,Jiangsu Wuxi 214081,China)
Fish fatty liver is one of increasingly serious diseases in aquaculture,it has become more and more serious in China aquaculture,In recent years,the incidence of fatty liver in fish had an increasing trend,but the occurrence mechanism of the fatty liver was still not very clear.Cytochrome P450 enzymes were the main oxidases metabolic enzymes in the liver microsome and played a very important role in the liver metabolism.However,no effective methods have been found for the prevention and treatment of this disease.The present study aimed to develop an in vitro model of hepatocyte steatosis using oleic acid as hepatotoxicant and evaluate the protective effects of Rhizoma Alismatis extracts against oleic acid induced hepatocyte steatosis in Jian carp.The primary cultured hepatocytes in Jian Carp were isolated and purified by trypsin digestion,cultured in vitro.The activities of glutamatepyruvate transaminase(GPT),aspertate aminotransferase(GOT),triglycerides(TG),total cholesterol(TC),alkaline phosphatase(AKP),cholinesterase(CHE),lactate dehydrogenase(LDH)were detected.The content of enzyme cytochrome P4501A1(CYP1A1)and enzyme cytochrome P4502E1 were detected by double antibody sandwich ELISA method.CYP1A expression in the hepatocytes was analyzed by Western blot method.The results showed,the hepatocytes of Jian Carp grew well and had a good morphology,and they could be used for investigation of lipid metabolism.Exposure of the hepatocytes to 0.4 mmol/L oleic acid for 48 h,significantly elevated the levels of glutamatepyruvate transaminase(GPT),aspertate aminotransferase(GOT),triglycerides (TG),total cholesterol(TC),alkaline phosphatase(AKP),cholinesterase(CHE),lactate dehydrogenase(LDH),the enzyme cytochrome P4501A1(CYP1A1)and the enzyme cytochrome P4502E1 (P<0.01 or P<0.05).After the primary hepatocytes treatment with five concentrations of Rhizoma Alismatis extract(0,1,5,10,20,50 μg/mL)for 24-48 hours,results showed that Rhizoma Alismatis extract could suppress the elevations of GOT,GPT,TG,TC,LDH,AKP,CHE,CYP1A1,CYP2E1(P<0.01 or P<0.05),and reduced the protein expression of CYP1A to varying degrees,the most optimal action time is 48 h.It can be concluded that Rhizoma Alismatis extract exhibited protective effect against hepatocyte steatosis in Jian carp.Further in vivo studies are needed to provide more evidence for using Rhizoma Alismatis extract as a hepatoprotective agent for the treatment of hepatocyte steatosis.
Jian carp;Hepatocyte;Oleic acid;Rhizoma Alismatis extract
S965.116
A
1001-4829(2017)1-0226-07
10.16213/j.cnki.scjas.2017.1.039
2016-02-25
中央级公益性科研院所基本科研业务费专项资金(2015JBFM01)
杜金梁(1982-),男,河北沧州市人,助理研究员,主要从事临床药理与药物代谢研究工作,E-mail:dujl@ffrc.cn,Tel:0510-85558876,*为通讯作者:殷国俊,E-mail:yingj@ffrc.cn;徐跑,E-mail:xup@ffrc.cn。

