玉米RIL群体SSR分子标记偏分离的遗传分析
[KH-*3D]周汝平,李淑君,杨华,祁志云,董昕,付忠军*
(1.重庆科光种苗有限公司,重庆400060;2.重庆市农业科学院玉米研究所,重庆401329)
玉米RIL群体SSR分子标记偏分离的遗传分析
[KH-*3D]周汝平1,李淑君2,杨华2,祁志云2,董昕2,付忠军2*
(1.重庆科光种苗有限公司,重庆400060;2.重庆市农业科学院玉米研究所,重庆401329)
以热带玉米自交系B31-3与温带自交系黄早四杂交得到的F8代重组自交系群体为材料,筛选出153个多态性SSR标记,以此为基础构建遗传连锁图谱。对这些多态性标记进行偏分离分析,发现48个表现为偏分离(P<0.05),这些偏分离标记中有30个标记位点偏向母本B31-3,占62.50%,18个标记位点偏向父本黄早四,占37.50%。这些偏分离标记在图谱上的分布有2种:成簇分布和孤立位点的偏分离。在10条不同染色体上共发现9个偏分离热点区域。这些偏分离热点区域的形成可能与配子体选择有关。
玉米;偏分离;分子标记;重组自交系
偏分离指的是,某种分离群体中实际观测到的基因型比例偏离预期的孟德尔分离规律的现象[1]。偏分离存在于许多物种中,被看做是生物进化过程中的主要动力之一。产生偏分离的原因可能与配子体或孢子体的选择有关[2],近年来在水稻、小麦、大豆、棉花等不同作物遗传群体,不种遗传标记中均发现了大量偏分离现象[3-6]。在玉米上,偏分离现象也有相关报道[7]。同时,研究发现分子标记连锁图上存在偏分离热点区域,这些区域可能存在偏分离相关的基因[8]。然而,不同作物的不同群体之间,是否存在共同的偏分离热区域,还有待于深入研究。本研究以热带玉米自交系B31-3与温带自交系黄早四杂交得到的F8代重组自交系群体为材料,筛选出153个多态性SSR标记,构建了遗传连锁图谱,并对这些分子标记进行偏分离分析,以期为玉米偏分离规律研究及玉米重要性状的QTL研究提供有益的信息。
1 材料与方法
1.1 材料
供试材料为重庆农业科学院玉米研究所构建的重组自己系群体。以热带玉米持绿自交系B31-3为母本,温带玉米早衰系黄早四为父本配制杂交组合,采用单籽粒传法进行繁殖8代,最终获得201个稳定株系。
1.2 遗传连锁图谱构建
用SDS法提取亲本及RIL群体DNA,选取均匀分布于玉米10条染色体上的SSR引物800对进行多态性分析。用Mapmaker 3.0构建遗传连锁图[9]。
1.3 偏分离分析
利用SSR标记划分RIL群体的基因型,将实际观察值逐一按孟德尔分离的理论比率(1∶1)进行χ2测验,推断是否存在偏分离,并对照亲本基因型,确定偏分离的方向及显著性。
2 结果与分析
2.1 群体基因型组成
选用800对SSR公用引物进行双亲间多态性检测,共获得153个带型清晰,稳定性好的多态性标记。构建了一张覆盖玉米10条染色体的遗传连锁图,总长度为2213.2 cM,标记间平均距离为14.5 cM。根据双亲基因型,对RIL群体201个单株的基因型进行分析。结果表明,每个基因位点来源于母本B31-3的在28.28%~63.78%,来源于父本黄早四的在36.22%~71.72%。对201个群体所有株系的全部标记在双亲基因型的分析结果为:来源于母本B31-3占50.74%,来源于父本黄早四的占49.26%,亲本基因型在群体中的分离比率为1∶1.03,接近于1∶1的孟德尔理论分布比率。
2.2 偏分离标记的分布
对153个多态性标记进行χ2分析,当P<0.05时,共有48个标记表现偏分离,频率为31.37 %,当P<0.01时,有33个标记表现偏分离,频率为21.57%(表1)。在所有48个偏分离标记中,30个标记偏向母本B31-3,占62.50%,18个偏向父本黄早四,占37.50%。
2.3 偏分离热点区域
偏分离标记在连锁群上成簇分布而且偏分离方向一致,所在的染色体区段被称为偏分离热点区域(segregation distortion region,SDR)。在这些区域,大部分临近的偏分离标记朝同方向发生偏分离。本研究共检测到9个偏分离热点区域,分别命名为SDR1-1,SDR1-2,SDR1-3,SDR2,SDR4,SDR6-1,SDR6-2,SDR8-1,SDR8-2,这9个偏分离热点区域的偏分离标记数分别为4、2、2、2、5、6、2、5和3个,在这些热点区域,SDR1-3,SDR2,SDR4区域的所有偏分离标记位点都偏向父本黄早四,另外5个区域的所有偏分离标记位点都偏向母本B31-3。这些偏分离标记在图谱上有2种分布形式:分别为孤立位点的偏分离和成簇分布(图1)。
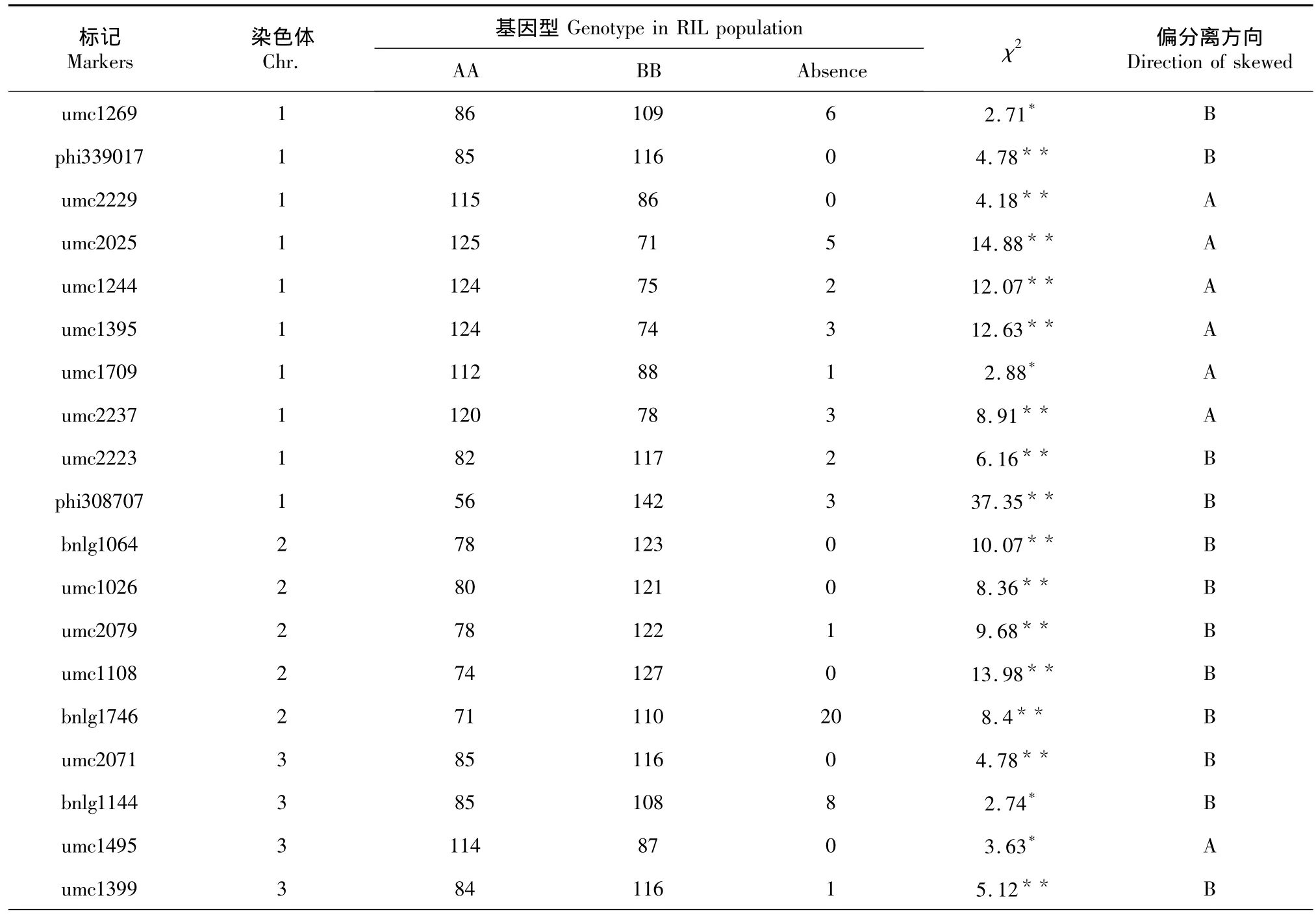
表1 标记偏分离χ2检验结果Table 1Chisquare test for segregation distortion of markers in RIL population
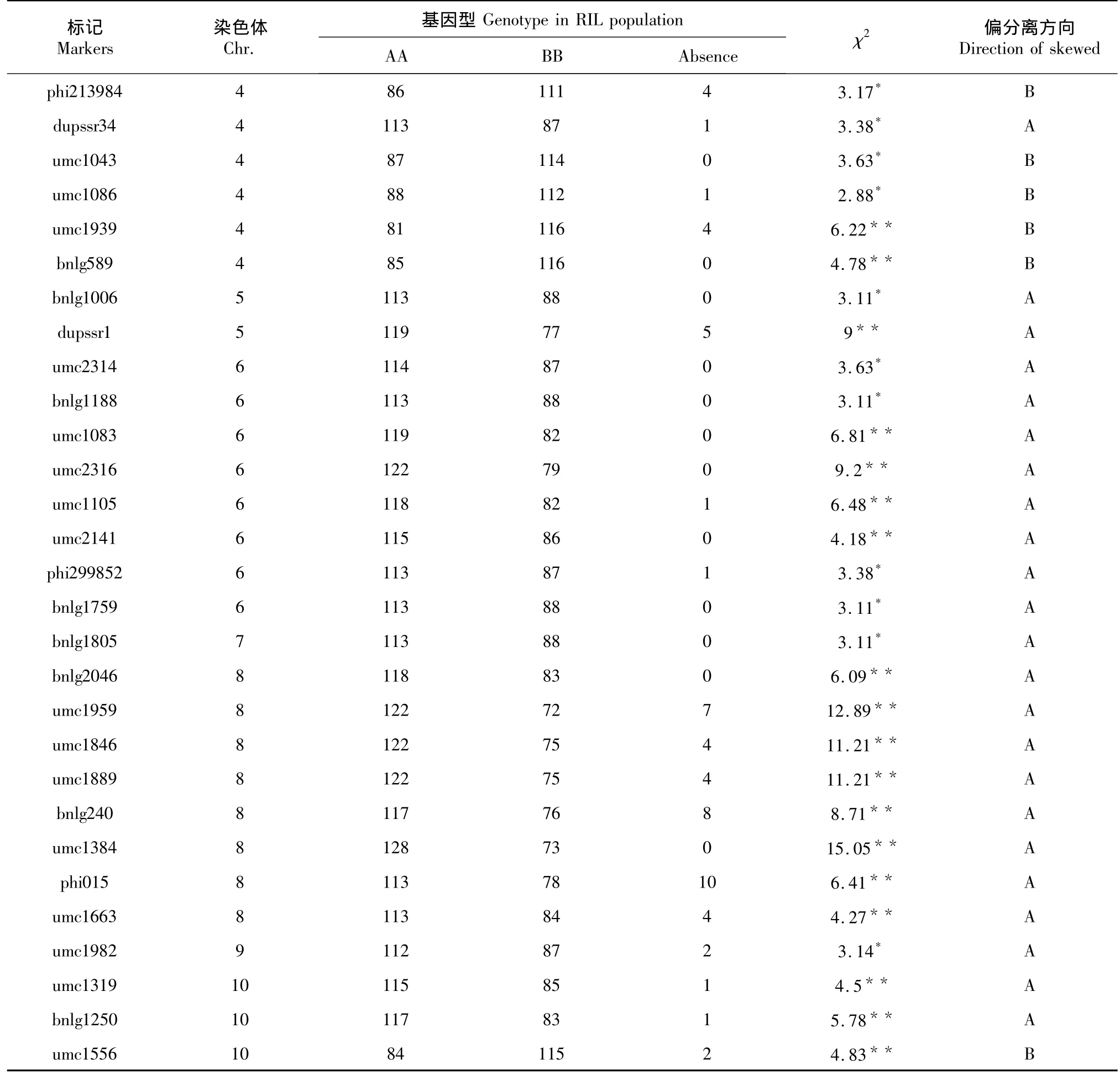
续表1 Continued table 1
3 讨论与结论
3.1 不同群体偏分离比较
Xu等[10]研究发现,与其他群体相比,水稻RIL群体有更高的偏分离频率(39.4%),DH (doubled hap loid)群体和BC(backcross)群体的偏分离比例几乎相同(DH,29.4%;BC,28.6%),而F2群体则较低(19.3%)[10]。严建兵等[7]用F2群体观察到的偏分离频率为28.1%,Austin和Lee[11]在玉米RIL群体中观察到偏分离频率为29 %。本研究中有48个标记表现偏分离,比例较高,为31.37%;从偏分离位点上看,每个群体都存在两种情况,孤立分布和热点区域。严建兵等[7]在构建的连锁图谱上发现,除8染色体外,其余9条染色体上都存在偏分离热点区域,其中1、3、4、6、7号染色体上都存在2个热点区域,Austin和Lee等[11]的研究则分布在1、4、7染色体上,本研究中发现的热点区域分布在1、2、4、6和8号染色体上。这些结果表明偏分离与作物种类、群体类型等都有很大关联。
3.2 偏分离产生原因
水稻、玉米等作物中发现,偏分离热点区域与已经定位的配子体基因的位置有较好的对应关系,推测配子体基因型选择是导致偏分离的主要原因[10,12]。目前在水稻中已经鉴定出13个配子体基因,玉米中也定位了5个配子体基因[13-14]。本研究发现的9个偏分离热点区域中6个偏向母本B31-3,3个偏向父本黄早四,推测这些偏分离热点区域可能存在配子体基因。但由于RIL群体经过多代重组与选择,偏分离的发生在什么时间?是否受其他因素影响?需要做进一步研究。
3.3 偏分离对QTL定位的影响
构建分子标记连锁图的一个重要目的是进行QTL定位。偏分离可以影响标记间的重组距离,也影响连锁群上标记的顺序,进而影响QTL定位。Lu等[1]认为如果偏分离是因为单个基因导致的,如配子体基因,对QTL定位的位置不会产生影响。而如果偏分离是因为两个或者以上的基因引起的,情况则比较复杂。在构建连锁图时,将偏分离标记剔除是最简单的克服方法,但会降低图谱基因组的覆盖率,可能会检测不到某些QTL。有人提出先利用正常分离的标记进行作图,再将偏分离标记添加进去,根据对原来图谱的影响大小来决定是否保留这些偏分离标记[15]。但目前还没有判断影响大小的明确标准,关于偏分离影响有待进一步研究。
[1]Lu H,Romero-Severson J,Bernardo R.Chromosomal regions associated with segregation distortion in maize[J].Theoretical and Applied Genetics,2002,105:622-628.
[2]Lyttle T W.Segregation distorter[J].Annual Review of Genetics,1991,25:511-557.
[3]陈庆全,张玉山.籼型水稻SSR标记遗传连锁图谱的构建及偏分离分析[J].分子植物育种,2009,7(4):685-689.
[4]陈佳慧,兰进好,王晖,等.小麦RIL群体SSR分子标记偏分离的遗传分析[J].麦类作物学报,2011,31(3):407-410.
[5]刘峰,吴晓蕾,陈受宜.大豆分子标记在RIL群体中的偏分离分析[J].遗传学报,2000,27(10):883-887.
[6]余渝,张艳欣,林忠旭,等.棉花种间BC1群体偏分离的遗传剖析[J].作物学报,2010,36(10):1657-1665.
[7]严建斌,汤严,黄益勤,等.玉米F2群体分子标记偏分离的遗传分析[J].遗传学报,2003,30(10):913-918.
[8]Perfegtti F,Pascual L.Segregation distortion of isozyme loci in cherimoya(Annona cherimola Mill.)[J].Theor Appl Genet,1996,93 (3):440-446.
[9]Lincoln S,Daly M,Lander E.Mapping genetic mapping with MAPMAKEREXP 3.0.Cambridge:MA:Whitehead institute Technical Report,1992.
[10]Xu Y,Zhu L,Xiao J,HuangN,et al.Chromosomal regions associated with segregation distortion of molecular markers in F2back-cross double hap loid and recombinant inbred populations in rice(Oryza sativa L.)[J].Molecular and General Genetics,1997,253:535-545.
[11]Austin D F,Lee M.Comparative mapping in F2∶3and F6∶7generat ions of quant it ative trait loci for grain yield and yield components in maize[J].Theor Appl Genet,1996,92:817-826.
[12]Lu H,Romero-Severson J,Bernardo R.Chromosomal regions associated with segregation distortion in maize[J].Theoretical and Applied Genetics,2002,105:622-628.
[13]Cheng R,Saito A,Takano Y et al.Estimation of theposition and effect of a lethal factor locus on a molecular marker linkage map[J].Theoretical and Applied Genetics,1996,93:494-502.
[14]Coe E H,Polacco M.Maize Genetics Cooperation Newsletter[J].Gene List and Working Maps,1995,694:157-191.
[15]宋宪亮,孙学振,张天真.偏分离及对植物遗传作图的影响[J].农业生物技术学报,14(2):286-292.
(责任编辑 李山云)
Genetic Analysis of Segregation Distortion of Molecular Markers in Maize RIL Population
ZHOU Ru-ping1,LI Shu-jun2,YANG Hua2,QI Zhi-yun2,DONG Xin2,FU Zhong-jun2*
(1.Chongqing Keguang Seed Co.,Ltd.,Chongqing 400060,China;2.Maize Research Institute,Chongqing Academy of Agricultural Sciences,Chongqing 401329,China)
A RIL population was used in this study,which derived from a cross between a temperate maize germplasm inbred line B31-1 and a tropical maize germplasm inbred lines Huangzao4.A genetic linkage map was constructed comprising of 153 polymorphic markers.Among the 153 polymorphic markers,82 markers showed the significant segregation distortion(P<0.05),favoring either the marker alleles of female parent B31-1(62.50%)or male parent Huangzao4(37.50%).Segregation distortion marker distribution along the present molecular maps of maize was far from uniform,with clusters of tightly linked loci and single marker.Nine egregation distortion regions were detected on 10 chromosomes,indicating that possible causes for segregation deviation of molecular markers are gametic selection
Maize;Segregation distortion;Molecular markers;RIL
S513
A
1001-4829(2017)1-0015-05
10.16213/j.cnki.scjas.2017.1.004
2016-02-06
2016重庆市基础科学与前沿技术研究专项“青贮玉米持绿性关键基因鉴定与特异分子标记开发”(cstc2016 jcyjA0116);2016国家重点研发计划“‘粮食丰产增效科技创新’子课题‘西南区优质高产青贮玉米品种筛选与机械化高效生产技术’”(2016YFD030030901);2016重庆市社会事业与民生保障科技创新专项“青饲青贮玉米新品种商业化育种创新”(cstc2016shms-ztzx0035);2015年重庆市基本科研业务费“富硒玉米种质资源鉴定与利用评价”;2016年重庆市基本科研业务费“玉米籽粒硒积累关键基因发掘与应用”;2016重庆市社会民生科技创新专项“耐荫玉米种质的创制及应用研究”(cstc2016 shmszx80031)
周汝平(1969-),男,高级农艺师,主要从事玉米遗传育种与科技推广,Tel:023-62911104,E-mail:975476673@qq.com,*为通讯作者。

